Синдром высвобождения цитокинов, также называемый «цитокиновым штормом», является одним из основных осложнений новой коронавирусной инфекции, которое ассоциировано с неблагоприятным исходом заболевания. Лекарственное средство тоцилизумаб, используемое ранее для лечения заболеваний с вовлечением иммунного механизма, было предложено для смягчения синдрома высвобождения цитокинов.
Ключевые слова: коронавирусная инфекция, рекомбинантные антитела, интерлейкин-6.
Актуальность. Поскольку определение уровня интерлейкина-6 в крови пациента является дорогим, не всегда доступным и не информативным при раннем прогрессировании синдрома высвобождения цитокинов методом, существуют иные критерии, позволяющие заподозрить данное состояние. К ним относится отягощение течения пневмонии до 3–4 стадии, сопровождающейся снижением SpO2≤94 %, нарастающая лихорадка и повышение содержания лабораторных маркеров воспаления: С-реактивного белка, ферритина, фибриногена, а также D-димеров [1].
При оценке возможного прогноза у пациентов, помимо лабораторных, важное значение имеют также их базовые показатели: возраст, пол, ИМТ, наличие сопутствующих заболеваний, группа крови [2]. Считается, что наиболее предрасполагающими к тяжелому течению показателями являются более старший возраст, повышенной индекс массы тела (>28 кг/м2) и наличие коморбидности [3]. Например, мужчины более уязвимы к тяжелому течению COVID-19 за счет социальных факторов: более высоким, чем у женщин, фактором стресса, включающим курение и употребление алкоголя, а не биологической детерминантой [4]. Гипотеза о влиянии группы крови на течение COVID-19 подвергается разным оценкам и требует дальнейшего тщательного изучения [1].
Тоцилизумаб используется для патогенетического лечения синдрома высвобождения цитокинов при COVID-19. Существуют мнения с негативной оценкой применения данного средства в связи с его невысокой эффективностью [5], другие же демонстрируют результаты по улучшению выживаемости и шансам выписки из стационара, а также по снижению вероятности прогрессирования заболевания и необходимости искусственной вентиляции легких [6].
Тем не менее главным в этом вопросе является определения срока назначения препарата. При оценке клинико-лабораторного течения наблюдались снижение уровня С-реактивного белка через 3, 7 и 14 дней после введения тоцилизумаба (по сравнению с пациентами, которые не получали тоцилизумаб); связь между изменениями положительного давления в конце выдоха или парциального давления O₂ в показателях артериальной крови [3].
Одной из проблем, связанных с применением тоцилизумаба у пациентов с COVID-19, считается риск вторичной инфекции. В качестве осложнений выделяют бактериальную пневмонию, отит, бактериемию Staphylococcus aureus и абсцесс легкого, все из которых, следует отметить, достаточно хорошо отвечают на стандартную антибактериальную терапию [6].
Цель: Установить клинико-лабораторные особенности течения коронавирусной инфекции у пациентов, получивших лечение тоцилизумабом.
Задачи:
- Оценить базовые показатели (пол, возраст, вес, коморбидность и группу крови АВO) и данные лабораторных показателей до и сутки после введения препарата у пациентов с благоприятным и неблагоприятным исходами;
- Выполнить статистический анализ полученных данных и поиск статистически значимых предикторов исхода.
Материал и методы исследования . Было выполнено исследование с участием 101 пациента, которые получали лечение по поводу коронавирусной инфекции и имели различные исходы для жизни. Базовые характеристики изучаемой группы включали: возраст Me 69 (62; 77) лет, вес 87 (74; 103) кг, количество мужчин, равное 60 (59,4 %), и женщин — равное 41 (40,6 %), группа крови O в 26 случаях (28 %), положительный резус-фактор (Rh+) в 73 случаях (78,5 %) и отрицательный (Rh-) — в 20 (21,5 %).
Введение тоцилизумаба наиболее часто осуществлялось на 5 (3; 9) день заболевания. Решение о назначении тоцилизумаба принималось врачебным консилиумом согласно критериям, установленными приказами Министерства здравоохранения Республики Беларусь.
Различия считались статистически значимыми при р<0,05. Количественные показатели представлены в виде медианы (Me) и межквартильного размаха, категориальные переменные представлены в виде процентов и частот в группах. Количественные переменные сравнивались с применением критерия Уилкоксона, категориальные — с помощью критерия хи-квадрат и точного критерия Фишера. Статистический анализ выполнен с использованием статистического пакета R 4.0.3.
Результаты исследования и их обсуждение. Среди базовых показателей выявлены статистически значимые различия в медианах возраста в зависимости от исхода заболевания: 68 (61; 72) лет у пациентов с летальным исходом против 61 (52; 69) года у выписанных пациентов, (p=0,001), что свидетельствует в пользу более молодого возраста среди пациентов с благоприятным исходом; в соотношении пациентов с группой крови O по сравнению с другими группами крови в зависимости от исхода заболевания (25 % против 48,6 % соответственно, p=0,031).
За сутки до введения тоцилизумаба у пациентов с благоприятным исходом наблюдалась большая продолжительность АЧТВ: 34 (32; 39) секунд против 30 (29; 34) секунд у пациентов с летальным исходом, p=0,006) и меньший показатель уровня мочевины (5,02 (4,14; 6,88) ммоль/л против 6,34 (5,80; 8,37) ммоль/л соответственно, p=0,019).
Спустя сутки после введения различия СРБ по медианам среди групп нет (125 (41; 162) мг/л против 102 (56; 150) мг/л у выздоровевших, p=0,5), однако в обеих группах наблюдается последующая тенденция к значительному снижению показателя (47 (15; 80) мг/л против 47 (20; 79) мг/л у выздоровевших).
После введения тоцилизумаба выявлены статистически значимые различия по содержанию лейкоцитов 6,5 (4,0; 9,2) *10⁹/л у выживших против 8,9 (5,4; 12,2) *10⁹/л у пациентов с летальным исходом, p=0,011), лимфоцитов (0,86 (0,49; 1,13) *10⁹/л против 0,41 (0,25; 0,74) *10⁹/л соответственно, p<0,001), КФК-МБ (19 (15; 34) Ед/л против 13 (9; 20) Ед/л соответственно, p=0,028), альбумина (30,7 (27,7; 33,6) г/л про-тив 28,5 (25,9; 30,4) г/л соответственно, p=0,013) и мочевины (5,5 (4,5; 6,5) ммоль/л против 6,9 (5,1; 11,8) ммоль/л соответственно, p=0,005).
У пациентов с неблагоприятным исходом выявлены статистически значимые различия по содержанию (с тенденцией к росту при динамическом наблюдении) спустя сутки после введения тоцилизумаба таких показателей, как D-димеры (625 (418; 1,050) нг/мл против 385 (288; 540) нг/мл у выздоровевших, p=0,007) и ЛДГ (838 (700; 1,037) Ед/л против 697 (623; 791) Ед/л у пациентов с благоприятным исходом, p=0,006). Через двое суток после введения тоцилизумаба наблюдалось дальнейшее снижение содержания лимфоцитов в группе неблагоприятного исхода (до 0,47 (0,28; 0,75) *10⁹/л).
Были выявлены предикторы исходов с помощью обобщенных линейных моделей с использованием возраста и пола в качестве контролируемых показателей, продемонстрированные в таблице 1.
Таблица 1
Статистически значимые предикторы по результатам построения обобщенных линейных моделей
|
Предиктор |
β |
ОШ |
95 % ДИ ОШ |
p |
|
|
Контролируемые показатели |
Лимфоциты |
-0,84 |
0,43 |
0,18–0,94 |
0,04 |
|
Лактат |
0,97 |
2,66 |
1,23–6,8 |
0,02 |
|
|
Возраст, пол |
Мочевина |
0,33 |
1,03 |
1,06–1,9 |
0,03 |
|
Альбумин |
-0,26 |
0,78 |
0,6–0,96 |
0,03 |
Статистически значимыми предикторами развития «цитокинового шторма» и неблагоприятного исхода в итоге оказались уровни лимфоцитов, лактата, мочевины и альбумина.
Посредством уравнения логистической регрессии: y = -5,86 + 0,1* [возраст, лет] — 0,18* [мужск. пол] — 0,85* [лимфоциты, *10⁹/л], лимфоциты были определены как статистически значимые предикторы неблагоприятного исхода, что иллюстрирует рис. 1.
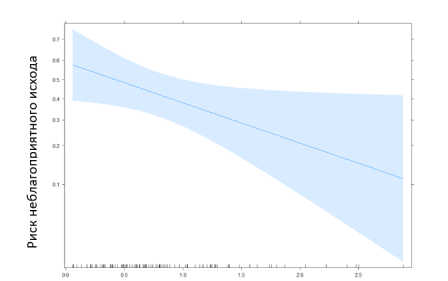
Рис. 1. Эффект лимфоцитов на риск неблагоприятного исхода
Уравнение логистической регрессии: y = -5,71 + 0,05* [возраст, лет] — 0,13* [мужск. пол] — 0,98* [лактат, ммоль/л] также определяет лактат как риск неблагоприятного исхода, что демонстрирует рис. 2.
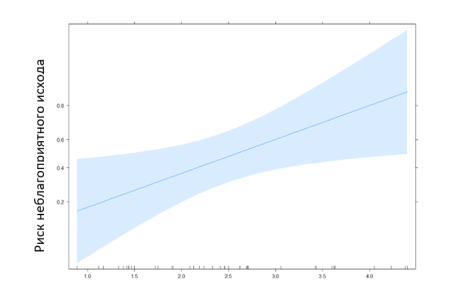
Рис. 2. Эффект лактата на риск неблагоприятного исхода
Выводы:
- У пациентов с неблагоприятным исходом отмечаются более высокие уровни ЛДГ, КФК-МБ, лактата, мочевины, Д-димеров, и более низкие уровни — альбумина;
- Установленные клинико-лабораторные особенности течения Covid-19 у пациентов, получивших тоцилизумаб, свидетельствуют о более высоком уровне лейкоцитов за счет преобладания сегментоядерных лейкоцитов и снижения лимфоцитов среди пациентов с летальным исходом;
- По результатам построения обобщенных линейных моделей с контролем возраста и пола (как наиболее распространенных предикторов тяжести COVID-19) независимыми предикторами неблагоприятного исхода являлись: абсолютное содержание лимфоцитов, уровень лактата, мочевины и альбумина;
- Как пациенты с благоприятным исходом, так и пациенты с неблагоприятным исходом имели одинаковое соотношение полов.
Литература:
1. Zietz M. Testing the association between blood type and COVID-19 infection, intubation, and death / Zietz M., Zucker J. // Nature Communications. — 2020. — Vol. 11.
2. Caricchio R. Preliminary predictive criteria for COVID-19 cytokine storm / Caricchio R., Gallucci M., // Annals of the Rheumatic Diseases. — 2020.
3. Gupta. Tocilizumab in COVID-19: some clarity amid controversy / Gupta, Shruti, and David E Leaf. // Lancet (London, England). — 2021. — Vol. 397,10285. — P. 1599–1601.
4. Abate B. Sex difference in coronavirus disease (COVID-19): a systematic review and meta-analysis / Abate B., Kassie A. // BMJ open. — 2020. Vol 10.
5. Salvarani C. Effect of Tocilizumab vs Standard Care on Clinical Worsening in Patients Hospitalized With COVID-19 Pneumonia: A Randomized Clinical Trial / Salvarani C., Dolci G. // JAMA Internal Medi-cine. — 2021. Vol. 181, N 1. — P. 24–31.
6. Salvarani C. Effect of Tocilizumab vs Standard Care on Clinical Worsening in Patients Hospitalized With COVID-19 Pneumonia: A Randomized Clinical Trial / Salvarani C., Dolci G. // JAMA Internal Medi-cine. — 2021. Vol. 181, N 1. — P. 24–31.







