Изучена реакция аминолизе эпоксидов С 10 ,С 12 полициклических мостиковых олефинов диэтиламином, морфолином и пиперидином. Исследованы биоцидные свойства синтезированных полициклических аминоспиртов в качестве антимикробных присадок к моторному маслу М-8 и установлена их эффективность.
Одним из развиваемых направлений нефтехимического синтеза является получение циклических аминоспиртов, поскольку наличие в их молекуле двух функциональных групп и циклического фрагмента создает реальные возможности целенаправленного получения различных, практически полезных продуктов. Аминоспирты, полученные на основе оксиранов с полициклическими мостиковыми фрагментами, могут быть использованы в качестве биологически активных и фармакологических препаратов [1–4], антимикробных, антикоррозийных материалов и антиоксидантов [5, 6]. В частности, аминоспирты и аминокислоты пинанового ряда, полученные из (+) и (-) α-пиненов по методике [7] могут быть базовыми веществами при конструировании новой группы противосудорожных препаратов [8].
Некоторые сведения о получении циклических аминоспиртов приведены в работах [3, 4, 9, 10], согласно которым аминолиз оксиранов существенно зависит от условия проведения реакций. Так, согласно [2], эпоксипроизводные норборнена в отличие от эпоксидов моноциклических непредельных углеводородов, при одинаковых условиях проявляют высокую устойчивость в реакциях аминолиза.
Известно, что в случае раскрытия оксиранового цикла О- и N- нуклеофилами соотношение первичного и вторичного (или вторичного и третичного) аминоспирта определяется правилом Красуского [9], согласно которой раскрытие оксиранового цикла в молекуле эпоксида осуществляется по связи между атомом кислорода и менее замещенным углеродным атомом. При этом выход основного продукта зависит от температуры и, особенно, полярности растворителя [10]. Так, при аминолизе фенилоксирана N,N-диалкилэтилендиамином реакция в отсутствии растворителя практически не протекает. С повышением полярности растворителя выход основного продукта увеличивается. Наибольший выход достигается при использовании изопропилового спирта.
В настоящей работе рассматриваются результаты исследований по аминолизу эпоксидов с три- и тетрациклическими фрагментами, синтезированнами на основе циклопентадиена и норборнена.
Экспериментальная часть
Исходные эпоксиды получены из С 10 -С 12 непредельных углеводородов, синтезированных димеризаций циклопентадиена с последующим гидрированием продукта реакции [11] и [4+2]-циклоприсоединением циклопентадиена с норборненом [12].
Аминолиз эпоксидов проводили в трехгорлом стеклянном реакторе в растворе изопропилового спирта при температуре 40–50° С и продолжительности 6–8 г. Амины были использованы в виде гидрохлоридов, которые под действием гидроксида калия «in situ» превращаются в амины и вступают в реакцию аминолиза. Выход транс-N-алкиламиноспиртов-экзо, эндо-гидрокси N-алкилтрициклодеканов и экзо, эндо- гидрокси-N-алкилтетрациклододеканов достигает 62–80 %.
Синтезированные соединения представляют собой желтоватого маслянистого вещества, которые были выделены в виде гидрохлоридов. Структура их подтверждена методами ИК-, ЯМР 1 Н и 13 С спектроскопии.
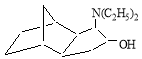
4(3)-диэтиламинотрицикло [5.2.1.0 2.6 ] декан-3(4)-ол [или 5(6)-диэтиламино-1,4`-метаногексагидроиндан-6 (5)-ол]: ИК-спектр, ν, см -1 : 3496 (ν,ОН), 3321 (ν, CHN), 3256 (ν, CN), 1658 (ν, CN), 1380, 1340 (δ, CH), 1128, 1110 (δ, OH); ЯМР 1 Н-спектр, δ, м.д.: 1,05 т (6Н, 2СН 3 , J 8.1 Гу), 1.31–1.63 м (12Н, Н 1,2,5,6,7,7,8,9,10 ), 2.44 д (4Н, N(CH 2 ) 2 , J 8.2, 7.0 Гу), 2.68 т (1Н, HCN, J 9.8 Гу), 3.42 д (1Н, НСОН, J 8.2, 7.1 Гу), 3.73 у.с. (1Н, ОН); масс-спектр, отн. интенс., %; 177 [С 12 Н 19 N] + (1.8), 132 [С 1 0 Н 1 2 ] +· (6.2); 120 [C 9 H 12 ] +· (4.8), 118 [C 9 H 10 ] +· (4.3); 106 [C 8 H 10 ] +· (7.8); 104 [C 8 H 8 ] +· (10.2); 92 [C 7 H 8 ] +· (12.4); 81 [C 6 H 9 ] + (36.3); 80 [C 6 H 8 ] +· (100); 79 [C 6 H 7 ] + (21.4); 68 [C 5 H 8 ] +· (18.5); 66 [C 5 H 6 ] +· (23.7).
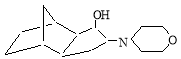
4(3)-морфолинилотрицикло [5.2.1.0 2.6 ] декан-3(4)-ол (смесь изомеров) (или 5(6)-морфолинилгексагидро-1,4-метаноиндан-6 (5)-ол). ИК-спектр, ν, см -1 : 3495 (ν,ОН), 3320, 3256 (ν, CHN), 1526 (CN), 1375, 1338 (δ, CН), 1240, 1123 (С-О-С), 1110, 1082 (δ, OH); ЯМР 1 Н-спектр, δ, м.д.: 1,28–1,62 т (12Н, Н 1,2,5,6,7,8,9,10 ), 2.70 д (1Н, HCN, J 9.8, 7.2 Гу), 2.73 т (4Н, N(CH 2 ) 2 , J 7.2 Гу), 3.42 д (1Н, НСОН, J 9.8, 7.2 Гу), 3.58 у.с. (1Н, ОН), 3.63 т (4Н, О(CH 2 ) 2 , J 7.2 Гу); масс-спектр, отн. интекс., %; 219 [С 14 Н 21 NО] + (1.8), 203 [С 14 Н 21 N] + (2.6); 201 [С 14 Н 19 N] + (2.4), 189 [С 13 Н 19 N] + (2,6); 187 [С 13 Н 17 N] + (2.7); 175 [С 12 Н 17 N] + (2.7); 174 [С 12 Н 16 N] + (3.1); 173 [С 12 Н 15 N] + (1.6); 161 [С 11 Н 15 N] + (2.1); 159 [С 11 Н 13 N] + (2.8); 133 [С 10 Н 13 ] + (5.2); 132 [C 10 H 12 ] +· (5.6); 120 [C 9 H 12 ] +· (10.6); 106 [C 8 H 10 ] +· (7.6); 105 [C 8 H 9 ] +· (8.7); 93 [C 7 H 9 ] +· (9.2); 92 [C 7 H 8 ] +· (23.4); 81 [C 6 H 9 ] +· (37.4); 80 [C 6 H 8 ] +· (100); 79 [C 6 H 7 ] +· (21.4); 78 [C 6 H 6 ] +· (18.4); 66 [C 5 H 6 ] +· (23.1); 65 [C 5 H 5 ] +· (12.4).
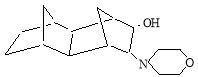
4(5)-морфолинилтетрацикло [6.2.1 1.8 .1 3.6 .0 2.7 ] додекан-5(4)-ол (смесь изомеров) (или 7(6)-морфолинилдекагидро-1,4; 5,8-диметанонафт-6 (7)-ол). ИК-спектр, ν, см -1 : 3486 (ν,ОН), 3235 (ν, CHN), 1532 (ν, CN), 1465 (δ, CН 2 ), 1382, 1364, 1347 (δ, СH), 1240, 1157 (С-О-С), 1097, 1087 (δ, ОH); ЯМР 1 Н-спектр, δ, м.д.: 1,24–1,65 м (14Н, 6Н 1,2,5,6,7,8 , 8Н 9,10,11,12 ), 2.51 д (1Н, HCN, J 9.8, 7.2 Гу), 2.69 т (4Н, N(CH 2 ) 2 , J 7.2 Гу), 3.42 д (1Н, НСОН, J 9.8, 7.2 Гу), 3.81 у.с. (1Н, ОН), 3.64 т (4Н, О(CH 2 ) 2 , J 7.2 Гу); ЯМР 13С, δ, м. д.: 76,2 (С 5 ), 70.8 (С 4 ), 48.4 (С 7 ), 45.7 (С 2 ), 45.4 (С 1 ), 40.5 (С 8 ), 40.3 (С 6 ), 39.8 (С 3 ), 34.9 (С 9,10 ), 30.8 (С 12 ), 29.6 (С 11 ), 67.4 (С 3,5 ), 52.6 (С 4,6 -морфолин).
Биоцидные свойства синтезированных аминоспиртов изучены в моторном масле М-8 в качестве антимикробных присадок. Результаты проведенных исследований приведены в таблице 1.
Таблица 1
Антимикробные свойства синтезированных С 10 , С 12 -полициклических аминоспиртов
|
Формула и название вещества |
Концентрация, % |
Зона угнетения роста микроорганизмов, мм |
|
|
Бактерии (МПА) |
Грибы (СА) |
||
|
3(4)-диэтиламинотрицикло [5.2.1.0 2.6 ] декан-4(3)ол (смесь изомеров) |
1.0 0.5 0.25 |
+ + + + + + |
1.3–1.5 1.2–1.3 + + |
|
3(4)-морфолинилтрицикло [5.2.1.0 2.6 ] декан-4(3)ол (смесь изомеров) |
1.0 0.5 0.25 |
1.3–1.4 0.9–1.0 + + |
1.7–1.9 1.2–1.3 0.8–1.0 |
|
3(4)-пиперидинилтрицикло [5.2.1.0 2.6 ] декан-4(3)ол (смесь изомеров) |
1.0 0.5 0.25 |
1.2 0.8–1.0 + + |
1.4–1.6 1.2–1.4 0.8–1.0 |
|
4(5)-морфолинилтетрацикло [6.2.1 3.6 .1 1.8 .0 2.7 ] додекан-5(4)-ол (смесь изомеров) |
1.0 0.5 0.25 |
1.5–1.6 1.2–1.4 ++ |
1.4–1.5 0.8–1.1 + + |
|
Пентахлорфенолят натрия |
1.0 0.5 |
1.3 0.7 |
1.4 0.7 |
|
Масло M-8 (без присадки) |
- |
+ + |
+ + |
Примечание: ++ сплошной рост микроорганизмов
Для испытаний использовали широко распространенные в нефтепродуктах и являющиеся их агрессивными разрушителями чистые культуры следующих видов микроорганизмов:
Бактерии: Mycobacterium lacticolium, Pseudomanas aeruginosa.
Грибы: Aspergillus niger, Cladosporium resinae, Penicillium chrosegenum, Chaetonium qolabosrum.
Указанные микроорганизмы выращивали при температуре 28±2°С в специально установленном термостате с 90–100 % влажностью: грибы — в течение 5–7 суток, а бактерии — в течение 2–3 суток. В качестве питательной среды для бактерий был использован мясо-пептонный агар (МПА), а для грибов — сусло-агар (СА 6 % по Блалингу).
Эффективность антимикробного действия оценивалась по величине диаметра зоны угнетения роста микроорганизмов вокруг лунки (в см) с присадкой и без нее: чем она больше, тем эффективнее антимикробное действие.
Результаты и их обсуждения
Аминолиз эпоксидов три- и тетрациклических непредельных углеводородов в отличие от эпоксидов бициклических углеводородов протекает без изменения их исходной структуры:
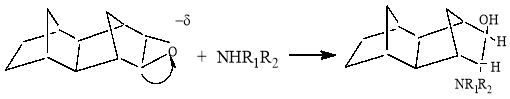
Аминолиз оксиранов существенно зависит от природы использованных растворителей, мольного соотношения реагентов (табл.2 и 3).
Синтезированные аминоспирты представляют собой трудноразделимую смесь экзо-эндо; экзо-экзо и эндо-эндо изомеров с преобладанием первых и проявляют высокую биоцидную эффективность.
Таблица 2
Зависимость реакции аминолиза 4-оксатетрацикло [6.2.1.0 2.7 .0 3.6 ] ундекана диетиламином ( I ) и морфолином ( II ) от природы растворителя
|
Растворитель |
ε |
Количество растворителя , моль |
Выход , % |
|
|
I |
II |
|||
|
Углерод-4-хлорид |
2,3 |
1,0 |
- |
- |
|
Бензол |
2,27 |
1,0 |
2,5 |
1,8 |
|
Толуол |
2,38 |
1,0 |
3,8 |
4,0 |
|
Трех-бутанол |
12,3 |
2,0 |
32,4 |
27,8 |
|
Пропанол-2 |
18,3 |
2,0 |
49,6 |
45,4 |
|
Етанол |
25,2 |
2,0 |
62,3 |
55,8 |
|
Метанол |
32,65 |
2,0 |
67,8 |
60,4 |
|
Пропанол-2+H 2 O (1:1) |
- |
3,0 |
79,3 |
76,4 |
|
Етанол+H 2 O (1:1) |
- |
3,0 |
80,5 |
82,3 |
Таблица 3
Влияния мольного соотношения реагентов на реакцию аминолиза 5-оксапентацикло [6.2.1.1 1.9 .1 3.7 . 0 2.8 .0 4.6 ] тридекана (Т=50°С, τ=8 ч., кат. К 2 СО 3 , растворитель-пропанол-2:Н 2 О+1:1
|
Амин |
Полученные соединения |
Взятый , q |
Соот. м оль I:II |
Выход , % |
|
|
Епоксид, I |
Амин II |
||||
|
Диэтиламин |
4(5)-диэтильаминотрицикло [6.2.1 1.8 .1 3.6 .0 2.7 ]додекан-5 (4)-ол |
8,8 8,8 8,8 |
7,3 11,0 14,6 |
1:2 1:3 1:4 |
51,6 67,3 82,4 |
|
Морфолин |
4(5)- морфолинтетрацикло [6.2.1 1.8 .1 3.6 .0 2.7 ] додекан-5 (4)-ол |
8,8 8,8 8,8 |
8,7 13,05 17,4 |
1:2 1:3 1:4 |
47,0 59,3 76,4 |
|
Пиперидин |
4(5)-пиперидинилтетрацикло [6.2.1 1.8 .1 3.6 .0 2.7 ] додекан-5 (4)-ол |
8,8 8,8 8,8 |
8,5 12,75 17,0 |
1:2 1:3 1:4 |
46,3 57,0 74,5 |
Литература:
- Касьян Л. И., Касьян А. О., Оковитный С. И., Тарабара И. Н. Алициклические эпоксидные соединения. Реакционная способность. Днепропетровск, Изд. Днепропетровск нац. Унив. 2003, 516 с.
- Касьян Л. И., Пальчиков В. А.// ЖорХ. 2010, т.46, Вып.1, с.7
- Bergmeier S. C.//Tetrahedron, 2000, Vol. 56, № 17, p.2561
- Karpf M., Trussardi R.//J.Org.Chem. 2001, Vol. 66, № 6, P.2044
- Saiz C., Villamil V., Gonzalez M. M., rossi M. A., Martinez L., Suescun L., Vila A. J., Mahler G.// tetrahedron Asym.2017, Vol.28, № 1, P.110
- Fernandes F. s., Fernandes T. s., suza da Silverira L., Caneschi W., et.al// Eur. J.Med. Chem.2016, Vol.108, p.203
- Szakonyi Z., Martinek T., Hetenyi A.//Tetrahedron, 2000, V.11, p.4571–4579
- Толстиков Т. Г., Морозова Е. А., Павлова А. В. и др. // Доклады Академии Наук., Химия, 2008, Т.422, № 4, с.490–492
- Терней А. Современная органическая химия // М.: Мир, 1981, Т.1, с.439–445
- Мохаммед А. Х., Борисова Е. Я., Угонова В. В., Крылов А. В., Борисова Н. Ю. // Вестник МИТХТ, 2011, № 5, с.140–142.