Ключевые слова: бактериальный кератит, антибактериальная активность, лейкоцитарно-тромбоцитарная аутоплазма (L-PRP).
Введение.
Сегодня наибольшее значение приобретает регенеративная медицина. Для регенеративной офтальмологии наиболее перспективным является субконъюктивальное применение лейкоцитарно-тромбоцитарной аутоплазмы (L-PRP) при лечении бактериального кератита.
Бактериальный кератит — это тяжелое воспалительное заболевание роговицы бактериального генеза, которое характеризуется помутнением роговой оболочки, а также ухудшением зрения. Это самое распространенное заболевание роговицы. В современной офтальмологии представляет собой наиболее серьезную проблему, в связи с тяжестью течения патологического процесса, обусловленного анатомическими особенностями роговицы глаза, а также высоким уровнем осложнений, что может привести к инвалидности по зрению. [1]
Заживление роговицы — это процесс комплексный, который включает в себя миграцию, митоз и дифференциацию эпителиальных и стромальных клеток, а также тканевое ремоделирование. [2] Существует предложенная R. Thoft и J. Friend, X, Y, Z гипотеза обновления клеток роговицы, согласно данной гипотезы восстановление роговицы осуществляется благодаря трем механизмам. X механизм представляет собой вертикальную миграцию клеток из базального слоя роговицы к ее поверхностному слою; Y — это механизм центрипетальной миграции эпителиальных клеток, то есть от периферии роговицы к ее центру; Z механизм представлен в виде общего направления миграции и потери клеток, которые складываются из комбинации двух механизмов X и Y. Следовательно, эти три механизма способствуют поддержанию эпителия роговицы в определенном балансе. При повреждении роговицы происходит активация процессов регенерации, которые направленны на восполнение утраченных клеток эпителия. [2] Для того, чтобы активировать процессы регенерации эпителия применяются определенные методы лечения бактериального кератита. Традиционным методом лечения бактериального кератита является применение антибиотиков. На первом месте в развитии бактериального кератита является золотистый стафилококк (Staphylococcus aureus). Но в последнее время применение только антибактериальной терапии бывает недостаточно, в связи с увеличением резистентности микроорганизмов к антибактериальным препаратам. [3]
В связи с этим применение лейкоцитарно-тромбоцитарной аутоплазмы является актуальным направлением в регенеративной офтальмологии.
В связи с вышеизложенным, цель исследования — изучить использование лейкоцитарно-тромбоцитарной аутоплазмы в лечении бактериального кератита, как фактора, который способствует восстановлению функций роговицы.
Материалы и методы.
Экспериментальные исследования проводились на глазах 24 поросят, массой 8–12 кг. Все экспериментальные процедуры с животными проводились в соответствии с международной конвенцией [4] Животные находились в стандартных условиях содержания в ветеринарной лаборатории Международного учебно-научного центра (МУНЦ) Министерства Здравоохранения и медицинской промышленности Туркменистана.
Животные с наличием бактериального кератита, были разделены на три группы. Каждая группа состояла из 8 особей. Исследования проводились на обоих глазах каждой особи. I группа — без лечения; II группа — с применением в качестве лечения местных антибиотиков; III группа — комбинированная терапия: с применением в качестве лечения местных антибиотиков, лейкоцитарно-тромбоцитарной фракции аутоплазмы (L-PRP) в сочетании бандажных линз.
Для получения экспериментального бактериального кератита использовалась методика, адаптированная из работ М. М. Бикбова и соавт (2013г). Колонию золотистого стафилококка, с помощью бактериологической петли втирали в травмированную роговицу животных (рис. 1). [5]. Спустя трое суток после заражения глаз животных проявлялись типичные для бактериального кератита гнойные поражения роговицы (рис. 2). Выделение и идентификация микроорганизмов для использования в экспериментальных исследованиях проводились на базе микробиологической научно-диагностической лаборатории Международного учебно-научного центра.
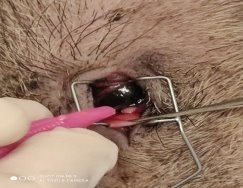
Рис. 1. Экспериментальная модель бактериального кератита
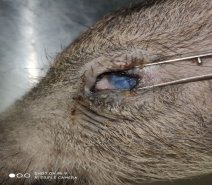
Рис. 2. Бактериальный кератит (3-и сутки)
Методика получения L-PRP является довольно несложной и доступной. У экспериментальных животных брали кровь из вены в объеме 4 куб. см. в 4,5 мл стерильные, вакуумные пробирки с 3,8 % цитрата натрия. Пробирки с полученными пробами крови центрифугировали однократно на 3000 об/мин в течении 7 минут, для разделения плазмы на форменные элементы. Для исследования мы использовали фракцию аутоплазмы с большим количеством тромбоцитов, т. е. 1000 μl (1 куб. см.) (рис. 3) [6].
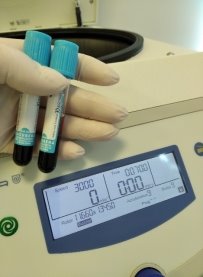
Рис. 3. Получение лейкоцитарно-тромбоцитарной фракции аутоплазмы (L-PRP)
Для исследования антибактериальной активности лейкоцитарно-тромбоцитарной аутоплазмы использовали диффузный метод в агаре в модификации Кирби-Бауэра, после инокуляции микроорганизма ( Staphylococcus aureus ), посевная доза которого на поверхности питательной среды составляла 10 4 КОЕ/мл. Антибактериальная активность L-PRP проявлялась ее диффундированием в питательную среду, угнетая рост микроорганизма, посеянного на поверхность агара. Активность L-PRP оценивалась при наличии сформированной зоны ингибирования роста не менее 7 мм (рис. 4). [7]
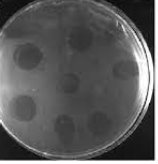
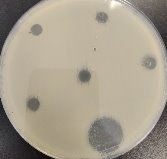
Рис. 4. Зоны лизиса бактериальной культуры — результат активности L-PRP
Следующий этап исследования для изучения клинического применения L-PRP в лечении бактериального кератита заключался в следующем: на четвертые сутки после развития бактериального кератита животным II и III групп назначалась антибактериальная терапия, которая заключалась в применении глазных капель (офлоксацин 0,3 %) (рис. 5). Животным III группы , с начала заболеванияпомимо применения антибактериальных глазных капель, проводилась трехкратная субконъюнктивальная инъекция L-PRP в объеме 1,0 мл на первые, третьи и седьмые сутки (рис. 6), так как III группа животных являлась группой, к которой применялась комплексная терапия, бандажную линзу надевали на третьи сутки (рис.7) [8].
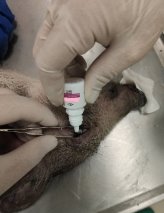
Рис. 5. Применение антибактериальной терапии
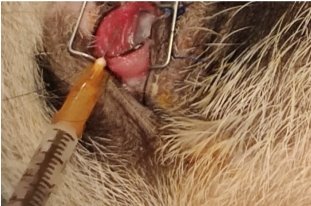
Рис. 6. Субконъюнктивальная инъекция L-PRP
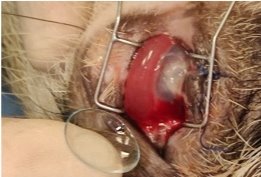
Рис. 7. Наложение бандажной линзы
После развития бактериального кератита проводили ежедневное наблюдение за состоянием роговиц глаз экспериментальных животных. И определяли эффективность лечения с помощью индекса поражения роговицы глаза (рис. 8).
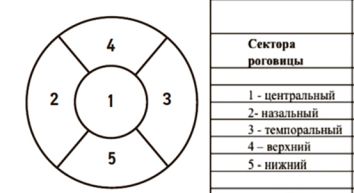
Рис. 8. Схема по секторам поражения роговицы
Результаты исследования. Врезультате проведенных экспериментальных исследований на третьи сутки после заражения роговицы золотистым стафилококком наблюдались субъективные признаки — слезотечение, блефароспазм; объективные признаки — уменьшился размер глазной щели, вплоть до полного смыкания век, а также покраснение и появление инфильтратов на роговице глаз.
До лечения средний индекс поражения роговицы глаз у экспериментальных животных всех трех групп составил 9,7 баллов. Кератит центральной локализации был представлен в виде одностороннего поражения и наблюдалась умеренная гиперемия конъюнктивы. На 5 сутки развития заболевания образовался округлой формы инфильтрат с ровными краями. Инфильтрат в центральной части был непрозрачный и имел молочно-белый оттенок. (рис. 9). При вовлечении в гнойно-воспалительный процесс краевых зон роговицы, то на пятые сутки после инфицирования наблюдалась картина аналогичная при поражении центральной части роговицы, с единственным отличием — это область поражения, которая выглядела в виде истончения прозрачной роговицы.
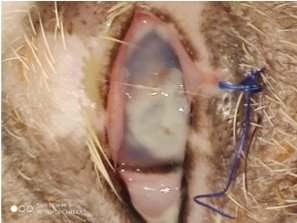
Рис. 9. Инфильтрат в центральной части
На пятые сутки у животных первой группы были поражены все секторы роговицы, наблюдалась перфорация роговицы и ее расплавление. Что касается второй группы экспериментальных животных, то наблюдалась довольно слабоположительная динамика исчезновения эпителиальных дефектов. Улучшения появлялись на 7 сутки и только в нижней части роговицы. Средний индекс поражения у данной группы животных на 8-е сутки лечения составил 8,2 балла. У третьей группы животных в результате применения комплексного лечения, включающего антибиотикотерапию, L-PRP и бандажные линзы, отмечалась более быстрая положительная динамика. Индекс поражения роговицы составил 5,6 балла после трехдневного лечения. На седьмые сутки лечения улучшение наблюдалось в краевых зонах роговицы. Что касается центральной части роговицы, то положительные результаты наблюдалась спустя восьми суток. При данной комплексной терапии через 2 недели лечения у этой группы экспериментальных животных наблюдалось полное исчезновение воспалительного процесса с эпителизацией дефектов. Кроме того, при применении L-PRP, у животных отсутствовала реакция аллергического характера. (рис. 10).
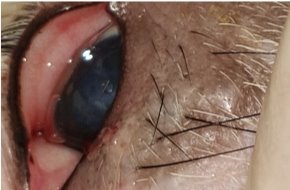
Рис. 10. Результат комплексной терапии на 14-е сутки
Выводы.
В результате проведенных исследований клиническое применение лейкоцитарно-тромбоцитарной фракции аутоплазмы актуально в лечении бактериального кератита, так как L-PRP обладает высокой антибактериальной активностью в отношении Staphylococcus aureus .
При использовании L-PRP установлено, что данная методика безопасна в офтальмологии при местном применении. Субконъюнктивальные инъекции L-PRP не вызывают ни аллергических, ни воспалительных реакций, а также других нежелательных эффектов.
Применение лейкоцитарно-тромбоцитарной фракции аутоплазмы (L-PRP) в комплексной терапии для лечения кератита, которая включает применение антибиотиков и бандажных линз, довольно существенно сокращает сроки лечения и минимизирует неблагоприятные последствия бактериального кератита, в отличии от применения только антибиотикотерапии.
Литература:
1. Бактериальные поражения роговицы: особенности клинического течения и исходы / Е. А. Дроздова, Н. М. Марачева, О. В. Пухова, Е. И. Тимошевская. — Текст: непосредственный // Медицинский вестник Башкортостана. — 2017. — № Том 12 N2. — С. 29–32.
2. Hozono, Y. Human corneal epithelial cells respond to ocularpathogenic, but not to nonpathogenic-flagellin / Y. Hozono. — Текст: непосредственный // Biochemical and Biophysical Research Communications. — 2006. — № 347. — С. 238–247.
3. Современные аспекты лечения язвенных поражений роговицы /. — Текст: непосредственный // Евразийский союз ученых. — 2016. — № 2. — С. 99–105.
4. Европейская конвенция о защите позвоночных животных, используемых для экспериментов или в иных научных целях. — Текст: электронный // Конвенция: [сайт]. — URL: https://base.garant.ru/4090914/ (дата обращения: 03.11.2021).
5. Способ моделирования бактериального кератита / М. М. Бикбов, В. К. Суркова, Н. А. Никитин, Н. Б. Зайнуллина. — Текст: непосредственный // Патент RU 2480845. — Москва:, 2013. — С. 1.
6. Плазмотерапия: Методики и области применения / И. В. Кошелева, Л. И. Шадыжева, Н. О. Переверзина, Н. А. Кливитская. — Текст: непосредственный // Лечащий врач. — 2018. — № 1. — С. 59–66.
7. Antibacterial Activity of Leukocyte- and Platelet-Rich Plasma: An In Vitro Study / Cieślik-Bielecka Agata. — Текст: электронный // Hindavi Biomed Research International: [сайт]. — URL: https://www.hindawi.com/journals/bmri/2018/9471723/ (дата обращения: 03.11.2021).
8. Маркес-де-Арасена, П. Субконъюнктивальное применение аутоплазмы, обогащенной тромбоцитами при лечении ожогов глаз / П. Маркес-де-Арасена, И. Монтеро-де-Эспиноса. — Текст: непосредственный // ARCH SOC ESP OFTALMOL. — 2001. — № 85. — С. 475–482.







