Статья посвящена термодинамическому анализу основной реакции процесса получения акролеина, осуществляемой с участием газообразного пропилена и кислорода воздуха в присутствии водяного пара.
Ключевые слова: термодинамика, энтальпия, энергия Гиббса, акролеин, трубчатый реактор, пропилен
Использование термодинамических расчетов помогает разобраться в различных производственных и проектных задачах. Термодинамический анализ является неотъемлемой частью научно-исследовательской детальности. Реализация новых химико-технологических проектов невозможна без предварительного изучения термодинамики анализируемого процесса. [1]
В данном случае изучается термодинамика процесса получения акролеина окислением пропилена. Это требуется для того, чтобы подобрать приемлемые условия для реализации процесса и для успешного технологического оформления (выбора ректора).
Получение акролеина из пропилена происходит в результате взаимодействие газообразного пропилена, кислорода воздуха и водяного пара в качестве разбавителя:
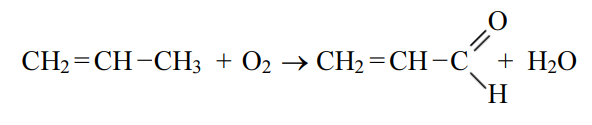
Эта реакция идет в интервале температур от 290 до 360 °С и является каталитической. Давление реакции обуславливается перепадом давления по системе и поддерживается в пределах от 0,05 до 0,1 МПа. Увеличение давления приводит к увеличению побочных реакций. [2]
В ходе этого процесса кроме основной реакции идут и побочные с получением углекислого газа, окиси углерода, акриловой кислоты и ацетальдегид. [2]
С помощью использования справочных [3] данных по стандартным значениям был произведен расчет зависимости изменения энтальпии от температуры, изменение свободной энергии Гиббса и натурального логарифма константы равновесия от температуры. Графики представлены на рисунках 1–3. Термодинамические расчеты проводились в интервале температур 298–698°К.
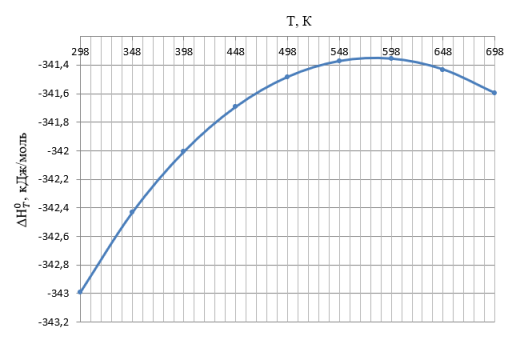
Рис. 1. График зависимости изменения энтальпии основной реакции получения акролеина от температуры
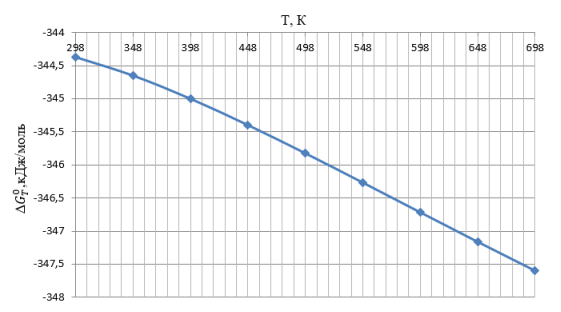
Рис. 2. График зависимости изменения свободной энергии Гиббса основной реакции получения акролеина от температуры
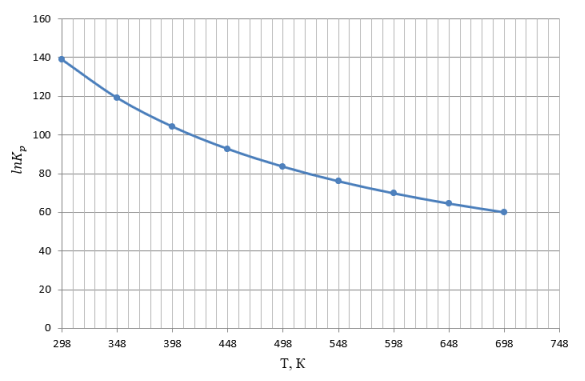
Рис. 3. График зависимости натурального логарифма константы равновесия основной реакции получения акролеина от температуры
В результате термодинамического анализа уставлено, что в заданном интервале температур 298–698 К изменение энтальпии имеет отрицательные значения, следовательно, основная реакция получения акролеина из пропилена является экзотермической. Изменение свободной энергии Гиббса отрицательно, значит, возможно самопроизвольное протекание реакции в прямом направлении. По высоким значениям константы равновесия можно сделать вывод, что в интервале температур 298–698 K реакция является необратимой. С повышением температуры константа равновесия убывает, что может также свидетельствовать об экзотермичности процесса.
Так как основная реакция является экзотермической (как и побочные реакции) при данном процессе необходимо предусмотреть отвод тепла для снижения риска увеличения образования побочных продуктов и преждевременной дезактивации катализатора.
Из всего вышеперечисленного можем сделать вывод о том, что приемлемым аппаратом для проведения процесса получения акролеина будет трубчатый реактор с неподвижным слоем катализатора в трубном пространстве и отводом тепла из межтрубного пространства посредством циркуляции хладагента. В качестве хладагента может быть использован расплав натриевой соли азотистой кислоты и калиевой соли азотной кислоты.
Литература:
- Дорофеева, О. В. Развитие и применение методов расчета термодинамических свойств газообразных соединений: автореф. дис.... доктора хим. наук / О. В. Дорофеева. — Москва, 2008. — 48 с.
- Мохов В. А. Повышение эффективности получения акролеина на АО «Волжский Оргсинтез»/ В. М. Мохов, С. А. Яковлев// Ползуновский вестник / ВолгГТУ. — Волгоград. –2018. –№ 1. — С. 131–134.
- Равделя, A. A. Краткий справочник физико-химических величин: учеб. пособ. / под ред. A. A. Равделя и А. М. Пономаревой. — 9-е изд. — СПб.: Специальная Литература, 1998. — 232 с.
- Попов Ю. В. Термодинамические расчеты процессов химической технологии / Ю. В. Попов, С. Е. Латышова; ВолгГТУ. — Волгоград, 2020. — 180 с.
- Попов Ю. В. Химические реакторы: учебное пособие / Ю. В. Попов, Т. К. Корчагина, В. А. Панчехин; ВолгГТУ. — Волгоград, 2013. — 240 с.







