При лечении коронавирусной инфекции важно не только её течение, но и то, что происходит в организме человека, в частности, кровеносной системе: какие нарушения провоцируют ухудшение состояния и дальнейшие осложнения. Об этих механизмах нарушения гемостаза и пойдет речь в статье.
Ключевые слова: COVID-19, SARS-CoV-2, тромбоз, гемостаз.
Введение
Новый коронавирус, известный как SARS-CoV-2, представляет собой респираторный вирус и является причиной глобальной пандемии коронавирусной инфекции (COVID-19). Хотя у большинства пациентов наблюдаются легкие симптомы или их отсутствие, тяжелое течение заболевания связано с тромбоэмболическими [16]. Коронавирусная инфекция часто приводит к состоянию гиперкоагуляции, которое является одной из причин высокой смертности. Понимание тромбогенного действия вируса и патофизиологии, лежащей в основе инфекции SARS-CoV-2, важно для лечения пациентов.
Тромботические осложнения и механизмы
Имеются существенные доказательства значительного риска тромбоза у пациентов с COVID-19. Клинические исследования обнаружили высокий процент случаев тромбоэмболических осложнений у пациентов с COVID-19 в отделении интенсивной терапии, несмотря на тромбопрофилактику низкомолекулярным гепарином (НМГ). Осложнения включали легочную эмболию (ТЭЛА), тромбоз глубоких вен (ТГВ), ишемический инсульт, инфаркт миокарда и системную артериальную эмболию [9].
При COVID-19 также сообщалось о легочном микротромбозе в альвеолах легких. Эти внутрисосудистые легочные микротромбы были связаны с развитием гипоксемии на ранних стадиях респираторного дистресс-синдрома взрослых (ОРДС) при COVID-19, что, вероятно, связано с несоответствием перфузии, вызванным изменениями в микроциркуляторном русле крови и последующим увеличением мертвого пространства [2]. В основе первичного легочного тромбоза могут лежать предполагаемые механизмы повреждения эндотелия, опосредованного легочным ангиотензинпревращающим ферментом 2 (АПФ2), потенциальным цитокиновым штормом и развитием состояния гиперкоагуляции при COVID-19 [10, 21].
SARS-CoV-2 способен потенцировать состояние гиперкоагуляции посредством активации путей контакта и тканевого фактора [15, 5]. Прямое вирусное повреждение миокарда и микрососудов вызывает воздействие на субэндотелий и коллаген, способствуя активации тромбоцитов и возможной активации контактного пути, который, как можно предположить, следует за высвобождением полифосфатов при дегрануляции тромбоцитов. Травма эндотелия вызывает воздействие тканевого фактора (TF) на субэндотелий, активируя путь тканевого фактора посредством активации FVII до FVIIa. Взаимодействия ACE-2-SARS-CoV-2 также могут нарушать регуляцию кинин-калликреиновой системы, что еще больше способствует активации контактного пути [21].
Воспаление, вызванное SARS-CoV-2, включает первичное воспаление сосудов, возможный сепсис и вторичную реакцию на повреждение тканей, вызванное вирусом [17], и включает образование медиаторов воспаления, таких как С-реактивный белок (СРБ), интерлейкин 6 (IL-6), интерлейкин-8 (IL-8) и фактор некроза опухоли α (TNF-α) [16, 11]. Высвобождение медиатора воспаления приводит к увеличению экспрессии ТФ, в то время как ИЛ-6 является ключевым регулятором транскрипции фибриногена. Повышенные уровни IL-6 связаны с повышенным уровнем фибриногена в плазме [2], что согласуется с резким повышением уровня фибриногена в плазме, наблюдаемым у пациентов с COVID-19 [5].
«Цитокиновый шторм» — это термин, используемый для описания острого перепроизводства противовоспалительных цитокинов клетками врожденного иммунитета, наблюдаемого при некоторых воспалительных инфекциях. Цитокиновый шторм обычно связан с одновременным повышением уровня ферритина в сыворотке и гемодинамической нестабильностью, что приводит к повреждению сосудов, полиорганной недостаточности и острому повреждению легких. Эти механизмы были идентифицированы при COVID-19 [11, 8, 7].
Взаимодействие тромбоцитов приводит к активации и дегрануляции тромбоцитов при COVID-19, что еще больше усиливает протромботическую сосудистую среду. Высвобождение полифосфатов из активированных плотных гранул тромбоцитов инициирует свертывание крови по внутреннему пути через активацию FXII [23]. Коагуляционная активность приводит к превращению фибриногена в фибрин посредством образования тромбина и последующей полимеризации фибрина.
Также данные исследований свидетельствуют о том, что NETos (программа образования нейтрофильных внеклеточных ловушек) увеличивается при COVID-19, особенно при тяжелом течении заболевания [6]. Ловушки эффективно улавливают вирусы, грибки и бактерии, концентрируя при этом антимикробные факторы [4]. Несмотря на то, что образование ловушек является важной частью иммунного ответа, они также взаимодействуют с воспалительными и коагуляционными каскадами, способствуя острому повреждению легких и активации тромбоцитов, эндотелиоцитов и FXII [4, 22]. Ловушки дополнительно повышают устойчивость сгустков к фибринолизу. NETos является одним из ключевых механизмов, связывающих высвобождение медиаторов воспаления, активацию тромбоцитов и эндотелия, образование тромбов и резистентность к фибринолизу [3, 20].
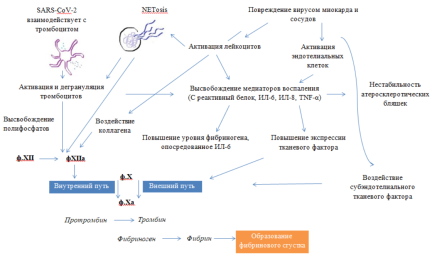
Баланс между отложением тромба и тромболизисом деликатно поддерживается активатором плазминогена тканевого типа (tPA), активатором плазминогена мочевого типа (uPA) и их ингибитором активатора плазминогена ингибитором-1 (PAI-1). Доказательства как тромбоза, так и кровотечения были обнаружены при COVID-19 [12], а наличие фибринолитической гиперактивности подтверждается значительным повышением уровня D-димера. Высвобождение противовоспалительных цитокинов может запускать активацию эндотелиальных клеток и высвобождение PAI-1 и tPA [12].
Диссеминированное внутрисосудистое свертывание крови является потенциально летальным механизмом при COVID-19, который приводит к нарушению фибринолиза и полиорганной дисфункции [18]. Клинические признаки явного ДВС-синдрома включают тромбоцитопению, удлинение ПВ, повышение уровня D-димера и увеличение количества продуктов деградации фибрина.
Сепсис-индуцированная коагулопатия (СИК) — это термин, используемый для идентификации раннего ДВС-синдрома, когда число тромбоцитов и протромбиновое время все еще значительно нарушены у пациента с подтвержденным сепсисом [18]. Общепризнанно, что патофизиология ДВС-синдрома при сепсисе включает комбинацию различных механизмов, в том числе активацию эндотелиальных клеток, тромбоцитов, лейкоцитов и отложение фибрина, что приводит к диффузному воспалению и коагулопатии. Ранее сообщалось, что общая частота ДВС-синдрома составляет 2,2 % у госпитализированных пациентов с COVID-19 [24]. Тем не менее, возникает несоответствие между выжившими и умершими когортами: 71,4 % умерших соответствуют критериям ДВС Международного общества тромбоза и гемостаза (ISTH) по сравнению с 0,6 % выживших: предполагается, что ДВС может быть критическим признаком ухудшения состояния пациента [13].
Значение антикоагулянтной терапии
Из-за повышенного риска тромбоэмболии у пациентов с заболеванием COVID-19 в настоящее время всем госпитализированным пациентам рекомендуется проводить тромбопрофилактику, если нет дополнительных рисков кровотечения [19, 14]. Также было предложено увеличить профилактическую дозу, поскольку риск ВТЭ остается высоким у пациентов, получающих стандартные профилактические дозы [9].
Все антикоагулянты связаны с риском кровотечения, который следует сопоставлять с клинической антитромботической эффективностью. Этот риск следует рассматривать отдельно для каждого пациента, принимая во внимание возможные коагулопатии.
Заключение
Взаимодействие между системами воспаления, свертывания и системы комплемента при COVID-19 требует дальнейшего изучения, чтобы более подробно установить вклад нарушения этих механизмов в патофизиологию заболевания. Благодаря достижениям в этих областях исследований возможно существенно улучшить лечение и профилактику тромбоза, связанного с COVID-19 в ближайшем будущем.
Литература:
- B. M. Henry, J. Vikse, S. Benoit, E. J. Favaloro, G. Lippi Hyperinflammation and derangement of renin-angiotensin-aldosterone system in COVID-19: a novel hypothesis for clinically suspected hypercoagulopathy and microvascular immunothrombosis Clin. Chim. Acta, 507 (2020), pp. 167–173 URL: https://www.sciencedirect.com/science/article/pii/S0009898120301832?via %3Dihub Дата обращения: 17.04.2022
- B. R. Branchford, S. L. Carpenter The role of inflammation in venous thromboembolism Front. Pediatr., 6 (2018), p. 142 URL: https://www.frontiersin.org/articles/10.3389/fped.2018.00142/full Дата обращения: 15.04.2022
- C. Ducroux, L. Di Meglio, S. Loyau, S. Delbosc, W. Boisseau, C. Deschildre, M. Ben Maacha, R. Blanc, H. Redjem, G. Ciccio, S. Smajda, R. Fahed, J. B. Michel, M. Piotin, L. Salomon, M. Mazighi, B. Ho-Tin-Noe, J. P. Desilles Thrombus neutrophil extracellular traps content impair tPA-induced thrombolysis in acute ischemic stroke Stroke., 49 (2018), pp. 754–757 URL: https://www.ahajournals.org/doi/10.1161/STROKEAHA.117.019896 Дата обращения: 15.04.2022
- C. L. Carty, P. Heagerty, S. R. Heckbert, G. P. Jarvik, L. A. Lange, M. Cushman, R. P. Tracy, A. P. Reiner Interaction between fibrinogen and IL-6 genetic variants and associations with cardiovascular disease risk in the cardiovascular health study Ann. Hum. Genet., 74 (2010), pp. 1–10 URL: https://onlinelibrary.wiley.com/doi/10.1111/j.1469–1809.2009.00551.x Дата обращения: 16.04.2022
- C. Lodigiani, G. Iapichino, L. Carenzo, M. Cecconi, P. Ferrazzi, T. Sebastian, N. Kucher, J. D. Studt, C. Sacco, B. Alexia, M. T. Sandri, S. Barco Venous and arterial thromboembolic complications in COVID-19 patients admitted to an academic hospital in Milan, Italy Thromb. Res., 191 (2020), pp. 9–14 URL: https://www.thrombosisresearch.com/article/S0049–3848(20)30140–7/fulltext Дата обращения: 15.04.2022
- C. Mozzini, D. Girelli The role of neutrophil extracellular traps in Covid-19: only an hypothesis or a potential new field of research? Thromb. Res., 191 (2020), pp. 26–27 URL: https://www.thrombosisresearch.com/article/S0049–3848(20)30147-X/fulltext Дата обращения: 16.04.2022
- C. van Nieuwkoop COVID-19 associated pulmonary thrombosis Thromb. Res., 191 (2020), p. 151 URL: https://www.thrombosisresearch.com/article/S0049–3848(20)30158–4/fulltext Дата обращения: 15.04.2022
- D. Ragab, H. S. Eldin, M. Taeimah, R. Khattab, R. Salem The COVID-19 cytokine storm; what we know so far Front. Immunol., 11 (2020), p. 1446 URL: https://www.frontiersin.org/articles/10.3389/fimmu.2020.01446/full Дата обращения: 16.04.2022
- E. Terpos, I. NtanasisStathopoulos, I. Elalamy, E. Kastritis, T. N. Sergentanis, M. Politou, T. Psaltopoulou, G. Gerotziafas, M. A. Dimopoulos Hematological findings and complications of COVID-19 Am. J. Hematol., 95 (2020), pp. 834–847 URL: https://onlinelibrary.wiley.com/doi/10.1002/ajh.25829 Дата обращения: 16.04.2022
- F. A. Klok, M. J. H. A. Kruip, N. J. M. van der Meer, M. S. Arbous, D. A. M.P. J. Gommers, K. M. Kant, F.H. J. Kaptein, J. van Paassen, M.A. M. Stals, M. V. Huisman, H. Endeman Incidence of thrombotic complications in critically ill ICU patients with COVID-19 Thromb. Res., 191 (2020), pp. 145–147 URL: https://www.thrombosisresearch.com/article/S0049–3848(20)30120–1/fulltext Дата обращения: 15.04.2022
- G. Chen, D. Wu, W. Guo, Y. Cao, D. Huang, H. Wang, T. Wang, X. Zhang, H. Chen, H. Yu, X. Zhang, M. Zhang, S. Wu, J. Song, T. Chen, M. Han, S. Li, X. Luo, J. Zhao, Q. Ning Clinical and immunological features of severe and moderate coronavirus disease 2019 J. Clin. Invest., 130 (2020), pp. 2620–2629 URL: https://www.jci.org/articles/view/137244 Дата обращения: 16.04.2022
- J. M. Connors, J. H. Levy COVID-19 and its implications for thrombosis and anticoagulation Blood., 135 (2020), pp. 2033–2040 URL: https://ashpublications.org/blood/article/135/23/2033/454646/COVID-19-and-its-implications-for-thrombosis-and Дата обращения: 17.04.2022
- J. Thachil, N. Tang, S. Gando, A. Falanga, M. Cattaneo, M. Levi, C. Clark, T. Iba ISTH interim guidance on recognition and management of coagulopathy in COVID-19 URL: https://onlinelibrary.wiley.com/doi/10.1111/jth.14810 Дата обращения: 15.04.2022
- M. Bautista-Vargas, F. Bonilla-Abadía, C. A. Cañas Potential role for tissue factor in the pathogenesis of hypercoagulability associated with in COVID-19 J. Thromb. Thrombolysis (2020) URL: https://link.springer.com/article/10.1007/s11239–020–02172-x Дата обращения: 15.04.2022
- M. Gabrielli, P. Lamendola, A. Esperide, F. Valletta, F. Franceschi COVID-19 and thrombotic complications: pulmonary thrombosis rather than embolism? Thromb. Res., 193 (2020), p. 98 URL: https://www.thrombosisresearch.com/article/S0049–3848(20)30256–5/fulltext Дата обращения: 16.04.2022
- N. Tang, D. Li, X. Wang, Z. Sun Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia J. Thromb. Haemost., 18 (2020), pp. 844–847 URL: https://onlinelibrary.wiley.com/doi/10.1111/jth.14768 Дата обращения: 17.04.2022
- S. Cui, S. Chen, X. Li, S. Liu, F. Wang Prevalence of venous thromboembolism in patients with severe novel coronavirus pneumonia J. Thromb. Haemost., 18 (2020), pp. 1421–1424 URL: https://onlinelibrary.wiley.com/doi/10.1111/jth.14830 Дата обращения: 16.04.2022
- T. Iba, J. H. Levy, T. E. Warkentin, J. Thachil, T. van der Poll, M. Levi Diagnosis and management of sepsis-induced coagulopathy and disseminated intravascular coagulation J. Thromb. Haemost., 17 (2019), pp. 1989–1994 URL: https://onlinelibrary.wiley.com/doi/10.1111/jth.14578 Дата обращения: 17.04.2022
- T. Omland, C. Prebensen, R. Røysland, S. Søvik, V. Sørensen, H. Røsjø, M. Svensson, J. E. Berdal, P. L. Myhre Established cardiovascular biomarkers provide limited prognostic information in unselected patients hospitalized with COVID-19 Circulation., 142 (2020), pp. 1878–1880 URL: https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.120.050089 Дата обращения: 15.04.2022
- Varjú, C. Longstaff, L. Szabó, A. Z. Farkas, V. J. Varga-Szabó, A. Tanka-Salamon, R. Machovich, K. Kolev DNA, histones and neutrophil extracellular traps exert anti-fibrinolytic effects in a plasma environment Thromb. Haemost., 113 (2015), pp. 1289–1298 URL: https://www.thieme-connect.de/products/ejournals/abstract/10.1160/TH14–08–0669 Дата обращения: 16.04.2022
- W. J. Guan, Z. Ni, Y. Hu, W. Liang, C. Ou, J. He, L. Liu, H. Shan, C. Lei, D.S. C. Hui, B. Du, L. Li, G. Zeng, K. Yuen, R. Chen, C. Tang, T. Wang, P. Chen, J. Xiang, S. Li, J. Wang, Z. Liang, Y. Peng, L. Wei, Y. Liu, Y. Hu, P. Peng, J. Wang, J. Liu, Z. Chen, G. Li, Z. Zheng, S. Qui, J. Luo, C. Ye, S. Zhu, N. Zhong Clinical characteristics of coronavirus disease 2019 in China N. Engl. J. Med., 382 (2020) URL: https://erj.ersjournals.com/content/55/5/2001028 Дата обращения: 15.04.2022
- Y. Wu Contact pathway of coagulation and inflammation Thromb. J., 13 (2015), p. 17 URL: https://thrombosisjournal.biomedcentral.com/articles/10.1186/s12959–015–0048-y Дата обращения: 15.04.2022
- Y. Zuo, M. Warnock, A. Harbaugh, S. Yalavarthi, K. Gockman, M. Zuo, J. A. Madison, J. S. Knight, Y. Kanthi, D. A. Lawrence 2020, Plasma tissue plasminogen activator and plasminogen activator inhibitor-1 in hospitalized COVID-19 patients medRxiv (2020) URL: https://www.medrxiv.org/content/10.1101/2020.08.29.20184358v4 Дата обращения: 15.04.2022
- Y. Zuo, S. Yalavarthi, H. Shi, K. Gockman, M. Zuo, J. A. Madison, C. Blair, A. Weber, B. J. Barnes, M. Egeblad, R. J. Woods, Y. Kanthi, J. S. Knight Neutrophil extracellular traps (NETs) in COVID-19 JCI Insight, 5 (2020) URL: https://www.medrxiv.org/content/10.1101/2020.04.09.20059626v1 Дата обращения: 17.04.2022







