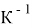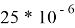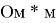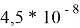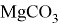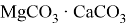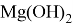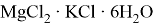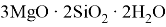Описаны основные физические и химические свойства магния. Рассмотрены способы получения магния из различных минералов и его применения в технике, металлургии и медицине.
Ключевые слова : магний, применения магния, свойства магния, оксид магния, гидроксид магния.
Физические и химические свойства
Магний (Mg) — 12-й элемент периодический системы Д. И. Менделеева. Лёгкий, ковкий щелочноземельный металл серебристо-белого цвета. Шестой элемент по содержанию в земной коре после кислорода, кремния, алюминия железа и кальция. В природе встречается в виде трёх стабильных изотопов:
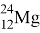
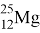
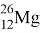
|
Тип решётки |
ГПУ |
|
Длина стороны основания шестиугольной призмы, нм |
0,3202 |
|
Высота шестиугольной призмы, нм |
0,5199 |
|
Плотность при 20°C, кг/м 3 |
1740 |
|
Плотность при 700°C, кг/м 3 |
1540 |
|
Температурный коэффициент линейного расширения,
|
|
|
Удельное электрическое сопротивление при 20°C,
|
|
|
Температура плавления, °C |
651 |
|
Температура кипения, °C |
1107 |
Конфигурация невозбуждённого атома:
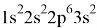
Магний — сильный восстановитель, при нагревании он способен вытеснять ряд элементов из их оксидов. В ряду активности металлов он стоит левее алюминия, а его потенциал
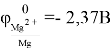
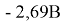
При комнатной температуре магний стабилен из-за образования на его поверхности оксидной плёнки
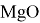
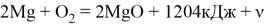
Магний образует один основный оксид
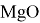
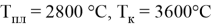
Оксид магния редко встречается в природе в виде минерала периклаз. В основном его получают двумя способами:
- Обжиг карбоната магния(магнезит) в специальных печах (“сухой” способ производства) позволяет в зависимости от условий получать различные виды оксида магния:
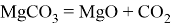
-
Сначала получение осадка гидроксида магния, взаимодействием сильной щёлочи и раствора бишофита (
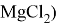
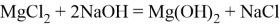
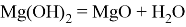
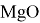
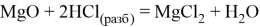
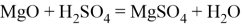
Также реагирует с кислотными оксидами и амфотерными оксидами, образуя двойные соли:
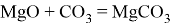
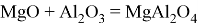
Являясь основным оксидом,
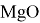
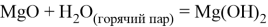
Гидроксид магния
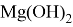
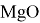
В природе
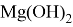
Гидроксид магния проявляет амфотерный характер, то есть взаимодействует как с кислотами, образуя соль и воду, так и со щелочами (но только при нагревании и с сильно концентрированной щёлочью), образуя комплексные соединения:
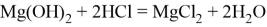
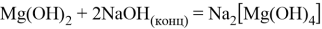
Также реагирует с кислотными оксидами, образуя соль и воду:
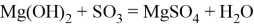
При длительном контакте с воздухом
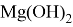
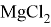
Соединения магния образуют кристаллогидраты с переменным количеством молекул воды:
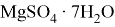
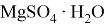
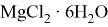
Магний, как очень активные металл, неустойчив к влаге. При наличии аэрации на его поверхности будет образовываться слой гидроксида:
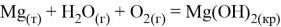
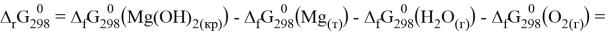
Как видно из термодинамических расчётов данная реакция протекает при стандартных условиях. Если аэрация отсутствует, то в ходе реакции также образуется гидроксид магния, но ещё выделяется водород:
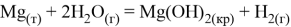
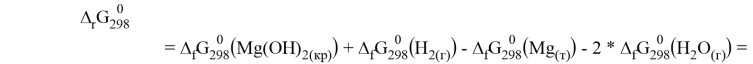
Без аэрации реакция может протекать при стандартных условиях, но медленно, поэтому для увеличения скорости температуру, при которой протекает реакция, надо повысить.
При нахождении магния во влажном воздухе имеет место электрохимическая коррозия. Это происходит из-за того, что на поверхности металла образуется тонкая плёнка воды, в которой растворены присутствующие в воздухе газы и другие вещества. Поэтому атмосферная коррозия магния усиливается по мере увеличения влажности и загрязнённости воздуха, особенно если в воздухе присутствуют хлориды, так как Cl является сильным катализатором коррозии.
Магний реагирует с кислотами неокислителями и кислотами окислителями:
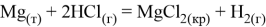
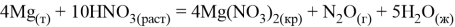
Эти реакции обусловлены его химической активностью: в кислых средах потенциал равен
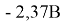
Магний не реагирует со щелочами при стандартных условиях, что объясняется образованием пассивирующего слоя на поверхности металла, но при увеличении температуры выше 70°C реакция возможна.
Добыча и получение магния
Магний — один из самых распространённых элементов в земной коре. Он содержится в составе многих минералов: из известных науке 1500 минералов он содержится в 200. Некоторые из них находятся рядом с залежами каменной соли под слоями различных пород, другие же образуют огромные массивы и даже горные хребты. Кроме минералов и горных пород хлорид магния содержится в водах океана, солёных озёрах и минеральных источниках (запасы неисчерпаемы —
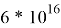
Таблица 1
Минералы, использующиеся в качестве сырья для добычи магния
|
Название минерала |
Химическая формула |
% содержания магния или оксида |
|
Магнезит |
|
47,8 % |
|
Доломит |
|
21,7 % |
|
Брусит |
|
69,1 % |
|
Карналит |
|
8,7 % |
|
Бишофит |
|
30–40 % |
|
Серпентенит |
|
43 % |
Ежегодная добыча магния составляет около миллиона тонн. Основные месторождения находятся в Китае, России и США. В то время как на Китай приходится 80 % от мировой добычи магния, на Россию 15 %, на США 5 %, а остальные страны добывают незначительное количество.
Впервые магний был получен восстановлением расплавленного хлорида магния калием:
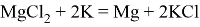
Хлориды растворяются в воде и поэтому удаётся выделить чистый металл. Сейчас химический способ получения не используется, так как требует использования дорогостоящих восстановителей (калий и натрий), а создать непрерывный технологический процесс не удалось.
В 1830 г. Майкл Фарадей получил магний, пропуская электрический ток через расплав его хлорида. В 1852 г. этот метод был детально исследован и усовершенствован Р. Бунзеном. С помощью электролизера ему удавалось всего за короткое время получать несколько граммов металла.
Технология электролитического получения магния значительно усовершенствована в наши дни, но основные её принципы не претерпели сильных изменений.
Второй способ промышленного получения магния сейчас — термический. Он основан на восстановлении оксида магния углеродистыми и металлическими восстановителями. Впервые этот способ начали использовать в промышленности в 30-х годах XX века. Термических способов несколько:
а. Pidgeon-процесс: разработан в 40-х годах Ллойдом Пидженом в Канадском исследовательском центре. Суть процесса в восстановлении обожжённого доломита ферросилицием:
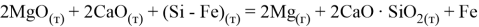
В 60-х годах интерес к данному способу у западных производителей значительно упал из-за высокой трудоёмкости и малой производительности, но получил второе рождение в Китае в конце 70-х годов прошлого века.
б. Процесс Magnetherm: был создан в 1960-х годах в французской фирме Pechiney Electrometallurgie и позволил существенно улучшить технологию силикотермического производства магния. Основное отличие новой технологии заключается в том, что восстановление оксида магния происходит в шлаковом расплаве. В процессе плавления периодически удаляется шлак без нарушения вакуума, что сильно повышает производительность термической установки.
Преимущество термического способа заключается в том, что он позволяет получать более чистый металл.
Применение магния
в конструкционных материалах
Главное преимущество магния — его лёгкость. В чистом виде он обладает невысокой прочностью, но введение в него небольшого числа других элементов сильно улучшает его свойства, как конструкционного металла, при этом не сильно увеличивая вес.
На основе этих свойств в Германии в 1909 году был создан сплав “электрон” (Al — 6 %, Zn — 1 %, Mn — 0,5 %, остальное Mg). Он, как и другие сплавы на основе магния, использовался в авиастроении в середине прошлого века. Но в ходе эксплуатации был выявлен недостаток таких сплавов: при повышении температуры сильно менялись их механические свойства, поэтому они были признаны непригодными. После множества проведённых исследований были открыты новые сплавы, лучше отвечающие поставленным требованиям.
Ещё один недостаток использования магния в качестве конструкционного материала — его высокая химическая активность, увеличивающейся с увеличением температуры, из-за которой он подвержен коррозии. С этим можно бороться, добавляя некоторые примеси. Не все элементы подойдут на эту роль. Так Fe, Ni, Cu, Pb будут только усиливать коррозию, но Mn, Zr, Zn, Ti улучшат коррозионную стойкость. Например, при добавлении менее процента титана к магниевому сплаву коррозионная стойкость увеличивается в 3 раза.
Одним из важнейших созданных сплавов стал “мангалий” (Mg — 5–30 %, остальное Al). Он сплав твёрже и прочнее алюминия, но легче обрабатывается и полируется.
Удельная вибрационная прочность магниевых деталей почти в 100 раз больше, чем у алюминиевых сплавов, и в 20 раз больше, чем у легированной стали. Также магниевые сплавы обладают лучшей удельной жёсткостью и поэтому применяются для изготовления деталей, подвергающимся изгибающим нагрузкам.
Современные сплавы, в которых содержится магний как основной или добавочный компонент, используются в автомобилестроении, корпусах телефонов, фотоаппаратов и видеокамер, ноутбуков, в деталях электроприборов и многих других областях техники.
В металлургии
В металлургии магний используют в процессах металлотермического получения трудновосстанавливаемых и редких металлов (Ті, Be, Zr, Hf, U). Процессы протекают при высокой температуре, когда взаимодействующие компоненты находятся в жидком состоянии. Магниетермия является основным способом получения титановой губки:
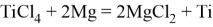
Технология получения металлических циркония и гафния во многом схожа с металлургией титана и основана на магниетермическом восстановлении хлоридов.
В черной металлургии магний нашел широкое применение при раскислении и десульфуризации чугуна и стали, что связано с большой химической активностью расплавленного магния по отношению к кислороду и сере.
В России около 80 % от всего используемого магния идёт на получение трудновосстанавливаемых и редких металлов.
В протекторной защите
Электрохимическая защита металлов от коррозии при помощи протекторов основана на значительной разности потенциалов металлов. Так как основная масса металлических конструкций в мире делается из чугуна и стали, в качестве протектора должны использоваться металлы с более отрицательным, чем у железа, электродным потенциалом. Один из них — магний. Его разница потенциалов с железом максимальная, что позволяет использовать этот металл в меньших количествах, чем другие: средний расход магниевых протекторов при защите от коррозии стальных конструкций и сооружений составляет
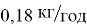
Широко применяется протекторная защита магнием паровых котлов, конденсаторов и трубчатых холодильников, резервуаров питьевой воды и ряда бытовых приборов, подземных трубопроводов, внутренней поверхности балластных танков наливных судов, морских буев и наружной облицовки. Также возможна катодная или протекторная защита железа магнием в среде расплавленных хлоридов.
В медицине
Магний необходим для работы сердца, нервной системы, мышц и жизнедеятельности клеток. Если человек потребляет мало свежих овощей, зелени, фруктов или имеет вредные привычки, может развиться дефицит этого вещества. Тогда врачом назначается препарат с содержанием оксида магния, чтобы повысить содержание магния в организме.
Также в медицине применяется и гидроксид магния. В основном он используется в двух целях:
а. Лекарство для нейтрализации кислоты в желудке. Если человек болеет гастритом, в его желудке образуется избыток соляной кислоты. При принятии человека лекарства, содержащего гидроксид магния, он вступает в реакцию нейтрализации с кислотой, тем самым уменьшая её количество:
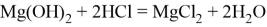
б. После реакции с кислотой хлорид магния, переходя в кишечник, оказывает послабляющий эффект, действуя как солевое слабительное.
В качестве альтернативного источника энергии
При сжигании магния в воздухе выделяется большое количество энергии —
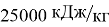
Также благодаря этому свойству некоторые учёные видят в магнии альтернативный источник энергии, так как кроме выделения тепла горение магния даёт в качестве отходов оксид, который можно перерабатывать обратно в магний в условиях чрезвычайно высокой температуры и в вакууме или отчищать и использовать в медицине.
Данное применение не распространено из-за высокой стоимости на магний, затрат энергии на нагрев, а также разницы в цене между чистым магнием и его оксидом (в России магний стоит 200 тыс., а оксид 100 тыс.). Всё это приводит к тому, что использовать магний в качестве промышленного источника энергии пока невыгодно.
Литература:
- Металлургия магния: учебное пособие /В. А. Лебедев, В. И. Седых. Екатеринбург: УГТУ-УПИ, 2010. 174 с.
- Магний /М. А. Эйдезон. М.: «Металлургия», 1969. 352 с.
- Магниды / Г. В. Самсонов, В. П. Перминов. Киев: “Наукова думка”, 1971. — 313 с.
- Гидрокиси металлов / В. П. Чалый. Киев: “Наукова думка”, 1972. — 163 с.
- Перспективы использование магния в качестве возобновляемого источника энергии / Р. К. Костанян, Г. Г. Карамян, П. И. Ивашкин, М. М. Калугин, Г. А. Мартоян. М.: Российская академия наук, 2017. — 28 с.