В настоящей работе осуществлен insilico дизайн 27 потенциальных ингибиторов протеинкиназ на основе известных киназных ингибиторов (иматиниба, нилотиниба и дазатиниба. Методами молекулярного моделирования оценен потенциал их ингибиторной активности в отношении мутантной (T315I) Bcr-Ablтирозинкиназы, которая выполняет ключевую роль в патогенезехронического миелоидного лейкоза. В результате выполненных исследований идентифицированы 6 соединений-лидеров, проявляющих, согласно расчетным данным, высокую аффинность связывания с мутантной Abl-киназой. Показано, что сконструированные методами молекулярного моделирования соединения представляют собой перспективные базовые структуры для разработки новых эффективных противоопухолевых препаратов.
Ключевые слова: протеинкиназы, Bcr-Ablтирозинкиназа, ингибиторы Bcr-Ablтирозинкиназы, компьютерный дизайн лекарств, молекулярный докинг.
Исследования фундаментальных молекулярных механизмов, лежащих в основе передачи сигналов опухолевых клеток, выяснили решающую роль протеинкиназ в канцерогенезе, поскольку в тех случаях, когда эти ферменты чрезмерно активны, они способствуют пролиферации клеток [1]. За последние30 лет было установлено, что множественные злокачественные опухоли человека обусловлены модуляцией и дисфункцией протеиновых и липидных киназ и дезактивированных фосфатаз из-за перестановок хромосом и генетических мутаций [2]. Исследования мутаций генома киназ показали, что генетически наследуемые варианты специфических киназ связаны с возникновением, развитием, прогрессированием и рецидивом рака.
Тирозинкиназа Bсr-Abl представляет собой гибридный белок, являющийся продуктом гибридного гена Bcr-Abl1, который является конститутивно активной тирозинкиназой, которая ответственна за онкогенную трансформацию клеток онкобелком. В частности, постоянная активность этой тирозинкиназы делает клетку невосприимчивой к воздействию факторов роста и вызывает ее избыточную пролиферацию. В итоге формирование белка Bcr-Abl провоцирует 95 % случаев хронического миелолейкоза и 20–50 % случаев острого В-клеточного лимфобластного лейкоза взрослых [3].
В настоящее время для лечения хронического миелоидного лейкоза применяются такие лекарственные препараты, как: иматиниб 1 , нилотиниб 2 , дазатиниб 3 и др (рис. 1). Терапия увеличивает показатели выживаемости. Однако использование данных лекарств со временем приводит к появлению резистентности у пациентов вследствие развития точечных мутаций в Bcr-Abl-белке [4]. Появление мутации T315I (замена аминокислоты треонин на изолейцин) в тирозинкиназе Bcr-Abl приводит к потере ключевой водородной связи между белком и ингибитором, что становится критичным для связывания белка с большинством известных ингибиторов. В настоящее время ведется поиск эффективных препаратов, которые способны ингибировать активность белка с наличием мутации T315I [5].
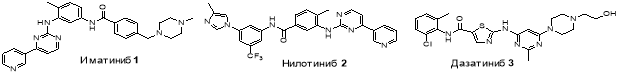
Рис. 1. Структурные формулы имитиниба, нилотиниба и дазатиниба
Главная идея моего исследования состояла в том, чтобы сконструировать за счет некоторых модификаций более гибкие молекулы, которые могли бы лучше связываться с тирозинкиназой Bcr-Abl с мутацией T315I. Модификации структур известных ингибиторов 1–3 заключались в замене амидной связи на фрагмент мочевины или тиомочевины, а также замены некоторых бензольных колец на менее объемные пиррольные, имидазольные, тиазольные и оксазольные, что на мой взгляд должно уменьшить стерические затруднения при встраивании молекулы ингибитора в структуру белка. Оценку эффективности взаимодействия белка и лиганда проводили с помощью молекулярного докинга в программе AutoDockVina [6]. На основе каждого из ингибитора 1–3 было предложенопо 9 соединений. Это соответственно соединения 1 a -1 i (структурно родственные иматинибу), соединения 2 a -2 i (нилотинибу) и соединения 3 a -3 i (дазатинибу) (рис. 2).
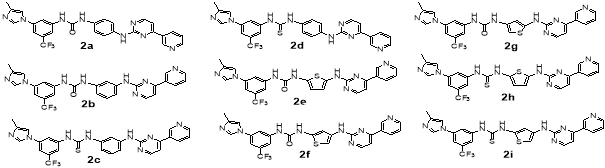
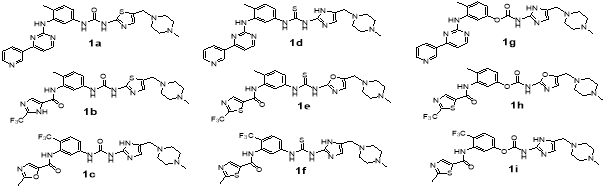
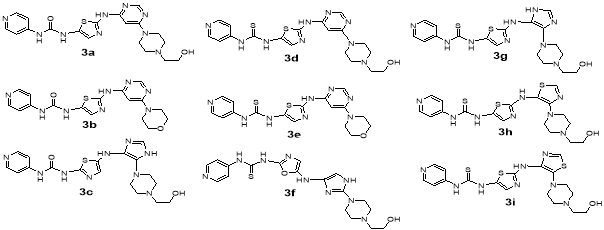
Рис. 2. Структуры смоделированных ингибиторов тирозинкиназы
Процесс молекулярного докинга был разделен на три этапа: подготовка молекулы белка, подготовка молекулы лиганда и расчет эффективности взаимодействия белка и лиганда.
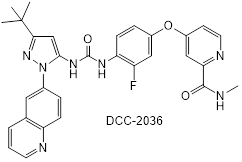
На первом этапе была выбрана структура белка. В качестве исходной структуры была взята тирозинкиназа человека Abl в комплексе с ингибитором DCC-2036 [3].
Структура комплекса получена методом дифракции рентгеновских лучей с разрешением 2.4 Å. Оптимизация была проведена с использованием силового поля Amber, частичные заряды были получены из Amberff99SB, из структуры белка были удалены молекула ингибитора DCC-2036, ковалентно-несвязанные ионы, молекулы воды, добавлены недостающие протоны аминокислот, присутствующие при физиологических значениях pH. Структура лигандов оптимизирована путем минимизации энергии структуры в программе ChemBio 3D в силовом поле MMFF94. Результаты расчета энергии взаимодействия белка и предложенных лигандов 1 a -1 i ,2 a -2 i и 3 a -3 i , в сравнении с известными ингибиторами 1–3 , представлены в таблице. 1.
Таблица 1
Значения свободной энергии связывания соединений с мутантной тирозинкиназой Abl
|
Соединение |
ΔG, ккал/моль |
Соединение |
ΔG, ккал/моль |
Соединение |
ΔG, ккал/моль |
|
1 |
-7,6 |
2 |
-9,6 |
3 |
-7,4 |
|
1a |
-9,8 |
2a |
-10,3 |
3a |
-8,8 |
|
1b |
-8,5 |
2b |
-9,9 |
3b |
-9,3 |
|
1c |
-8,3 |
2c |
-8,8 |
3c |
-6,9 |
|
1d |
-9,0 |
2d |
-10,6 |
3d |
-8,0 |
|
1e |
-8,2 |
2e |
-9,3 |
3e |
-7,7 |
|
1f |
-8,0 |
2f |
-9,6 |
3f |
-7,9 |
|
1g |
-9,9 |
2g |
-9,7 |
3g |
-7,7 |
|
1h |
-9,1 |
2h |
-9,6 |
3h |
-7,6 |
|
1i |
-9,0 |
2i |
-9,5 |
3i |
-7,5 |
Как видно, из данных таблицы 1 большая часть из предложенных нами структур лучше встраиваются в тирозинкиназу Bcr-Abl1 с мутацией T315I. Так, соединения 1 a -1 i имеют более высокую аффинность, чем иматиниб 1 , причем особо можно отметить соединения 1а и 1 g . Соединение 1а отличается от иматиниба следующими модификациями: заменой бензольного кольца на тиазольный цикл и заменой амидной связи на мочевинную. Соединение 1 g отличается заменой бензольного кольца на имидазольный цикл и заменой амидной связи на уретановую. Среди соединений 2 a -2 i , также ряд соединений имеет значительно более высокую аффинность по сравнению с нилотинибом — это соединения 2а и 2 d . Соединение 2а имеет вместо амидной связи — мочевинную, а соединение 2 d — тиомочевинную. Среди соединений 3 a -3 i наиболее лучшим сродством к тирозинкиназе обладают структуры 3 a и 3 b , которые по сравнению с дазатинибом имеют следующие модификации: замена 2-хлор-5-метилфенила на пиридин-4-ил, амидной связи на мочевинную, удаление метила из пиримидинового фрагмента.
Cконструированные in silico на основе таких известных ингибиторах тирозинкиназ, как иматиниб 1 , нилотиниб 2 и дазатиниб 3 , соединения 1 a - i , 2 a - i и 1 a - i (рис. 2) образуют широкую сеть межмолекулярных контактов с функционально важными остатками Bcr-Ablтирозинкиназы с мутацией T315I. Они имеют более низкие значения свободной энергии связывания, которые были рассчитаны для их комплексов с мутантной Abl-киназой методами молекулярного докинга (табл. 1). Таким образом, данные молекулярного моделирования свидетельствуют о том, что соединения 1а,1 g , 2а, 2 d , 3 a и 3 b (рис. 2) представляют значительный интерес для проведения дальнейших экспериментальных и теоретических исследований. Дальнейшие исследования включают химический синтез лигандов, биомедицинские испытания in vitro и оптимизацию структуры соединения-лидера, направленную на получение его аналогов с улучшенной противоопухолевой активностью и приемлемыми фармакокинетическими и токсикологическими параметрами.
Литература:
- Köstler W. J., Zielinski C. C. Targeting Receptor Tyrosine Kinases in Cancer. In: Receptor Tyrosine Kinases: Structure, Functions and Role in Human Disease. Eds.: Wheeler D. L., Yarden Y. New York: Springer Science & Business Media, 2015. P. 78–225.
- Bardelli A., Parsons D. W., Silliman N., Ptak J., Szabo S., Saha S., Markowitz S., Willson J. K. V., Parmigiani G., Kinzler K. W., Vogelstein B., Velculescu V. E. Mutational analysis of the tyrosine kinome in colorectal cancers. Science. 2003. V. 300. № 5621. P. 949. Doi: 10.1126/science.1082596.
- Tanaka R., Kimura S. Abl tyrosine kinase inhibitors for overriding Bcr-Abl/T315I: from the second to third generation // Expert Rev. Anticancer Ther. 2008. № 8. P/ 1387–1398. Doi: 10.1586/14737140.8.9.1387
- Flynn D. L. et all. Conformational Control Inhibition of the BCR-ABL1 Tyrosine Kinase, Including the Gatekeeper T315I Mutant, by the Switch-Control Inhibitor DCC-2036 // Cancer Cell. 2011. Vol. 19, iss. 4. P. 556–568. Doi: 10.1016/J.CCR.2011.03.003.
- Lin Y., Meng Y., Huang L.Computational Study of Gleevec and G6G Reveals Molecular Determinants of Kinase Inhibitor Selectivity // JACS. 2014. V. 136. P. 14753–14762. Doi: 10.1021/ja504146x.
- Kochnev Y., Hellemann E., Cassidy K. C., Durrant J. D. Webina: an open-source library and web app that runs AutoDock Vina entirely in the web browser // Bioinformatics. 2020. V. 36.Iss. 16. P. 4513–4515. Doi: 10.1093/bioinformatics/btaa579.







