Тушение флуоресценции — известное явление, нашедшее множество практических применений в науке и технике. В данной работе опробован простой и доступный способ измерения интенсивности флуоресценции, заключающийся в обработке фотографий образцов с помощью графического редактора. Для экспериментов нами был выбран дешевый и распространенный тушитель йодид калия. На тушение йодидом калия испытано пять органических красителей (Флуоресцеин, Родамин Ж, Родамин С, Акридиновый Желтый, Примулин) в водных растворах. Получены константы тушения K SV для уравнения Штерна-Фольмера. Выяснено, что йодид калия лучше всего тушит флуоресценцию Акридинового Желтого и хуже всего Примулина. Наглядно показана корреляция между наблюдаемой флуоресценцией и численным значением константы тушения.
Ключевые слова: флуоресценция, тушение флуоресценции, уравнение Штерна-Фольмера, йодид калия.
Взаимодействие между флуорофором и молекулой обычно вызывает изменение наблюдаемых и регистрируемых параметров флуоресценции, таких как интенсивность, квантовый выход и/или время жизни. Эти изменения флуоресценции позволяют объяснить и понять природу и происхождение взаимодействий между молекулами. Одно из таких явлений — тушение флуоресценции. Тушением флуоресценции называют любые процессы, которые уменьшают интенсивность флуоресценции данного вещества [1]. К тушению может проводить множество процессов, в том числе реакции в возбужденном состоянии, перенос энергии, образование комплексов и тушение при столкновениях.
В общем, можно наблюдать различные типы тушения флуоресценции: динамическое, статическое, тепловое и перенос энергии на расстояние, известный также как перенос энергии Форстера. Для нас наиболее интересны два вида тушения: динамическое и статическое. В случае динамического тушения тушитель должен диффундировать к флуорофору в течение времени нахождения в возбужденном состоянии. В результате контакта флуорофор возвращается в основное состояние без излучения фотона. В этом случае тушение описывается уравнением Штерна-Фольмера:
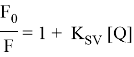
В этом уравнении F 0 — интенсивность флуоресценции в отсутствие тушителя, F — измеренная флуоресценция, а [ Q ] обозначает концентранцию тушителя в растворе. K SV — константа тушения Штерна-Фольмера. Графически данные о тушение предсьавляю в виде графика в координатах конценртация тушителя [ Q ] по оси абсцисс и отношение интенсивностей F 0 / F по оси ординат.
В случае статического тушения между флуорофором и тушителем образуется комплекс, который не флуоресцирует. В любом случае, чтобы произошло тушение, флуорофор и тушитель должны контактировать. Это — основное требование, которое проявляется в различных прикладных экспериментах, причем приложения связаны со свойствами процесса тушения [2].
В качестве тушителей флуоресценции выступают самые разнообразные вещества. Одним из наиболее известных динамических тушителей является молекулярный кислород [3], который тушит практически все известные флуорофоры. Поэтому, очень часто необходимо удалить растворенный кислород из растворителей, чтобы получить надежные измерения выхода флуоресценции или времени жизни. Механизм гашения кислорода был предметом споров. Наиболее вероятным механизмом является то, что парамагнитный кислород заставляет флуорофор подвергаться интеркомбинационной конверсии в триплетное состояние.
Другой тип тушения обусловлен тяжелыми атомами, такими как йод и бром. Галогенированные соединения, такие как трихлорэтанол и бромбензол, также действуют как динамические тушители. Тушение более крупными галогенами, такими как бромиды и иодиды, может быть результатом интеркомбинационной конверсии в возбужденное триплетное состояние, чему способствует спин-орбитальное взаимодействие возбужденного (синглетного) флуорофора и галогена [4]. Поскольку излучение из триплетного состояния медленное, триплетное излучение сильно гасится другими процессами.
Поскольку тушение флуоресценции легко наблюдать и измерять, оно является полезным индикатором процессов, происходящих на молекулярном уровне. Основной принцип заключается в том, что присутствие или отсутствие целевого вещества в растворе сближает флуорофор и его гаситель (отсутствие флуоресценции) или отдаляет друг от друга (флуоресценция). Например, измерением тушения можно выявить доступность флуорофоров для тушителей. Если данный растворитель очень вязок, то диффузия замедляется и тушение ослабевает. Следовательно, изучив тушение, можно определить скорости диффузии тушителей. Или предположим, флуорофор связан либо с белком, либо с мембраной. Если белок или мембрана непроницаемы для тушителя и флуорофор локализован внутри макромолекулы, то не может быть ни динамического, ни статического тушения. Исходя из этих соображений, тушение можно использовать для выяснения локализации флуорофоров в белках и мембранах и их проницаемости для тушителей. Кроме того, явление тушения флуоресценции широко используется в молекулярной визуализации [5,6]. Самотушение некоторых красителей активно используется в флуоресцентной микроскопии [7] или может быть использовано в датчиках протеолиза [8].
Все что было сказано выше в отношение флуоресценции, ее описания и практических применений невозможно без основного инструмента изучения этого явления — спектрофлуориметра. Не всегда он есть в доступе, например, у студентов, выполняющих лабораторные работы. В этой работе для изучения флуоресценции мы использовали доступную методику, требующую лишь фотоаппарата и графического редактора. Таким образом мы хотели показать, что на простых примерах изучать флуоресценцию можно и без дорогостоящего оборудования.
Для экспериментов нами были выбраны пять распространенных органических красителей — флуорофоров: Флуоресцеин, Родамин Ж, Родамин С, Акридиновый Желтый, Примулин. В качестве тушителя — не менее распространенный и доступный йодид калия. С ними были приготовлены водные растворы. Данные о концентрации красителей в рабочих растворах — Таблица 1.
Таблица 1
Данные о составе испытуемых растворов
|
Краситель |
C крас. , моль/л |
С K I , моль/л |
|
Флуоресцеин a |
1·10– 6 |
0,075–0,3 |
|
Родамин Ж |
1·10– 6 |
0,05–0,2 |
|
Родамин C |
4·10– 7 |
0,05–0,2 |
|
Акридиновый желтый |
5·10– 6 |
0,0375–0,15 |
|
Примулин |
5·10– 6 |
0,05–0,2 |
a В раствор флуоресцеина добавили NaOH, чтобы его концентрация была 0,1 моль/л.
Далее с помощью фотоаппарата в темноте при свете УФ-лампы были сделаны снимки образцов, в графическом редакторе переведены в черно-белый режим. Там же была получена средняя яркость каждого образца, коррелирующая с интенсивностью флуоресценции.


Рис. 1. Водные растворы акридинового желтого в черном боксе при свете УФ-лампы и обработанное в GIMP изображение
На основе полученных данных по пяти красителям были построены графики тушения флуоресценции в координатах Штерна-Фольмера (Рисунок 2). Определено линейное уравнение данных зависимостей и рассчитано среднеквадратичное отклонение R 2 от экспериментальных данных.
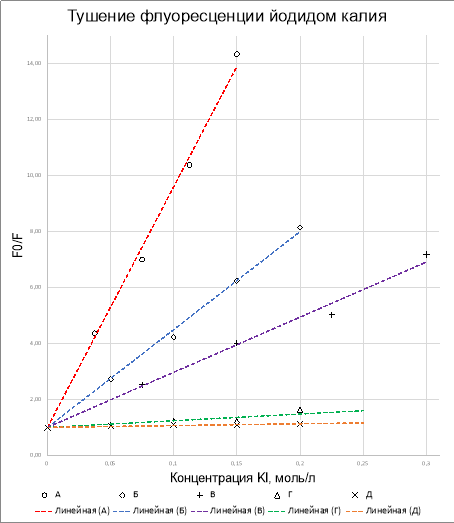
Рис. 2. Графики тушения флуоресценции: А — Акридиновый Желтый, Б — Родамин Ж, В — Флуоресцеин, Г — Родамин С, Д — Примулин
Рассчитанные константы K SV сведены в Таблицу 2.
Таблица 2
Рассчитанные константы Штерна-Фольмера
|
Краситель |
K SV |
R 2 |
|
Флуоресцеин |
19,70 |
0,98 |
|
Родамин Ж |
34,99 |
0,99 |
|
Родамин C |
2,43 |
0,83 |
|
Акридиновый Желтый |
86,07 |
0,99 |
|
Примулин |
0,68 |
0,88 |
Понятно, что чем больше значение K SV в уравнении Штерна-Фольмера, тем сильнее тушение флуорисценции. Для наглядной демонстрации связи константы и наблюдаемого тушения приводим три фотографии на Рисунке 3. На первой картинке на глаз разница между растворами практически незаметна глазу, на последней же уже второй образец с минимальной концентрацией тушителя резко отличается от первого.



Рис. 3.Растворы с K SV = 2,43 (Родамин С), K SV = 19,70 (Флуоресцеин), K SV = 86,07 (Акридиновый Желтый) соответственно
В заключение, нами исследовано явление тушения флуоресценции йодидом калия для пяти водных растворов распространненых красителей. Опробованная новая методика определения интенсивности флуоресценции с помощью лишь фотографий растворов красителей показала отличный Получены константы тушения K SV для уравнения Штерна-Фольмера. Для Акридинового Желтого K SV = 86,07, для Родамина Ж K SV = 34,99, для Флуоресцеина K SV = 19,70, для Родамина С K SV = 2,43, для Примулина K SV = 0,68 . Наглядно показана корреляция между наблюдаемой флуоресценцией и численным значением константы тушения.
Экспериментальная часть
Все используемые красители предоставлены кафедрой красителей СПбГТИ (ТУ). Во всех растворах использована дистиллированная вода в качестве растворителя. Пенициллиновые пузырьки, мерные колбы и пипетки перед работой вымыты хромовой смесью и тщательно высушены.
Подготовлено по пять образцов водных растворов флуорофоров с разной концентрацией тушителя — йодида калия (KI). Концентрация красителя и тушителя подбиралась для каждого флуорофора так, чтобы наблюдаемое тушение было отчетливо заметным глазу. Рабочие концентрации красителя находятся в интервале от 1·10– 7 до 5·10– 6 моль/л, а KI от 0,0375 до 0,3 моль/л (Таблица 1). Шестой «холостой» образец в каждом эксперименте — дистиллированная вода.
Образцы флуорофоров были сфотографированы в черном боксе в помещении без света на закрепленный в штативе фотоаппарат с ISO 50 и выдержкой 1 с при свете УФ-лампы с максимумом излучения ~370 нм (Рисунок 1).
Полученные в формате CRW фотографии были открыты в программе GIMP с установленным плагином RawTherapee, переведены в режим Градации Серого. Далее с помощью инструмента Гистограмма измерили среднее значение яркости в одной и той же области в центре каждого из пузырьков. Значение яркости для пузырька с водой приняли за яркость фона. Действительную среднюю яроксть F вычислили как разность средней яроксти пузырька с красителем и пузырька с водой.
Падение интенсивности флуоресценции описывается уравнением Штерна-Фольмера:
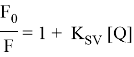
где F 0 — интенсивность флуоресценции в отсутствие тушителя, F — измеренная флуоресценция, а [ Q ] обозначает концентранцию тушителя в растворе. K SV — константа тушения Штерна-Фольмера. В нашем случае F 0 и F — действиетльные средние яркости.
Общая методика приготовления рабочих растворов красителей. На аналитических весах (измерение до 4-го знака) брали навеску красителей массой ~10–15 мг. С полученной навеской готовили водный раствор в мерной колбе объемом 500 мл. Далее получали два рабочих раствора объемами по 100 мл с заданной в Таблице 1 концентрацией флуорофора. Для этого отбирали алкивотную часть и переносили в мерную колбу объемом 100 мл. В один из рабочих растворов добавляли навеску йодида калия необходимую для получения максимальной его концентрации, указанной в Таблице 1. Получив два рабочих раствора, заполняли пенициллиновые пузырьки следующим образом:
- 4 мл раствора красителя заданной концентрации
- Смесь 3 мл раствора красителя заданной концентрации + 1 мл красителя заданной концентрации с KI
- Смесь 2 мл раствора красителя заданной концентрации + 2 мл красителя заданной концентрации с KI
- Смесь 1 мл раствора красителя заданной концентрации + 3 мл красителя заданной концентрации с KI
- Смесь 4 мл раствора красителя заданной концентрации с KI
- Дистиллированная вода
Пузырьки закрыли пробками и тщательно взболтали.
Литература:
- Albani J. R. Structure and Dynamics of Macromolecules: Absorption and Fluorescence Studies. Elsevier, 2004. P. 414.
- Lakowicz J. R. Principles of Fluorescence Spectroscopy. Elsevier, 2006. P. 673.
- Kautsky H. Quenching of luminescence by oxygen. Trans Faraday Soc., 1938. P. 216.
- Kasha M. // J. Chem. Phys. 1952. Vol. 20. P. 71–74. DOI: 10.1016/j.cej.2012.07.103
- Blum G., et all // PLOS ONE. 2004. Vol. 7. DOI: 10.1371/.0006374.
- Weissleder R., et all // Nature Biotechnology. 1999. Vol. 17. Issue 4. P. 375–378. DOI: 10.1038/7933.
- Jacobsen M. T., et all // Cell Chem Biol., 2017 Vol. 24. Issue 8. P. 1040–1047. DOI: 10.1016/j.chembiol.2017.06.015.
- Voss E. W., et all // BioTechniques. 1996. Vol. 20 Issue. 2. P. 286–291. DOI: 10.2144/96202rr06.







