В статье рассматривается процесс получения хлористого метила жидкофазным взаимодействием хлористого водорода и метанола. Выбран реактор для данного процесса на основе результатов моделирования в программе COMSOL Reaction Engineering Lab.
Ключевые слова: хлористый метил, метанол, селективность, удельная производительность, реактор, моделирование.
Хлористый метил получают путем жидкофазного взаимодействия метанола с хлористым водородом. Процесс осуществляют при температуре реакционной массы 110–115 о С и давлении 60 кПа.
Реакция образования хлористого метила протекает в одну стадию:
СH 3 OH + HCl CH 3 Cl + H 2 O
Синтез хлористого метила проводится при массовом соотношении реагирующих веществ — хлористый водород: метиловый спирт равным 3:1. Избыток хлористого водорода применяется для подавления реакции образования нежелательного побочного продукта — диметилового эфира.
Образование диметилового эфира протекает по реакции:
CH 3 Cl + CH 3 OH CH 3 -O-CH 3 + HCl
В промышленности, в настоящее время, степень конверсии метанола 97 %. Селективность основной реакции 99,9 %. Селективность побочной реакции 0,1 %. Технологический выход продукта — 99,7 %.
Формализованная схема процесса получения хлористого метила:
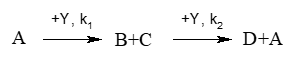
где Y — CH 3 OH;
В — CH 3 Cl;
A — HCl;
C — H 2 O;
D — CH 3 OCH 3 ;
Используя известные [1,2] кинетические уравнения для процесса получения хлористого метила жидкофазным гидрохлорированием метанола, в указанных выше обозначениях, уравнение скорости образования целевого продукта запишем в следующем виде:
r 1 = k 1 [A] [У],
где k 1 –константа скорости процесса образования хлористого метила.
Уравнение скорости образования побочного продукта:
r 2 = k 2 [B] [Y],
где k 2 — константа скорости процесса образования диметилового эфира.
Константа скорости k (при t=25
о
С), л/моль∙сек
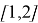
– основной реакции — k 1– 9,6∙10– 2
– побочной реакции — k 2– 8,69∙10– 3
Начальные концентрации исходных веществ, C
0
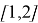
– метанол — 0,36 моль/м 3
– хлористый водород — 1,08 моль/м 3
При выборе реактора необходимо учитывать два параметра — удельную производительность и селективность.
Одной из важнейших характеристик реактора является его удельная производительность, которая показывает, какое количество целевого продукта образуется в единице реакторного объема в единицу времени.
Проведем сравнение данных показателей для реакторов: полного смешения (РПС) и идеального вытеснения (РИВ).
Для РПС удельную производительность вычисляют по уравнению
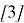
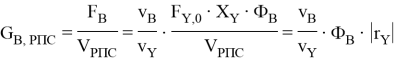
Для реактора РИВ удельную производительность вычисляют по уравнению [3]:
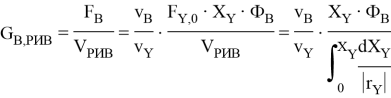
Сравнение удельной производительности для реактора полного смешения (РПС) и реактора идеального вытеснения (РИВ) осуществили построением графика зависимости удельной производительности реактора от степени конверсии метанола с использованием программы «COMSOL Reaction Engineering Lab»
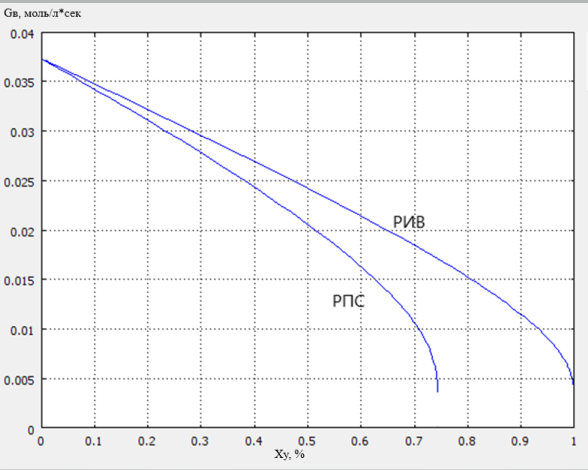
Рис. 1. Сравнение удельной производительности для РПС и РИВ
Падающий характер кривой G B = f(X Y ) объясняется тем, что скорость реакции гидрохлорирования метанола уменьшается с повышением степени конверсии.
Из графиков видно, что наиболее эффективным реактором для данного процесса по величине удельной производительности является реактор идеального вытеснения. Для РИВ снижение удельной производительности с конверсией выражено не так сильно, как для РПС, в следствии чего эти реакторы более предпочтительны.
Второй важнейшей характеристикой является селективность процесса. Для сравнения селективности РПС и РИВ осуществили построение графика зависимости селективности от конверсии с использованием программы COMSOL Reaction Engineering Lab.
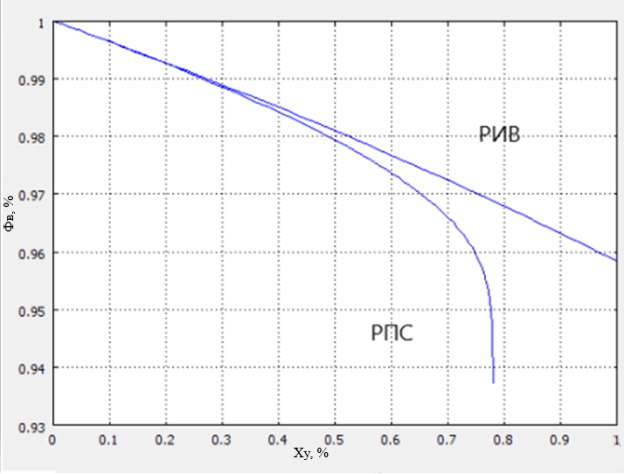
Рис. 2. Сравнения селективности для РИВ и РПС
Падающий вид кривой Ф В = f(Х Y ) объясняется тем, k 1 ˃˃k 2 , поэтому селективность с увеличением конверсии значительно уменьшается, что характерно для необратимых последовательных реакций — реагент В образуется и вступает в побочную реакцию с исходным реагентом Y.
Из графиков видно, что более эффективным будет использование РИВ. В реакторе этого типа достигается более высокая удельная производительность и селективность. Таким образом этот реактор будет являться более производительным.
Литература:
- Розанов B. H., Трегер Ю. А. Кинетика жидкофазного некаталитического гидрохлорирования метанола в соляной кислоте // Кинетика и катализ. 2011. Том 52. № 5. С. 670. https://elibrary.ru/download/elibrary_17057869_13497445.pdf
- M. Н. Махин, Л. Н. Занавескин, Г. С. Дмитриев / Кинетика и Катализ / 2014, том 55, №. 2, с. 172–175. https://elibrary.ru/download/elibrary_21270008_32777078.pdf
- Лебедев, Н. Н. Теория химических процессов основного органического и нефтехимического синтеза / Н. Н. Лебедев, М. Н. Манаков, В. Ф. Швец; под ред. Н. Н. Лебедева. — 2-е изд. перераб. — Москва: Химия, 1984. — 376 с.
- Огородников, А. С. Моделирование в среде MatLab COMSOL 3.5a. Часть 1 / А. С. Огородников. — Томск: Изд-во ТПУ, 2012. — 104 с.







