В статье авторы изучают основные свойства нонамолибдоманганата аммония основными физико-химическими методами и синтезируют нонамолибдоманганатовую кислоту.
Ключевые слова: гетерополисоединение, свойства, применение, синтез.
Гетерополисоединения (ГПС) — это группа координационных соединений, имеющие в своем составе единый лиганд, в роли которого чаще всего выступают металлокислородные кислоты, взаимодействующие между собой и образующие полиоксометаллатныелиганды. В зависимости от отношения лиганда к одному или нескольким элементам-комплексообразователям гетерополисоединения разделяют на одноядерные и многоядерные. Глубокое изучение химии гетерополисоединений началось только после 1860 года, и за весь период исследования собралась большая теоретическая и практическая справка, но на данный момент не все аспекты являются достаточно изложенными. На сегодняшний день известны различные структурные типы гетерополисоединений. Соединения, имеющие в своей сфере 12 атомов молибдена, относятся к структуре типа Кеггина (12 ряда). Гетерополисоединения структуры Перлоффа, называемые также структурами Андерсона, имеют 6 атомов вольфрама или молибдена, находящихся внутри сферы. Известно также существование комбинированного типа, точный химический состав и свойства которых можно изучить с помощью основных физико-химических методов.
Гетерополимолибдоманганаты относятся к гибридному типу структур соединений 9 ряда. Особенность таких гетерополисоединений в том, что они проявляют окислительно-восстановительные свойства. Данные соединения имеют широкий и разнообразный спектр применения. В основном их можно встретить в гомогенном и гетерогенном катализе, синтезе органических соединений. Интерес представляет исследование каталитической активности ГПС в зависимости от состава и структуры [1]. Также своё применение ГПС находят в методах анализа веществ аналитической химии для определения таких элементов, как фосфор, кремний и германий. В роли осадителя протеинов, алколоидов и пуринов используют гетерополисоединения. Примером использования ГПС в колориметрических методах исследования является применение аниона [P 2 M 18 O 62 ] 6- для определения мочевой кислоты и холестирола. Гетерополивольфраматы и молибдаты можно встретить на производстве цветных красок, также в процессе фотосинтеза их используют в качестве акцепторов электронов. Антивирусными и антиопухолевыми свойствами обладают анионы гетерополивольфраматов, в особенности [NaSb 9 W 21 O 86 ] 18- . Гетерополикислоты и их соли используются как гетерогенные катализаторы [1] для различных реакций — получение акриловой и метакриловой кислоты окислением пропилена и изобутилена соответственно, окисление ароматических углеводородов, реакция полимеризации олефинов и др.
Российские ученые уделяют много внимания реакциям с гомогенными каталитическими процессами, протекающими с участием гетерополианионов в растворах. В частности, для каталитического окисления этилена кислородом воздуха до ацетальдегида используют смешанные полианионы [PV x Mo 12-x O 40 ] n- вместе с солями палладия (II).
В качестве дешевых ионообменных материалов давно используются нерастворимые соли гетерополикислот, в особенности молибдофосфат аммония. Также свое применение они находят в хроматографии и для изготовления ион-селективных мембран.Кристаллические 12-вольфрамофосфорные и 12-молибофосфорные кислоты применяются как протонные проводники.
Список применений гетерополисоединений продолжает пополняться по мере подробного изучения их свойств. На данный момент уже есть данные о применении их как ингибиторов пламени, защитного покрытия для предотвращения коррозии стали и алюминия.
Из-за того, что на сегодняшний день известен большой спектр полученных гетерополисоединений, ключевым в научной работе является выбор наименее изученного соединения, но имеющего перспективу в развитии дальнейшего применения. По этой причине авторы выбрали исследовать менее изученный гетерополимолибдоманганат аммония и получить нонамолибдоманганатовую кислоту.
Были получены кристаллы нонамолибдоманганата аммония, синтез проводился по модифицированной известной методике. Авторы методики предложили проводить синтез следующим образом [2]: приготовить раствор парамолибдата аммония, растворив 7,5 г в 60 мл дистиллированной воды, и нагреть его до 80 °C, приготовить второй раствор ацетата марганца, растворив 2 г в 40 мл дистиллированной воды, и нагреть до 45 °C. Первый раствор подкисляли добавлением азотной кислоты до pH=3. Полученные растворы в результате смешали, добавили по каплям 10 % раствор перекиси водорода и нагревали на водяной бане до уменьшения объема раствора втрое. После чего раствор оставили охлаждаться в эксикаторе на неделю. Спустя время выпали оранжевые кристаллы нонамолибдоманганата аммония, которые промыли водой и высушили при комнатной температуре.
Затем, чтобы избавиться от иона аммония и получить нонамолибдоманганатовую кислоту, из полученных кристаллов приготовили раствор, который налили в катионит КУ-2.
Для уточнения химического состава был проведен масс-спектральный анализ нонамолибдоманганата аммония, результаты которого приведены в табл. 1.
Таблица 1
Результаты масс-спектрального элементного анализа
|
(NH 4 ) 6 [MnMo 9 O 32 ]·6H 2 О |
N |
Mn |
Mo |
O |
|
Найдено, % Вычислено, % |
5,01 5,1 |
3,30 3,32 |
52,00 53,11 |
32,08 31,98 |
Также авторами был проведен рентгенофазовый анализ соединения, по сопоставлению полученной штрихрентгенограммы с базами данных нами было установлено, что гетерополисоединие марганца не содержит примесей и определено как самостоятельное соединение с тригональной сингонией. По методу Сыромятникова удалось установить параметры элементарных ячеек, числа формульных единиц и пикнометрическую плотность. (табл. 2)
Таблица 2
Результаты РФА ( NH 4 ) 6 [ MnMo 9 O 32 ]·6 H 2 О
|
Гетерополисоединение |
а,Å |
b , Å |
c ,Å |
V , Å 3 |
ρ, г/см 3 |
Z |
|
(NH 4 ) 6 [MnMo 9 O 32 ]·6H 2 О |
15,92 |
15,92 |
12,39 |
2723,3 |
2,98 |
3 |
Термогравиметрический анализ указал на наличие трёх эндотермических эффектов для (NH 4 ) 6 [MnMo 9 O 32 ]·6H 2 О (Рис. 1). Первый, происходящий при 120°C, сопровождается удалением 6 молекул кристаллизационной воды. При втором эндотермическом эффекте в интервале температур 220–320°C выделяется аммиак, происходит перекристаллизация нонамолибдоманганата, восстановление маргнаца, а также образование темно-коричневой смеси MnMoO 4 +8MoO 3 . Третий эндотермический эффект при 770°C указывает на удаление 8 молекул оксида молибдена (VI). Схема термического разложения нонамолибдоманганата аммония представлена ниже:
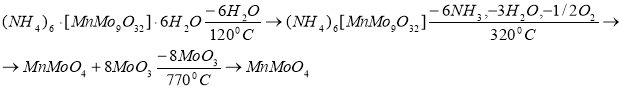
![Термодериватограмма (NH4)6 [MnMo9O32]·6H2О](https://moluch.ru/blmcbn/100444/100444.013.png)
![Термодериватограмма (NH4)6 [MnMo9O32]·6H2О](https://moluch.ru/blmcbn/100444/100444.012.png)
![Термодериватограмма (NH4)6 [MnMo9O32]·6H2О](https://moluch.ru/blmcbn/100444/100444.010.png)
![Термодериватограмма (NH4)6 [MnMo9O32]·6H2О](https://moluch.ru/blmcbn/100444/100444.011.png)
![Термодериватограмма (NH4)6 [MnMo9O32]·6H2О](https://moluch.ru/blmcbn/100444/100444.010.png)
![Термодериватограмма (NH4)6 [MnMo9O32]·6H2О](https://moluch.ru/blmcbn/100444/100444.009.png)
![Термодериватограмма (NH4)6 [MnMo9O32]·6H2О](https://moluch.ru/blmcbn/100444/100444.008.png)
![Термодериватограмма (NH4)6 [MnMo9O32]·6H2О](https://moluch.ru/blmcbn/100444/100444.007.png)
![Термодериватограмма (NH4)6 [MnMo9O32]·6H2О](https://moluch.ru/blmcbn/100444/100444.006.png)
![Термодериватограмма (NH4)6 [MnMo9O32]·6H2О](https://moluch.ru/blmcbn/100444/100444.005.png)
![Термодериватограмма (NH4)6 [MnMo9O32]·6H2О](https://moluch.ru/blmcbn/100444/100444.004.png)
![Термодериватограмма (NH4)6 [MnMo9O32]·6H2О](https://moluch.ru/blmcbn/100444/100444.003.png)
![Термодериватограмма (NH4)6 [MnMo9O32]·6H2О](https://moluch.ru/blmcbn/100444/100444.002.png)
![Термодериватограмма (NH4)6 [MnMo9O32]·6H2О](https://moluch.ru/blmcbn/100444/100444.014.png)
Рис. 1. Термодериватограмма (NH 4 ) 6 [MnMo 9 O 32 ]·6H 2 О
Полученные в результате синтеза соединения могут применяться в роли катализатора в реакции окисления метана. Перспектива дальнейшего практического использования может быть основана на изучении свойств нонамолибдоманганатов в агрохимии, например в качестве раствора, стимулирующего прорастание семян биоиндикаторов (гороха, фасоли, рапса).
Литература:
- Поп М. С. Гетерополи- и изополиоксометаллаты. Новосибирск: Наука, 1990. –232 c.
- Казанский Л. П., Торченкова Е. А., Спицын В. И. Структурные принципы в химии гетерополисоединений. // Усп. хим. 1974. Т.43. № 7. С.1137–1156.
- Никитина Е. А. Гетерополисоединения/ Е. А. Никитина/М.: Госхимиздат, 1962.–424 с.







