Данная работа посвящена исследованию противогрибковой активности оксида вольфрама (III) WO3 на активность экзокаталазы A. niger в условиях отсутствия и присутствия постоянного магнитного поля. Объектом изучения выступал вид грибов, полученный из Всероссийской коллекции микроорганизмов (ИБФМ РАН, Пущино): Aspergillus niger van Tieghen ВКМF-1119. Эксперименты проводили с постоянным магнитом с магнитной индукцией 0,03 Тл. В ходе работы было выяснено, что исследуемые соединения способны подавлять активность внеклеточной каталазы гриба A. niger как в условиях отсутствия постоянного магнитного поля, так и в условиях его воздействия. В условиях действия магнитного поля более эффективно снижалась активность внеклеточной каталазы гриба A. niger.
Ключевые слова: микробиология, магнитобиология, биодеструкция.
Благодаря пластичности метаболических процессов микроскопические грибы способны использовать в качестве источников питания не только природные, но и различные синтетические материалы и изделия из них. Для таких грибов часто используется термин «технофилы» [1], самым распространенным из которых считается Aspergillus niger . Технофильные грибы способны быстро адаптироваться к постоянно появляющимся современным материалам и средствам их защиты. В связи с этим возникает потребность в изучении особенностей метаболизма микроскопических грибов, участвующих в процессах биоповреждений промышленных материалов и изделий из них, а именно A. niger .
Известно, что основными экзометаболитами грибов, принимающими участие в процессе биодеградации полимерных материалов, являются ферменты, главным образом, оксидоредуктазы [8, 10]. Выявление экзоферментов у грибов-деструкторов, а также количественная оценка их активности позволяет прогнозировать возможные механизмы биодеградации материалов и изделий при их эксплуатации, а также целенаправленно и эффективно осуществлять подбор средств защиты (биоцидных препаратов) изделий от биоповреждений, вызываемых микроскопическими грибами [4]. Известно, что оксид вольфрама (WO 3 ) снижает активность внеклеточной каталазы гриба A. niger .
Оксид вольфрама (WO 3 ) обладает токсическими свойствами в отношении бактериальных клеток, а грибы обладают меньшей чувствительностью, но при воздействии дополнительных условий характер и сила воздействия на различные клетки значительно отличается. Многочисленные исследования [7] показывают, что мицелиальные грибы развиваются активнее при воздействии на них постоянного магнитного тока, поэтому для дальнейших исследований и практического важно проверить особенности их действия частиц оксида вольфрама (WO 3 ) в постоянном магнитном поле.
Свойства частиц оксидов металлов зависят от их размера, интенсивности освещения [3]. Теоретически более мелкие частицы должны быть более токсичными, но экспериментально влияние размера на цитотоксичность приводит к противоречивым результатам [11]. Размер частиц в условиях эксперимента может изменяться, что не позволяет оценивать их токсичность на клетки бактерий и грибов, поэтому нужно учитывать фактический истинный размер. Именно поэтому следует рассматривать субмикронные частицы оксида металла. Вольфрам относится к парамагнетикам, его магнитная восприимчивость равна 0,32·10 −9 , действие нужного поля принуждает атомы занять упорядоченную позицию [6, 9].
Экспериментальная часть и обсуждение
В эксперименте использовалось постоянное магнитное поле, полученное с помощью постоянного магнита с магнитной индукцией 0,03 Тл.
В качестве тест-культуры микроорганизмов использовали штамм мицелиального гриба, полученный из Всероссийской коллекции микроорганизмов (ИБФМ РАН, Пущино): Aspergillus niger van Tieghen ВКМF-1119. Объектом исследования являлся оксид вольфрама (III) (WO 3 ) со средним размером частиц ~ 670 нм.
Полученную биомассу мицелиального грибы делили на 6 равных частей и помещали в стерильные бюксы с 10 мл стерильной среды Чапека-Докса и вносили навески оксида вольфрама (WO 3 ) (2 мг/мл конечного объема). Воздействие на объект осуществляют постоянным магнитным полем; длительность экспозиции — 120 минут. Далее — переносили биомассу с питательной средой и оксидом вольфрама в колбы (100 мл), культивировали на качалках при температуре 25±2°С, скорость — 120 об/мин в течение 7 суток.
Определение активности каталазы проводилось спектрофотометрически (СФ-2000). В качестве субстрата использовался 30мМ пероксид водорода (Li, Shellhorn, 2007). Измерения проводились при
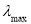
Активность каталазы рассчитывалась по формуле:
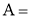
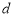
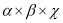
Активность внеклеточной каталазы выражали в единицах оптической плотности, отнесенных на 1 г белка (метод Лоури-Фолина), и пересчитывали в процентах от контроля.
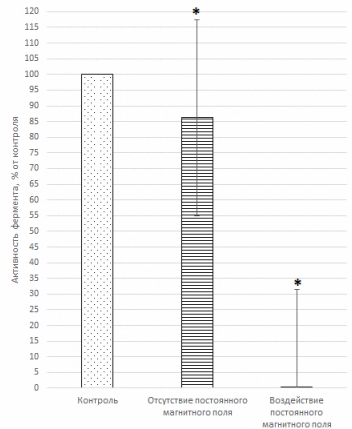
Рис. 1. Активность внеклеточной каталазы гриба A. niger в присутствии WO 3 в условиях отсутствия и воздействия постоянного магнитного поля
Символом «*» отмечены варианты, статистически отличные от контроля при уровне значимости р ≤ 0.05.
Анализ данных, представленных на рис. 1, показал, что исследуемые соединения снижали активность внеклеточной каталазы гриба A. niger как в условиях отсутствия постоянного магнитного поля, так и в условиях его воздействия по сравнению с контролем. В условиях действия магнитного поля более эффективно снижалась активность внеклеточной каталазы гриба A. niger .
Известно, что снижение ферментативной активности может происходить в результате следующих механизмов:
- Воздействие биоцида на активный центр фермента или его структуру;
- Нарушение синтеза фермента de novo [2];
- Изменение выходы ферментов из клетки в культуральную среду вследствие нарушения проницаемости мембраны [5].
Мы не располагаем данными, что имело место в нашем случае. Это не входило в цели и задачи нашего исследования и возможно будет исследовано в дальнейшем.
Данные результаты вносят существенный вклад в изучение действия мелкодисперсных частиц оксидов металлов, проявляющих фотокаталитическую активность, на микроорганизмы.
Весьма перспективным является создание самостерилизующихся поверхностей, содержащих мелкодисперсные частицы оксидов металлов. Можно предположить, что, подбирая характеристики магнитного излучения, предоставляется возможным регулировать антимикробную активность избирательно по отношению к определенным видам микроорганизмов.
Литература:
- Аникина Н. А., Смирнов В. Ф., Смирнова О. Н. и др. Биоповреждение систем лакокрасочных покрытий, вызываемых микроскопическими грибами // Экология и промышленность России. 2016. Т.20. Вып.6. С.26–29.
- Безбородов А. М., Загустина Н. А., Попов В. О. Ферментативные процессы в биотехнологии. М.: Наука, 2008. 335с.
- Букина Ю. А., Сергеева Е. А. Получение антибактериальных текстильных материалов на основе микрочастиц серебра посредством модификации поверхности текстиля неравновесной низкотемпературной плазмой // Вестник Казанского технологического университета. 2012. Вып.7. С.125–128.
- Залепкина С. А., Смирнов В. Ф., Смирнова О. Н. и др. Фунигицидный эффект 2-селенил-1-пиридин-1-оксида и его производных и их действие на активность оксидоредуктаз и рост Aspergillus oryzae // Микология и фитопатология. 2018. Т.52. Вып.4. С.267–276.
- Касатова Е. С., Стручкова И. В., Аникина Н. А. и др. Действие слабого низкочастотного электромагнитного поля на активность экстрацеллюлярных оксидоредуктаз Trichoderma virens // Микология и фитопатология. 2017. Т.51. С.99–103.
- Курлов А. С., Назарова С. З., Гусев А. И. Магнитная восприимчивость и термическая стабильность размера частиц нанокристаллического карбида вольфрама WC // Физика твердого тела. 2007. Т. 49. Вып. 9. С. 1697–1703.
- Смирнов В. Ф., Смирнова О. Н., Аникина Н. А. и др. Действие биоцидов на содержание органических кислот у грибов — деструкторов технических изделий, эксплуатируемых в условиях тропического климата (Вьетнам) // Коррозия: материалы, защита. 2020. Вып.6. С.39–48.
- Сухаревич В. И., Кузикова И. Л., Медведева Н. Г. Защита от биоповреждений, вызываемых грибами. СПб.: ЭЛБИ-СПб, 2009. 207с.
- Хоперсков А. В., Захарченко В. Д.. Способ оперативного контроля подлинности изделий из золота от подделок .
- Цымбал О. А., Панкратов А. Н., Цивилева О. М. и др. К вопросу о методике оценки потенциала фунгицидной активности съедобных грибов при интродукции органических селенидов // Успехи медицинской микологии. 2013. Т.11. С.310–313.
- Covino S., Stella N., Cajthaml T. Mycoremediation of organic pollutans: opportunities, and pitfalls // Fungal applications in sustainable environmental biotechnology. 2016. P.185–213.
- Yamamoto O. Influence of particle size on the antibacterial activity of zinc oxide // Int. J. Inorg. Mater. 2001. V.3. P.643







