В последние десятилетия отмечается широкое внедрение высокотехнологичного медицинского оборудования экспертного класса в клиническую практику, что открывает, в свою очередь, новые перспективы в лучевой диагностике. Магнитно-резонансная томография, являясь высокотехнологичным методом лучевой диагностики открывает новые горизонты в диагностике опухолевых образований почек путем получения снимков высокого разрешения и качества.
Для решения поставленных целей нами были обследованы 52 больных со злокачественными образованиями почек. Всем обследованным больным были проведены комплексные методы лучевой диагностики, такие как ультразвуковое исследование, мультиспиральная компьютерная томография и для детального изучения изображения проведена магнитно-резонансная томография.
Ключевые слова: злокачественные образования, почка, магнитно-резонансная томография, МРТ, мультиспиральная компьютерная томография, МСКТ, ультразвуковое исследование, УЗИ.
Введение. Злокачественные образования почек у взрослых составляют около 2–3 % всех новообразований почек. Заболеваемость злокачественными образованиями почек встречается 2 раза чаще у мужчин, чем у женщин [1, 2, 3, 4, 5].
Возможности современных высокотехнологичных методик лучевой диагностики с каждым годом повышается, это в свою очередь поднимает качество диагностики на новый уровень. Комплексное применения лучевых методов диагностики при злокачественных образованиях почек основано на комплексном применении данных УЗИ, КТ и МРТ [6, 7, 8, 9, 10].
Цель. Оценить возможности лучевых методов диагностики при раках почек.
Материалы и методы. Для оценки возможностей лучевых методов диагностики у больных с раком почек было проведено исследование в Республиканском специализированном научно-практическом Медицинском Центре Онкологии и Радиологии (РСНПМЦОиР) Минздрава РУзб за период с 2020 по 2022 годы. С учетом клинико-лабораторных данных пациенты были разделены на две группы: группа сравнения 25 (32,5 %), группа пациентов со злокачественными образованиями почек 52 (67,5 %). Из 52 обследованных больных со злокачественными образованиями почек 28 (53,8 %) мужчин и 24 (46,2 %) женщин, средний возраст которых составил 55,3±1,4.
Все пациенты были обследованы с помощью ультразвукового аппарата Mindray DC 60, мультиспиральной компьютерной томографии GE Revolution 128 и магнитно-резонансной томографии GE Evolution 1.5T.
На первом этапе проводилось стандартное ультразвуковое исследования почек и мочевыделительной системы в В-режиме для оценки паренхимы почек и новообразований, их контуров, размеров и внутренней структуры опухоли. Для оценки параметров кровотока в сосудах почек, а также патологических образованиях проводилось цветовое допплеровское картирование. На втором этапе было проведено мультиспиральная компьютерная томография без контрастирования (нативное исследования). После нативных исследований была введена в/в контрастирование (с помощью автоматического инъектора) и проведена повторное МСКТ исследования в кортикомедуллярной фазе и нефротической фазе. Также была оценена выделительная фаза (через 5мин). Данная методика исследования была проведена исключительно при сложных ситуациях у 30 (57,7 %) больных, когда диагностирование была затруднена. На третьем этапе исследования была проведено МРТ брюшной полости для более детальной оценки характера злокачественного образования, ее контуров, внутренней структуры опухоли, размеров и наличие поражений лимфатической системы.
Результаты. Сучетом клинико-лабораторных данных пациенты были разделены на две группы: группа сравнения 25 (32,5 %), группа пациентов с злокачественными образованиями почек 52 (67,5 %) (рис. 1).
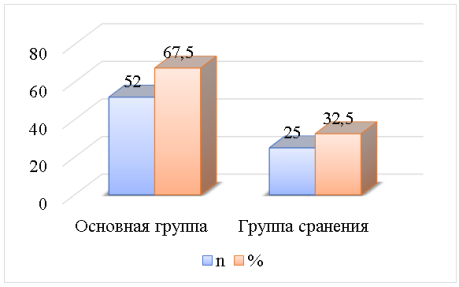
Рис. 1. Процентное соотношения обследованных больных (n=77)
По результатам статистического деления пациентов на группы можно отметить, что на возрастной диапазон от 50 лет до 59 лет приходится основная группа пациентов –67,3 %. На долю пациентов злокачественными образованиями (ЗОП) до 40 лет приходится лишь 3,8 % от общей совокупности случаев.
В таблице 1. представлено распределение всех пациентов с ЗОП 52 включенных в настоящее исследование в соответствие с классификацией pTNM.
Таблица 1
Распределение больных в зависимости от распространения злокачественных опухолей почек (n=52)
|
Распространенность первичной опухоли |
Число |
|||
|
n |
% |
|||
|
pT3а |
без признаков опухолевой венозной инвазии |
33 |
63,4 |
|
|
распространение опухоли в почечную вену |
9 |
17,3 |
||
|
pT3b |
5 |
9,6 |
||
|
pT3c |
2 |
3,9 |
||
|
pT4 |
распространение опухоли в НПВ |
подпеченочный сегмент НПВ |
2 |
3,9 |
|
надпеченочный сегмент НПВ |
1 |
1,9 |
||
|
Всего |
52 |
100,0 |
||
Гистологическое подтверждение ЗОП было у всех включенных в исследование пациентов (рис. 2): светлоклеточный вариант ЗОП был верифицирован у 45 (86,5 %) больных, папиллярный вариант ЗОП выявлен у 4 (7,7 %) пациентов, хромофобный в 3 (5,8 %) случаях.
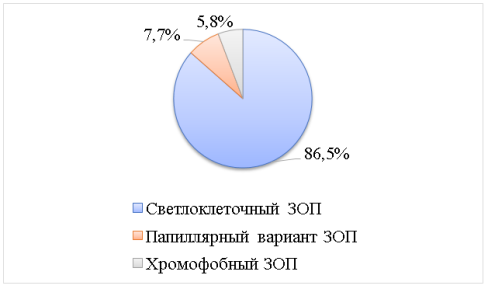
Рис. 2. Процент обследованных больных по гистологическому варианту ЗОП (n=52)
В большинстве наблюдений первичный опухолевый узел располагался в левой почке — 28 (53,8 %) случаев, правая почка была поражена опухолью у 24 (46,2 %) больных (рис. 3).
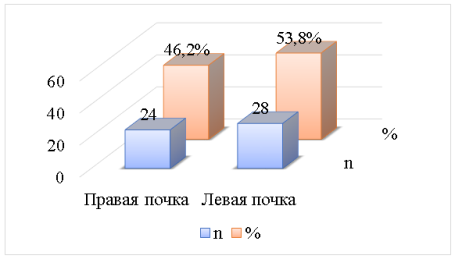
Рис. 3. Первичная локализация ЗОП рака почки (n=52)
Основной задачей инструментальной диагностики является определение размеров и локализации опухоли, ее инвазии в окружающие почку органы и ткани, оценка состояния регионарных ЛУ, а также выявления отдаленных метастазов.
В большинстве наблюдений (43 (82,7 %) из 52 случаев) ЗОП визуализировался в виде узлового образования, деформирующего наружный контур почки (в 90,4 % случаев при КТ, в 86,5 % случаев при МРТ). Узел имел частично четкие, частично нечеткие контуры (в 88,4 % случаев при КТ, в 61,5 % случаев при МРТ).
При МРТ контуры опухоли выглядели четкими значительно чаще (20 больных, 38,5 %), чем при УЗИ (13 больных, 25,0 %) и КТ (6 больных, 11,6 %), что объясняется лучшей дифференцировкой мягкотканых элементов при МРТ. В остальных случаях контуры опухоли по данным всех исследований представлялись частично четкими, частично нечеткими.
По данным МРТ образование было чаще неоднородной (в 88,5 % случаев), иногда кистозной структуры (11,5 %). У одной трети больных (у 17 из 52) диаметр опухоли составлял 2–4 см. Диаметр наименьшей выявленной нами при КТ и МРТ опухоли составлял 1 см (5 пациентов, 9,6 %). Крупные опухоли (диаметром более 10 см) выявлены у 18 пациентов, при этом у 7 из них выявлено практически тотальное поражение почки, что одинаково отображалось при УЗИ, КТ и МРТ.
Следует отметить, при МРТ в 2 случаях диаметр узловых образований оказался несколько меньше, чем при КТ, что наиболее отчетливо определялось на Т2-изображениях и соответствовало интраоперационным находкам. Подобное расхождение объяснялось тем, что при КТ границы опухоли выглядели менее четкими, чем при МРТ. Отмечено, что МРТ позволяет более четко, чем КТ, визуализировать мелкие интрапаренхиматозные опухоли (при КТ изменения формы почки не определялось у 3 больных, при МРТ — у 5).
Диффузная гиперплазия (неравномерное утолщение) практически всей почки (при значительном поражении) при УЗИ, КТ и МРТ визуализировалась одинаково. В 2 наблюдениях определявшиеся при УЗИ очаговые образования в почке не визуализировались при КТ. Отмечалось лишь локальное утолщение почечной паренхимы без четких границ. МРТ (Т2-изображения) в обоих случаях позволила отчетливо выявить и саму опухоль, и ее внутреннюю структуру, и даже капсулу.
У 17 (32,7 %) из 52 больных при МРТ отчетливо определялась капсула опухоли, которая наилучшим образом визуализировалась на Т2-изображениях в виде периферического ободка с низкой интенсивностью сигнала. Капсула чаще определялась при опухолях диаметром до 4 см (33 больных, 63,5 %), реже при крупных (19 больных, 36,5 %).
При КТ капсула опухоли четко определялась только у 2 (3,9 %) из 52 больных: в одном случае при кистозном варианте РП, во втором случае при выраженном обызвествлении. Неоднородность структуры опухоли за счет тканевых изменений (некроз или кровоизлияния) наилучшим образом визуализировалась при МРТ на Т2-изображениях в виде участков повышенной интенсивности сигнала (46 больных, 88,5 %). При КТ неоднородность внутренней структуры обычно была более выражена в крупных новообразованиях, что особенно хорошо выявлялось при в/в контрастировании (30 больных, 57,7 %).
Интенсивность отображения узлов РП была разной. На Т1-изображениях в 22 (42,3 %) случаях они представлялись гипоинтенсивными, в 21 (40,4 %) — изоинтенсивными, в 2 (3,8 %) — гиперинтенсивными, в 7 (13,5 %) — со смешанной (неоднородной) интенсивностью сигнала. На Т2-изображениях узлы визуализировались в 20 (38,4 %) случаях как изоинтенсивные, в 13 (25,0 %) — как гиперинтенсивные, в 7 (13,5 %) — как гипоинтенсивные, в 12 (23,1 %) как узлы со смешанной интенсивностью сигнала.
В/в контрастирование проведено у 17 (32,7 %) больных из 52. Максимальное «усиление» узлов при в/в контрастировании отмечено в кортико-медуллярную фазу исследования (у 9 (52,9 %) из 17 больных). При этом небольшие опухоли и при КТ, и при МРТ «усиливались» равномерно, опухоли диаметром более 5 см «усиливались» неравномерно, в основном по периферии.
Врастание опухоли в соседние органы подозревали при выраженных изменениях контуров смежного органа, отсутствии разделительных жировых прослоек и изменении нормальной интенсивности сигнала от вовлеченных тканей. Необходимо отметить, что при МРТ инвазия соседних органов визуализировалась более наглядно. В 1 случае при МРТ удалось четко определить границу между опухолью почки и медиальной поверхностью печени и тем самым отвергнуть сделанное по данным КТ предположение о вовлечении печени в опухолевый процесс.
Венозная опухолевая инвазия во внутриорганные и почечную вены были выявлены у 9 (17,3 %) больных. В 6 (11,5 %) случаях неопластический процесс распространялся в нижнюю полою вену (НПВ) от устья почечной вены до устьев печеночных вен. У 2 (3,9 %) пациентов, краниальный отдел опухоли локализовался в ретропеченочном отделе НПВ или распространялся выше, в ее грудной отдел, но не пролабировал в полость правого предсердия. У 1 (1,9 %) случаи имело место распространение неопластического процесса из первичного очага в почке по почечной и НПВ в полость правого предсердия.
У 5 (9,6 %) пациентов в стадии pT3a была выявлена опухоль единственно функционирующей почки. Еще в 1 (1,9 %) случае имела место крупная опухоль единственной левой почки, распространяющаяся в просвет почечной и периренального отдела НПВ.
Сопоставление данных УЗИ, МРТ и интраоперационных находок показало, что для того, чтобы уточнить предварительные данные УЗИ и получить подробную информацию о местной и регионарной распространенности опухолевого процесса, достаточно проводить только одно дополнительное исследование — МРТ.
Размеры, форма, границы опухолей и их внутренняя структура при МРТ отображались столь отчетливо, что другие исследования (КТ, ангиография) для уточнения их местной и регионарной распространенности не требовались. При сопоставлении данных МРТ с интраоперационными находками отмечено полное совпадение результатов у всех оперированных больных. Опухолевый тромбоз нижней полой и почечных вен и его протяженность были точно выявлены при МРТ у всех пациентов. Расхождений с интраоперационными данными не было. Врастание опухоли почки в смежные органы диагностировано у 3 пациентов. Увеличенные лимфатические узлы выявлены у 26 из 52 больных. И то, и другое было подтверждено при последующем хирургическом вмешательстве.
Вывод. Применение неинвазивного и неионизирующего метода МРТ у больных с раком почек позволило оценить степень развития образования в почках, установить структурные изменения на разных стадиях течения заболевания, осуществлять динамический мониторинг за состоянием больных и оценить прогноз течения заболевания.
Каждый из изученных методов комплексной лучевой диагностики имеет определенную роль и место в уточняющей диагностике рака почек у больных. Изученные нами МРТ метод, как высокоинформативные технологии неинвазивной и неионизирующей диагностики, рекомендуются для более широкого внедрения в различных звеньях здравоохранения.
Литература:
- Coulange C., Brethean D. The annual national epidemiologic survey of tumors of the kidney. April 1993 — March 1994, 970 patients // Prog. Urol. — 1995. — Vol. 5, N 4. — P. 529–539.
- Kim J. K., Kim T. K., Ahn H. J. et al. Differentiation of subtypes of renal cell carcinoma on helical CT scans // AJR. — 2002. — Vol. 178, N 6. — P. 1499–1506.
- Robles J. E., Rosell D., Zudaire J. J. et al. Epidemiology of tumors of the renal parenchyma // Rev. Med. Univ. Navarre. — 1999. — Vol. 43, N 2. — P. 68–76.
- Schmid H. P., Szabo J. Renal cell carcinoma — a current review // Schweiz. Rundsch. Med. Prax. — 1997. — Vol. 86, N 20. — P. 837–843.
- Tavani A., La Vecchia C. Epidemiology of Renal Cell Carcinoma // J. Nephrol. — 1997. — Vol. 10, N 2. — P. 93–106
- Акберов Р. Ф. Многофазовая КТ-ангиография в диагностике новообразований почек «малых» размеров /Р. Ф. Акберов, С. С. Шлыков, Е. В. Пузакин, С. А. Рыжкин //Медицинская визуализация (М.). -2010. — Спец. вып. «Радиология-2010». — С. 14–15.
- Акберов Р. Ф. Оптимизация лучевых методов исследования в диагностике новообразований почек «малых» размеров: учебно-методическое пособие /Р. Ф. Акберов, С. С. Шлыков, И. М. Михайлов, Е. В. Пузакин. — Казань, 2011. — 24 с.
- Айрапетова Г. Д. Магнитно-резонансная томография в диагностике почечно-клеточного рака / Г. Д. Айрапетова, А. Б. Лукьянченко, В. Б. Матвеев // Вестник онкологии. 2007. — № 2. — С. 54–59.
- Аляев, Ю. Г. Возможности методов визуализации в диагностике и мониторировании опухоли почки. / Ю. Г. Аляев, Н. Д. Ахвледиани, Д. Н. Фиев, и соавт. // Экспер. и клинич. урология. — 2011. — № 2–3. — С.96–97.
- Матвеев, Б. П. Опухоли почечной паренхимы. В кн.: Клиническая онкоурология. / Под ред. Б. П. Матвеева // М.: АБВ-пресс, 2011. — С.11– 225.







