В данной работе проведен дизайн синтеза ахирального производного талидомида с учетом факторов препаративности и эффективности. Первая методика основана на присоединении амида малоновой кислоты к производному урацила, а вторая — на диеновом синтезе.
Ключевые слова: талидомид, множественная миелома, дизайн синтеза, цереблон.
Талидомид применялся в качестве седативного средства, однако в 1960-х годах выяснилось, что он обладает высокой тератогенной активностью. Позже талидомид стал назначаться для лечения множественной миеломы и лепры. По последним данным около 10 % всех онкогематологических заболеваний составляет множественная миелома [1]. Общая выживаемость пациентов с ММ значительно возросла за последние 15 лет благодаря включению в их лечение новых препаратов, таких как иммуномодуляторы, ингибиторы протеасом и моноклональных антител. Значимость ангиогенеза в росте опухоли и метастазировании привела к изучению и разработке антиангиогенных средств, в том числе Талидомида и его аналогов, в качестве противоопухолевых лекарственных средств. Талидомид был первым из этих препаратов, у которого была продемонстрирована клиническая активность. Он представляет собой рацемат. Ранее в эксперименте in silico было показано, что ахиральный аналог талидомида, 2-(2,6-диоксо-1,2,5,6-тетрагидропиридин-3-ил)изоиндолин-1,3-дион, эффективно связывается с цереблоном. Талидомид — соединение группы пиперидинов, α-фталимидо-глутаримид (систематическое название IUPAC, 3-(RS)-2-(2,6-диоксо-3-пиперидил)изоиндол-1,3-дион), содержит один хиральный центр (C3-атом углерода глутаримидного кольца) и существует виде двух (R)- (+) и (S)- (−) энантиомеров. (R)-энантиомер проявляет седативный эффект, в то время как (S)-энантиомер ответственен за тератогенность. Но введение чистого (R)-энантиомера также приводит к серьезным нарушениям в развитии плода из-за рацемизации в физиологических условиях. Ниже приведена схема рацемизации талидомида в водном растворе:
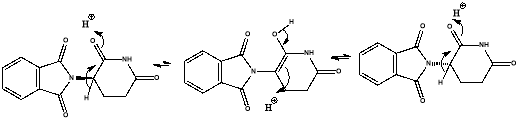
Рис. 1. Рацемизация талидомида в растворе
С тех пор, как талидомид был запрещен, ввиду своих тератогенных свойств, было показано, что препарат проявляет антиангиогенную, противовоспалительную и антимиеломную активность. Неоангиогенез является основным фактором роста, развития и метастазирования опухоли. Талидомид и его производные связывают цереблон (CRBN) и ингибируют или способствуют убиквитинированию целевых субстратов, таких как Cys2-His2 (C2H2) и белка IKZF3 с помощью комплекса CRL4A-CRBN (Cullin-RING ligase 4).
Также было показано, что талидомид блокирует активность факторов ангиогенеза, таких как bFGF (основной фактор роста фибробластов), VEGF (фактор роста эндотелия сосудов) и интерлейкин-6, помимо снижения TNF-α. Следовательно, талидомид — синтетический иммуномодулирующий препарат, обладающий противоопухолевым и противовоспалительным действием. Талидомид и его аналоги используются в терапии широкого спектра заболеваний, таким образом, разработка новых синтетических методов получения его аналогов является достаточно перспективной. Как было упомянуто ранее, в эксперименте in silico было показано, что ахиральный аналог талидомида (рис.2) проявляет высокую аффинность к белку цереблону. В данной работе будут представлены способы получения данного соединения.
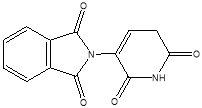
Рис. 2. Ахиральный аналог талидомида
Цель исследования. Осуществить дизайн синтеза ахирального аналога талидомида и провести сравнительную характеристику предложенных методик на основе таких факторов, как и экологичность, экономическая эффективность, выход, временной фактор, и выявить наиболее рациональную для использования в лабораторных и промышленных условиях схему.
Материалы и методы. Для проведениядизайна cтруктур был использован программный пакет Chem office. Анализ синтетических схем получения талидомида и аналогичных веществ выполнен с помощью поиска в базах данных Beilstein, BMRB, CSD, Pubchem, JOC.
Результаты исследования:
На данный момент талидомид получают следующим образом:
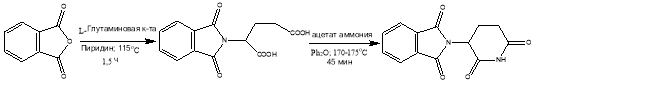
Рис. 3. Схема получения талидомида
Исходя из схемы мы предложили общую схему получения талидомидного аналога из ненасыщенного производного глутамина или продукта его циклизации:
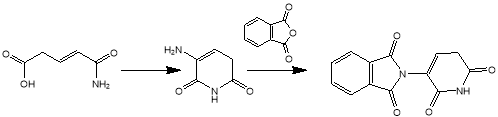
Рис. 4. Общая схема получения
Далее будут предложены методики получения ненасыщенного производного глутамина. Схему первой методики синтеза можно представить следующим образом:
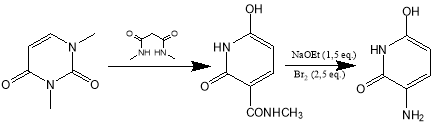
Рис. 5. Схема получения на основе производного урацила
Исходным веществом здесь является производное такого природного соединения, как урацил, 1,3-диметилурацил.
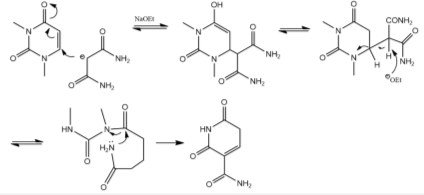
Рис. 6. Механизм перегруппировки
Производное урацила взаимодействует с амидом малоновой кислоты, в присутствии этилата натрия в качестве основания. На первой стадии происходит нуклеофильная атака молекулы урацила в положение 6, далее происходит раскрытие цикла с разрывом связи между атомами С1-С6 и образование нового пиперидинового цикла.
Следующий этап данного метода — перегруппировка Гофмана.
Вторая методика включает следующие превращения:
![Схема получения посредством [4+2] присоединения](https://moluch.ru/blmcbn/107157/107157.007.png)
Рис. 7. Схема получения посредством [4+2] присоединения
В данной схеме производное пиридина предполагается получить с помощью реакции Дильса-Альдера или, другими словами, [4+2] циклоприсоединением. Электронодонорные заместители делают используемый азадиен более реакционноспособным в качестве субстрата для диенового синтеза. В данном случае необходимо использовать именно активированный диен, т. к. диенофил должен иметь электроннодефицитную кратную связь, а в применяемом 1,1-диэтоксиэтене оба заместиителя электронодонорные. Следовательно, вступать в реакцию Дильса-Альдера с высоким выходом такой диенофил будет только с активированными диеном. На следующей стадии проводится окисление по Байеру-Виллигеру с последующим гидролизом полученного сложного эфира.
Последний предложенный нами метод представляет собой схему получения 3-аминопиридин-2,6(1H,3H)-диона из 3-аминопиперидин-2,6-диона. Галогенирование в α-положениие к карбонильной группе с помощью Br 2 в уксусной кислоте протекает по следующему механизму:
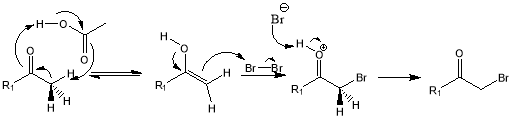
Рис. 8. Механизм бромирования
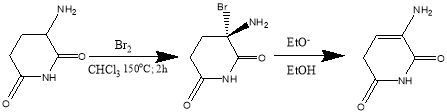
Рис. 9. Схема получения на основе глутаримида
Полученные в вышеописанных методиках соединения далее вводятся в реакцию с фталевым ангидридом для получения требуемого соединения, аналога талидомида.
Таблица 1
Сравнительная таблица
|
Схема 1 |
Схема 2 |
Схема 3 |
|
|
Экологичность |
+ |
+ |
+ |
|
Время |
+ |
+ |
+ |
|
Стоимость |
+ |
- |
+ |
|
Выход |
50–60 % |
60–70 % |
50–55 % |
Выводы: врезультате сравнительного анализа установлено, что все предложенные схемы достаточно экологичны, не предполагают длительный процесс синтеза. Однако разница в экономической эффективности и выходе продукта позволяет сделать следующие выводы: наиболее рациональным в промышленных условиях будет использование первой либо третьей методики, а для получения небольших количеств соединения, что исключает экономический фактор, с большим выходом удобнее использовать вторую схему.
Литература:
- Multiple myeloma Source: Globocan 2020 [Electronic resourse] / World Health Organization. — Mode of access: https://www.who.int/tb/publications/global_ report/en. — Date of access: 20.05.2022.
- Enantiomerization mechanism of thalidomide and the role of water and hydroxide ions / С. Tian [et al.] // Chemistry. — 2012. — Vol. 18, № 45. — P. 14305–14313.
- Paravar T. Thalidomide: Mechanisms of Action/ T. Paravar, J. Lee // J. International Reviews of Immunology. — 2008. –№ 27, P.111–135.
- F. Fatima Thalidomide: An Overview on Teratogenicity and its Newer Theraputic effects / Fatima F., Roshan S. // J. International Journal Of Pharmaceutical Research. — 2020. — Vol.18, № 1, P.115–142.
- Pyridine synthesis by [4 + 2] cycloadditions of 1-azadienes: hetero-Diels Alder and transition metal-catalysed approaches
- Galat A. A Synthesis of α,β-Unsaturated Amides / A. Galat // J. Chemistry Division. — 1948. — Vol.70, № 6. — P. 2596.







