В настоящее время существует ряд перспективных методов хирургического восстановления периферических нервов, где степень травмы кодирует ход операции. В зависимости от дефекта пластические хирурги придерживаются классических принципов лечения, а также внедряют в практику сопутствующую пересадку жировой ткани в область восстановления. Пересадка стволовых клеток жировой ткани выполняется в качестве дополнения к основной операции на периферических нервах, открывая новые горизонты регенерации. В статье представлены данные, полученные в ходе литературного обзора исследований, проводимых на лабораторных животных по поводу трансплантации жировой ткани во время фундаментальных операций на периферических нервах.
Ключевые слова: стволовые клетки, жировая ткань, повреждение нерва, восстановление, регенерация, аутотрансплантация, диастаз, кондуит, миелинизация, демиелинизация, факторы роста.
Несмотря на современные достижения, функциональное восстановление повреждённого периферического нерва остается актуальным вопросом микрохирургиии. Непродуктивная регенерация зачастую приводит к развитию отягощающей нейропатической боли, именно поэтому проблема сохранения мимики при репарации лицевого нерва является актуальным вопросом пластической хирургии, нейрохирургии и неврологии.
В современной практике при больших диастазах применяют аутотрансплантацию неповреждённого афферентного nervus cutaneus, что в послеоперационный период приводит к нарушению чувствительной иннервации повреждённой области, поэтому перспективным направлением аутотрансплантации в реконструкции нерва является восстановление повреждённого ствола нерва кондуитом, наполненным средой, стимулирующей регенерацию. Такие составляющие кондуита, как стволовые клетки, взятые из жировой ткани, обладают уникальными характеристиками. Стволовые клетки жировой ткани (далее — ADSCs) имеют аналогичный мезенхимальным стволовым клеткам красного костного мозга фенотип, а также облагаются сходными профилями генной экспрессиии.
Нейро-регенеративный потенциал рассматриваемой ткани объясняется Paracrine hypothesis, согласно которой ADSCs секретируют множество нейротрофических факторов, синтез которых опосредованно усиливается шванновскими клетками, что приводит к стимулированию миелинизации, регенерации, а также снижает вероятность фиброза нервной ткани.
Швановские клетки мигрируют к местам повреждения, выходя за пределы дистального сегмента нерва, где высвобождают факторы роста, способствуя регенерации нервов [2]. Молекулы, участвующие в морфологических изменениях, — например: c-Jun — в ответ на повреждение, обеспечивают аксоглиальные взаимодействия и регенерацию аксонных путей. [1] ADSCs также способны синтезировать экзосомы, что увеличивает выработку основного белка миелина, необходимого для миелинизации поврежденных периферических нервов после процесса демиелинизации.
В ходе литературного обзора, донорскими участками для забора ткани являлась передняя брюшная стенка и внутренняя поверхность бедра. Соблюдая главный принцип сбора жировой ткани — минимальная травматизация адипоцитов —, за последние 3 года различные исследования на лабораторных моделях отмечают высокую выживаемость и относительную регенерацию при использовании ADSCs в реконструкции повреждённых периферических нервов. [3] Сведем данные нашего анализа в графике на рис. 1.
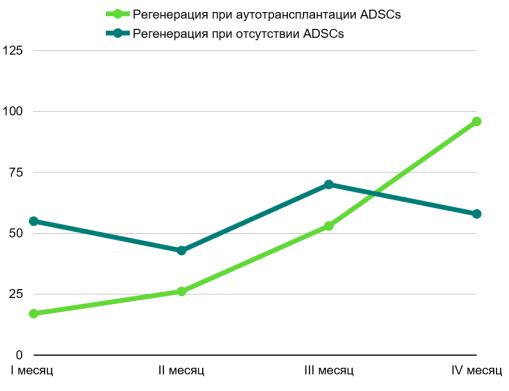
Рис. 1
График на рис. 1 отражает зависимость морфологической и функциональной регенерации у лабораторных животных на основании проанализированных исследований за последние 3 года.
Преимущества аутотрансплантации жировой ткани в реконструкции тотальных и субтотальных повреждений нерва выявляются в высоком проценте мультипотентных клеток, сниженной иммунногенности и высокой скорости пролиферации. Вероятность провокации экспрессии проонкогенов, а также длительное культивирование клеток становятся значительными недостатками метода, что приводит к ограничениям в использованиии принципа операции.
Таким образом, среда ADSCs является перспективным наполнителем кондуитов при реконструкции нервов. Аутотрансплантация жировой ткани открывает новые горизонты в области реконструктивной пластики поврежденного нерва, обеспечивая продуктивное восстановление. Эксперименты на животных демонстрируют неабсолютный успех при трансплантации ADSCs в ходе операции, поэтому необходимо проведение дополнительного исследования для демонстрации неоспоримой пользы.
Литература:
- Nocera, G.; Jacob, C. Mechanisms of Schwann cell plasticity involved in peripheral nerve repair after injury. Cell Mol. Life Sci. 2020, 77 , 3977–3989. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Jiang, L.; Mee, T.; Zhou, X.; Jia, X. Augmenting Peripheral Nerve Regeneration with Adipose-Derived Stem Cells. Stem Cell Rev. Rep. 2021. [Google Scholar] [CrossRef]
- Rhode, S.C.; Beier, J.P.; Ruhl, T. Adipose tissue stem cells in peripheral nerve regeneration-In vitro and in vivo. J. Neurosci. Res. 2021, 99, 545–560. [Google Scholar] [CrossRef] [PubMed]
- Razavi, S.; Jahromi, M.; Vatankhah, E.; Seyedebrahimi, R. Differential effects of rat ADSCs encapsulation in fibrin matrix and combination delivery of BDNF and Gold nanoparticles on peripheral nerve regeneration. BMC Neurosci. 2021, 22, 50. [Google Scholar] [CrossRef]
- Nakajima, T.; Tada, K.; Nakada, M.; Matsuta, M.; Tsuchiya, H. Facilitatory effects of artificial nerve filled with adipose-derived stem cell sheets on peripheral nerve regeneration: An experimental study. J. Orthop. Sci. 2021, 26, 1113–1118. [Google Scholar] [CrossRef]
- Jahromi, M.; Razavi, S.; Seyedebrahimi, R.; Reisi, P.; Kazemi, M. Regeneration of Rat Sciatic Nerve Using PLGA Conduit Containing Rat ADSCs with Controlled Release of BDNF and Gold Nanoparticles. J. Mol. Neurosci. 2021, 71, 746–760. [Google Scholar] [CrossRef] [PubMed]
- Rhode, S.C.; Beier, J.P.; Ruhl, T. Adipose tissue stem cells in peripheral nerve regeneration-In vitro and in vivo. J. Neurosci. Res. 2021, 99, 545–560. [Google Scholar] [CrossRef] [PubMed]
- Gonzalez Rodriguez, A.; Gonzalez Porto, S.A.; Comellas Melero, N.; Arufe, M. C. Acellular nerve graft enriched with mesenchymal stem cells in the transfer of the phrenic nerve to the musculocutaneous nerve in a C5-C6 brachial plexus avulsion in a rat model. Microsurgery 2021. [Google Scholar] [CrossRef][PubMed]
- Yang, Z.; Yang, Y.; Xu, Y.; Jiang, W.; Shao, Y.; Xing, J.; Chen, Y.; Han, Y. Biomimetic nerve guidance conduit containing engineered exosomes of adipose-derived stem cells promotes peripheral nerve regeneration. Stem Cell Res. Ther. 2021, 12, 442. [Google Scholar] [CrossRef] [PubMed]
- Dehdashtian A, Bratley JV, Svientek SR, Kung TA, Awan TM, Cederna PS, Kemp SW. Autologous fat grafting for nerve regeneration and neuropathic pain: current state from bench-to-bedside. Regen Med. 2020 Oct;15(10):2209–2228. doi: 10.2217/rme-2020–0103. Epub 2020 Dec 2. PMID: 33264053.
- Arif F, Rahman MF, Khan CF. Adipose derived stem cells for the peripheral nerve regeneration: review of techniques and clinical implications. J Pak Med Assoc. 2023 Feb;73(Suppl 1)(2):S148-S154. doi: 10.47391/JPMA.AKUS-24. PMID: 36788407.







