Введение
Загрязнение окружающей среды, особенно загрязнение воды, становится все более животрепещущей проблемой во всем мире. Причиной такой ситуации является быстрый рост промышленного производства. Как известно, промышленные сточные воды содержат большое количество органических пигментов, ионов тяжелых металлов и многих других токсичных веществ, будут вызывать загрязнение воды, если их не очищать. Если сточные воды не будут проходить очистку, то их попадание в окружающую среду может вызвать негативные последствия как для экосистемы, так и для самого человека. На сегодняшний день существует множество методов очистки водных ресурсов, таких как биохимического окисления, адсорбции, ионного обмена, фоторазложения... Из всех специальных методов очистки воды, метод восстановления пигментов до нейтральной, бесцветной и нетоксичной формы привлекает внимание многих исследователей во всем мире [1–5].
Было показано, что наноматериалы Cu/Fe 3 O 4 , синтезированные методом зеленой химии из экстракта зеленого чая, обладают хорошей каталитической активностью в реакции восстановления МB боргидридом натрия [2]. Однако факторы, влияющие на процесс получения экстракта зеленого чая, а также на процесс синтеза, а следовательно, и на каталитическую активность материала, детально не были исследованы.
Цель настоящей работы — исследование влияния условий синтеза Cu/Fe 3 O 4 из экстракта зеленого чая на их каталитическую активность в реакции восстановления метиленового синего боргидридом натрия.
Экспериментальная часть
Синтез материалов Cu/Fe 3 O 4 : Экстракт получили при нагревании 5–25 г листьев зеленого чая в 200 мл дистиллированной воды при 50–100 °C в течение 5–50 мин. Поместили 0,005–0,05 г Fe 3 O 4 в стеклянный стакан, содержащий 10 мл дистиллированной воды, и обрабатывали ультразвуком в течение 15 мин, чтобы создать суспензию Fe 3 O 4 в воде. Добавили в суспензии 50 мл раствора CuSO 4 1–10 ммоль/л, затем 1–10 мл экстракта зеленого чая, помешали смесь магнитной мешалкой при 40–70 o С в течение 5–50 мин. Полученный осадок (Cu/Fe 3 O 4 ) извлекали с помощью магнитов, промывали и сушили при 60 °С в течение 4 часов.
Катализ восстановления MB боргидридом натрия : добавили 4 мг адсорбента Cu/Fe 3 O 4 в 50 мл раствора MB 20 мг/л. Перемешали смесь магнитной мешалкой в течение 60 мин до достижения адсорбционного равновесия. К смешанному раствору добавили 1 мл раствора 0,2 M NaBH 4 и 1,5 M NaOH. Перемешали смесь магнитной мешалкой в течение 20 мин. Через каждые 4 мин отсасывали примерно 3 мл раствора и измерили оставшуюся концентрацию MB в растворе. После завершения фотометрических измерений раствор сливали обратно в реакционную колбу.
Обсуждение результатов
1. Влияние условий экстракции зеленого чая
Зависимость константы скорости восстановления MB боргидридом натрия от массы зеленого чая представлен на рис. 1.
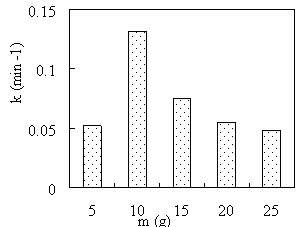
Рис. 1. Зависимость константы скорости восстановления МB от массы зеленого чая
Из рис. 1 видно, что масса зеленого чая сильно влияет на каталитическую активность материала Cu/Fe 3 O 4 . При увеличении массы зеленого чая с 5 г до 25 г скорость реакции восстановления MB быстро возрастала, а затем постепенно снижалась. Наибольшее значение константы скорости было достигнуто при использовании катализатора Cu/Fe 3 O 4 , синтезированного из экстракта с соотношением 10 г зеленого чая на 200 мл дистиллированной воды. Это можно объяснить тем, что при увеличении массы зеленого чая содержание восстановителей в экстракте, следовательно, количество образовавшейся Cu увеличивается. Cu действует как каталитический центр, поэтому каталитическая активность материала возрастает. Однако при массе зеленого чая выше 10 г количество восстановителя в экстракте может быть слишком большим, в результате чего реакция восстановления Cu 2+ до Cu будет происходить в объеме раствора, а не на поверхности Fe 3 O 4 . Уменьшение содержания Cu в материале является причиной снижения каталитической активности материала.
Время и температура экстракции также сильно влияют на каталитическую активность материала Cu/Fe 3 O 4 . Соответственно, при увеличении время экстракции зеленого чая с 10 мин до 50 мин скорость восстановления MB постоянно возрастала, а затем внезапно снижалась (Рис. 2a). При повышении температуры экстракции от 50 °С до 100 °С скорость восстановления МB быстро возрастает, затем медленно возрастает (Рис. 2b).
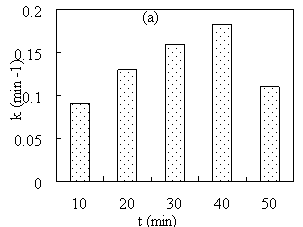
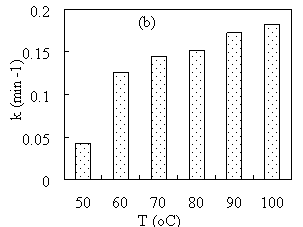
Рис. 2. Зависимость константы скорости восстановления MB от времени (a) и температуры (b) экстракции
Влияние времени и температуры экстракции на каталитическую активность материала Cu/Fe 3 O 4 может быть связано с влиянием времени и температуры экстракции на количество восстановителя, диффундирующего в экстракт. Соответственно, с увеличением времени экстракции количество восстановителя, диффундирующего в экстракт увеличивается. Однако, когда время экстракции слишком велико (t > 40 min), восстановители в экстракте могут разложиться и потерять активность. При повышении температуры процесс проникновения растворителя будет происходить быстрее, поэтому количество восстановителя, диффундирующего в экстракт увеличивается.
Таким образом, подходящими условиями экстракции зеленого чая для подготовки экстракта для синтеза Cu/Fe 3 O 4 являются: 10 г зеленого чая на 200 мл дистиллированной воды; время экстракции: 40 мин; температура экстракции: 100 o C.
2. Влияние условий синтеза наноматериалов
Влияние объема экстракта, температуры и времени синтеза наноматериалов, концентрации CuSO 4 и содержания Fe 3 O 4 на каталитическую активность материалов Cu/Fe 3 O 4 было исследовано.
Результаты экспериментов показывают, что объем экстракта зеленого чая сильно влияет на каталитическую активность материала Cu/Fe 3 O 4 . При увеличении объема экстракта с 1 мл до 10 мл скорость восстановления MB возрастала, а затем постепенно снижалась.
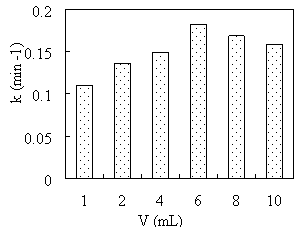
Рис. 3. Зависимость константы скорости восстановления МB от объема экстракта
Это можно объяснить тем, что увеличение объема экстракта зеленого чая означает увеличение содержания восстановителя, поэтому каталитическая активность материала Cu/Fe 3 O 4 увеличивается. Однако при слишком большом количестве восстановителя реакция восстановления Cu 2+ до Cu происходит быстро, образующиеся частицы Cu не успевают прикрепиться к носителю Fe 3 O 4 , а остаются во взвешенном состоянии в растворе, поэтому каталитическая активность Cu/Fe 3 O 4 снижается.
Эксперименты показывают, что время и температура синтеза наноматериалов также сильно влияют на каталитическую активность Cu/Fe 3 O 4 .
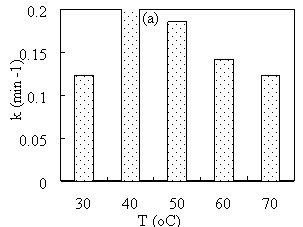
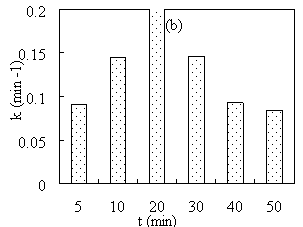
Рис. 4. Зависимость константы скорости восстановления МB от температуры (a) и времени (b) синтеза наноматериалов
Из рис. 4 видно, что при увеличении температуры и времени синтеза наноматериалов каталитическая активность материала Cu/Fe 3 O 4 увеличивается, а затем постепенно снижается.
Температура синтеза влияет не только на скорость образования Cu, но и на дисперсионную способность носителя Fe 3 O 4 в растворе. Повышение температуры до 40 о С увеличивает скорость восстановления Cu 2+ , поэтому каталитическая активность Cu/Fe 3 O 4 возрастает. Однако при высоких температурах частицы Fe 3 O 4 быстро коагулируют. Следовательно, реакция образования Cu на поверхности носителя не благоприятна, и каталитическая активность полученного материала снижается.
Влияние времени синтеза наноматериалов на каталитическую активность материала может быть связано с влиянием времени на содержание Cu в полученном материале Cu/Fe 3 O 4 . С увеличением времени реакции количество образующейся Cu увеличивается, как следствие, каталитическая активность материала повышается. Однако, когда время синтеза слишком велико, кристаллы Cu, образовавшиеся на носители Fe 3 O 4 , могут снова попасть в раствор. Следовательно, каталитическая активность материала Cu/Fe 3 O 4 снижается.
Влияние концентрации CuSO 4 и массы Fe 3 O 4 на каталитическую активность материала Cu/Fe 3 O 4 показано на рис. 5.
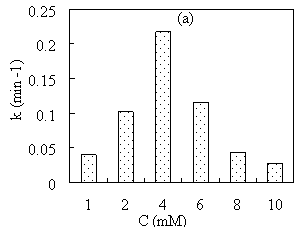
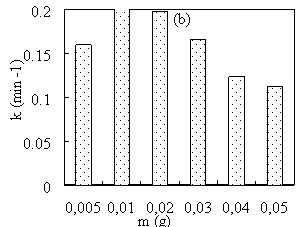
Рис. 5. Зависимость константы скорости восстановления MB от концентрации CuSO 4 (a) и массы Fe 3 O 4 (b)
Эксперименты показывают, что при увеличении концентрации раствора CuSO 4 от 1 ммоль/л до 10 ммоль/л каталитическая активность материала Cu/Fe 3 O 4 быстро возрастает, а затем резко снижается. При увеличении массы носителя Fe 3 O 4 от 0,005 г до 0,05 г каталитическая активность полученного материала Cu/Fe 3 O 4 незначительно возрастала, затем постепенно снижалась.
Концентрация раствора CuSO 4 влияет не только на содержание, но и на размер образующихся наночастиц Cu. Соответственно, при низких концентрациях Cu образуется в форме коллоидных частиц. Поэтому содержание Cu в Cu/Fe 3 O 4 невелико и каталитическая активность материала плохая. Увеличение концентрации CuSO 4 приводит к образованию большего количества Cu, поэтому каталитическая активность материала значительно улучшается. Однако при слишком большой концентрации CuSO 4 реакция синтеза наноматериалов протекает быстро, образующиеся частицы Cu не прилипают к поверхности Fe 3 O 4 , а быстро флокулируют в растворе. В результате чего каталитическая активность материала снижается.
Как известно, Fe 3 O 4 действует как носитель, определяя магнетизм, а фаза Cu выступает как каталитический центр, определяя каталитическую активность материала. В принципе, чем больше содержание Fe 3 O 4 , тем ниже каталитическая активность материала. Однако в действительности, когда количество носителя слишком мало, частицы Cu, образующиеся на поверхности материала, будут иметь большой размер и, скорее всего, выпадут из носителя, тем самым снижая каталитическую активность материала Cu/Fe 3 O 4 .
Таким образом, подходящими условиями синтеза наноматериалов Cu/Fe 3 O 4 являются: 6 мл экстракта зеленого чая на 50 мл раствора CuSO 4 с концентрацией 4 ммоль/л; температура синтеза: 40 o C в течение 20 мин; масса носителя Fe 3 O 4 : 0,01 г.
Заключение
Факторы, влияющие на процесс экстракции, такие как масса зеленого чая, время и температура экстракции, и на синтез наноматериалов, такие, как объем экстракта, температура и время синтеза, концентрация CuSO 4 и масса носителя Fe 3 O 4 , сильно влияют на каталитическую активность полученного материала Cu/Fe 3 O 4 .
Подходящими условиями для синтеза каталитических материалов Cu/Fe 3 O 4 являются: 10 г зеленого чая на 200 мл дистиллированной воды; время экстракции: 40 мин; температура экстракции: 100 o C; 6 мл экстракта зеленого чая на 50 мл раствора CuSO 4 с концентрацией 4 ммоль/л; температура синтеза: 40 o C в течение 20 мин; масса носителя Fe 3 O 4 : 0,01 г.
Литература:
- Synthesis of silver decorated silica nanoparticles with rough surfaces as adsorbent and catalyst for methylene blue removal / M. Hu, X. Yan, X. Hu, R. Feng, M. Zhou. — Текст: непосредственный // Journal of Sol-Gel Science and Technology. — 2018. — V. 89. — № 3 — P. 754–763. DOI:10.1007/s10971–018–4871-z
- Ву Тхи Зуен. Синтез наноматериалов Cu/Fe 3 O 4 из экстракта листьев зеленого чая и их применение в качестве катализатора восстановления метиленового синего / Тхи Зуен Ву, Ван Так Динь. — Текст: непосредственный // Молодой ученый. — 2024. — № 5 (504). — С. 7–11. — URL: https://moluch.ru/archive/504/110884.
- Green synthesis of Cu/Fe 3 O 4 nanoparticles using green tea extract: Evaluation of its catalytic activity, antioxidant and anti-colon cancer effects / L. Xu, L. Zhang, D. Ren [и др.]. — Текст: непосредственный // Inorganic Chemistry Communications. — 2022. — V. 144 — P. 109927. DOI: 10.1016/j.inoche.2022.109927
- Nasrollahzadeh M. Green synthesis of the Cu/Fe 3 O 4 nanoparticles using Morinda morindoides leaf aqueous extract: A highly efficient magnetically separable catalyst for the reduction of organic dyes in aqueous medium at room temperature / M. Nasrollahzadeh, M. Atarod, S. M. Sajadi. — Текст: непосредственный // Applied Surface Science. — 2016. — V. 364(28). — P. 636–644. DOI: 10.1016/j.apsusc.2015.12.209
- Green Nanoarchitectonics of Cu/Fe 3 O 4 nanoparticles using helleborus niger extract towards an efficient nanocatalyst, antioxidant and anti-lung cancer agent / Y. Xue, B. Karmakar. — Текст: непосредственный // Journal of Inorganic and Organometallic Polymers and Materials. — 2022. — № 32(9). — P. 3585–3594. DOI: 10.1007/s10904–022–02430-w







