Казалось бы, головному мозгу человека мало что может угрожать. Он имеет полномасштабную защиту по всем правилам постройки крепостей. Его окружает словно ров с водой, прослойка специальной биологической жидкости, которая не только обеспечивает дополнительное питание, но и служит своеобразным биологическим амортизатором, создает такие условия, так изменяет его массу, словно мозг находится в состоянии невесомости. Покрыт он плотным слоем разнородных тканевых оболочек. И наконец, мозг надежно спрятан в костном практически монолитном остове — черепе, как в металлическом сейфе. Но, фактически, травмировать головной мозг очень просто, и даже самые малые травмы головы или некоторые состояния, воздействующие на весь организм, очень часто заканчиваются для человека серьезными проблемами с этим нежным органом.
Из всего сказанного выше следует, что черепно-мозговая травма является и долго еще останется одной из наиболее значимых проблем в современном здравоохранении и главное в вопросе о социальном обеспечении на всю оставшуюся жизнь пациентов перенесших и выживших после данной травмы.
Черепно-мозговая травма (ЧМТ) — механическое повреждение покровных тканей, апоневроза, надкостницы, костей черепа, а главное вещества головного мозга, сосудов и его оболочек. [1]
Существует множество теорий в какой-то мере объясняющих патогенез первичного повреждения головного мозга в момент механической травмы, а патогенез посттравматических реакций возникающих уже в травмированном мозге еще до конца не изучен. Но однозначно установлено, что очень важную роль во вторичном повреждении тканей черепной коробки играет свободно-радикальное перекисное окисление липидов и гипоксия, возникающая на фоне травмы. [1,2,3]
Целью данного исследования было изучение динамики показателей гипоксии (креатинкиназа (КК), лактатдегидрогеназа (ЛДГ) и лактат) в спинномозговой жидкости у больных выживших после тяжелой черепно-мозговой травмы на фоне применения препаратов цитикалин, мексидол в сравнении с базовой терапией черепно-мозговой травмы и соотношение изменения уровней данных показателей с данными полученными по критериям шкалы комы Глазго.
Для исследования были отобраны 3 группы пациентов по 10 человек в каждой перенесших тяжелую черепно-мозговую травму и не имевших алкогольного опьянения и тяжелой сопутствующей соматической патологии. Первая группа пациентов получала стандартную рекомендованную базовую терапию; вторая группа пациентов получала так же стандартную базовую терапию с добавлением препарата мексидол в дозировке 800 мг/сутки внутривенно капельно в течение 20 суток; третья группа пациентов совместно со стандартной базовой терапией получала препарат цитиколин в дозе 1000 мг/сутки внутривенно капельно в течение 20 суток.
Рекомендованными методами в руководствах по клинико-лабораторной диагностике проводилось исследование концентрации креатинкиназы, лактатдегидрогеназы и лактата в спинномозговой жидкости, которая забиралась на анализ первоначально при поступлении пострадавшего в стационар до начала терапии, затем каждые 5 дней на фоне применения терапии в течение 20 дней. Ежедневно больной осматривался врачом нейрохирургом и реаниматологом с обязательной оценкой по шкале комы Глазго. [1,3]
Исследованиями установлено, что уровень показателей гипоксии, определяемый у пациента в момент его поступления в стационар, зависит от множества факторов, таких как вид и механизм травмы, условия получения повреждения, условия внешней окружающей среды, от чувствительности головного мозга к травме; от наличия или отсутствия патологии головного мозга, ликвородинамического тракта, от патологии сердца и сосудистого бассейна головного мозга и периферических артерий, а главное от времени оказания медицинской помощи и времени поступления пострадавшего в стационар. Обо всем этом свидетельствует различный уровень повышения показателей гипоксии у пациентов, характеризующийся их увеличением на 70–200 % по различным показателям, что говорит о 1,5–2 и более кратном их увеличении относительно нормальных значений данных в руководствах по клинико-лабораторной диагностике.
В результате проведенных исследований установлено, что динамика снижения концентрации веществ указывающих на наличие гипоксии в головном мозге у первой группы пациентов получавших только стандартную рекомендованную терапию черепно-мозговой травмы по всем показателям на 20 сутки от момента получения травмы не превысила в среднем 12,5 % по сравнению с уровнем первого дня взятым за базовый. Снижение этих же показателей у пациентов второй группы получавших дополнительно мексидол составила в среднем на 32,3 %, а в группе пациентов получавших цитикалин уровень снижения концентрации составлял в среднем на 52,1 %.
Для определения клинического эффекта препаратов все изменения гипоксии в ликворе сопоставлялись с данными обследования по шкале комы Глазго.
Динамика уровня комы у больных первой группы, отражена на рис.1. Согласно полученным данным у некоторых больных (80 %) отмечается повышение уровня сознания на 1 балл, у 20 % пациентов повышение уровня сознания составило 2 балла.
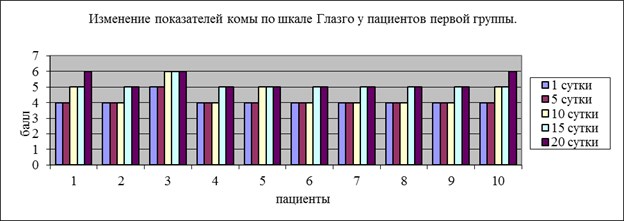
Рис. 1. Уровень комы по ШКГ у пациентов первой группы.
Динамика уровня комы у больных, которым к проводимой терапии добавляли мексидол, отражена на рис.2. Согласно полученным данным у всех больных отмечается значительное повышение уровня сознания (на 1–2-3 балла) на пятые, десятые, двадцатые сутки, что сопровождалось хорошей динамикой репарации раны мягких тканей головы.
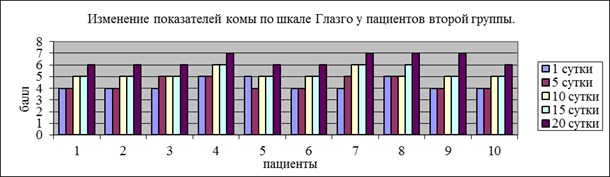
Рис. 2. Уровень комы по ШКГ у пациентов второй группы.
Динамика уровня комы у больных, которым к проводимой терапии в процессе лечения вводили препарат цитиколин, отражена на рис.3. Оценка уровня комы проводилась по шкале комы Глазго. Согласно полученным данным у всех больных отмечается значительное повышение уровня сознания (более чем на 4–5 баллов). У двух пациентов повышения уровня сознания составило 6 баллов относительно исходного уровня. На фоне приема препарата отмечалась хорошая репарация травмы мягких тканей.
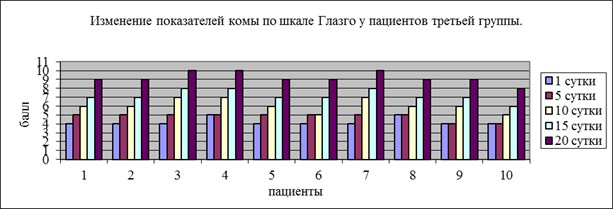
Рис. 3. Уровень комы по ШКГ у пациентов второй группы.
При анализе лабораторных данных установлено, что снижение уровней показателей гипоксии в первой группе пациентов связаны исключительно с действием собственной антиоксидантной системы, о чем свидетельствует низкий динамический уровень их снижения. Темпы снижения показателей гипоксии более выражены у пациентов второй группы по сравнению с первой, что связано с антиоксидантной и антигипоксической активностью препарата мексидол. Но еще наиболее выраженный эффект снижения уровня гипоксии наблюдается у пациентов третьей группы, что скорее всего связано не только с антиоксидантной и антигипоксической активностью препарата цитикалин, но и с иными положительными эффектами препарата.
В результате проведенного исследования было установлено, что на фоне применения антиоксидантов цитикалина и мексидола состояние показателей гипоксии имеют отчетливую тенденцию к снижению, что наиболее выражено у препарата цитикалин, и указывает на высокую скорость восстановительных процессов нейроцитов на фоне их применения. То что все эти эффекты наиболее выражены у препарата цитиколин скорее всего связано со способностью препарата цитикалин оказывать антиоксидантную и антигипоксическую активность, осуществлять нейропротекцию, но и активно встраиваться в структуру поврежденных мембран нейроцитов, предотвращая их окончательную гибель, что было показано в исследованиях ряда зарубежных авторов. [4,6,7,8,9] Так же была выявлена прямая зависимость между уровнем показателей гипоксии в ликворе и уровнем сознания определяемого по шкале комы Глазго, что выражается в уменьшении срока течения посттравматической комы индивидуально у каждого пациента во второй и третьей группах соответственно.
Литература:
1. Архангельский В. В. Патогенез и патологоанатомическая характеристика черепно-мозговой травмы //Медицина 2003г. с. — 17
2. Медицинские лабораторные технологии и диагностика: Справочник./ Под ред. Проф. А. И. Карпищенко — СПб.: Интермедика., т.1–1998г. — 408 с.
3. Новиков В. Е. Фармакология и биохимия гипоксии / Н. П. Катунина/ Обзоры по клинической фармакологии и лекарственной терапии.- 2002.- т.1.-с.73–87.
4. Bramanti V, Campisi A, Tomassoni D, Li Volti G, Caccamo D, Cannavo G, et al. Effect of acetylcholine precursors on proliferation and differentiation of astroglial cells in primary cultures. Neurochem Res 2008; 33: 2601–8
5. Bullock M. R. et al. // Surgical Management of Traumatic Brain Injury 2002// Brain Trauma Foundation, USA
6. Gutierrez M, Rodriguez B, Alvarez J, Exposito M, Vallejo M, Merino J, et al. Effects of citicoline and mesenchymal stem cells in acute cerebral infarct. Experimental study in rats. Cerebrovasc Dis 2010; 29 (Suppl 2): S1–341.
7. Hazama T, Hasegawa T, Ueda S, Sakuma A. Evaluation of the effect of CDP–choline on post–stroke hemiplegia employing a double–blind controlled trial. Int J Neurosci 1980; 11: 211–25.
8. Iranmanesh F, Vakilian A. Efficiency of citicoline in increasing muscular strength of patients with nontraumatic cerebral hemorrhage: a double–blind randomized clinical trial. J Stroke Cerebrovasc Dis 2008; 17: 153–5.
9. Ueda S, Hasegawa T, Ando K, Okawa T, Chino N, Ogata H, et al. Evaluation of the pharmacological effect of CDP–choline injection in post–stroke hemiplegia.Double–blind comparative study using the Hemiplegia Function Test (12–grade evaluation method). Strides of Medicine 1994; 170: 297–314.







