Для фотометрического определения скандия в литературе описано сравнительно много реагентов. Среди них сульфофенилазохромотроповая кислота, глиоксаль-бис-(2-оксианил), п-нитроазобензол хромотроповая кислота, кверцетин, 1-(2-гидрокси-5-нитрофенил)-3-изопропил-5-(2-бензоксазолил)формазан, люмогаллион, азопроизводные 8-оксихинолина другие реагенты [1–2-3]. Но чувствительность и избирательность определения для большинства реагентов не очень высоки. Установлено, что азореагенты на основе пирогаллола представляют несомненный интерес для определения многих элементов [4]. Поэтому целью настоящей работы было спектрофотометрическое определение скандия с 2,2/,3,4-тетраокси-3/-сульфо-5/-хлоразобензолом в присутствии и отсутствии третьего компонента-трифенилгуанидина.
Экспериментальная часть
Реагенты и растворы. Реагент синтезирован по методике [4], его состав и строение установлены методами элементного анализа и ИК-спектроскопии.
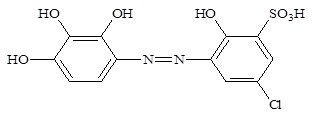
В работе использовали 1·10–3 Мэтанольный раствор 2,2/,3,4-тетраокси-3/-сульфо-5/-хлоразобензола и 1·10–2 М водно-этанольный раствор трифенилгуанидина. Исходный раствор скандия с концентрацией 1•10–1 готовили растворением рассчитанной навески металлического скандия в НСl по методике [5]. Более разбавленные растворы скандия готовили разбавлением исходного раствора. Раствор реагента (R) хорошо растворим в воде, а ТФГ в водно-этанольной смеси (1:1). Для создания необходимых значений рН использовали фиксанал НСl (рН 1–2) и аммиачно-ацетатные буферные растворы (3–11).
Результаты и их обсуждение
Изучение зависимости комплексобразования от рН показало, что выход комплекса максимален при рН 3 (λмах=405 нм), реагент имеет максимум светопоглощения при λмах=360 нм. Основные спектрофотометрические характеристики разработанной методики фотометрического определения скандия приведены в таблице 1.
Таблица 1
Основные фотометрические характеристики реакций скандия(III) с органическими реактивами
|
Реагент |
λ,нм |
Sc:R |
pH |
emax |
Интервал подчинения закону Бера, мкг/мл |
|
ХлорфосфоназоIII [6] |
640 |
1:2 |
2–4 |
14700 |
0,21–1,8 |
|
Sc(III)-R |
457 |
1:2 |
3 |
16500 |
0,1–3,24 |
|
Sc(III)-R-ТФГ |
450 |
1:2:1 |
1 |
17500 |
0,05–2,52 |
Методами Старика-Барбанеля, изомолярных серий и сдвига равновесия установлено, что состав образующихся окращенных соединений равны 1:2 (ScR), 1:2:1 (ScR-ТФГ) [7]. Методом Астахова определены числа протонов, выделяющихся в результате комплексобразования и подтверждены указанные соотношения компонентов в комплексах [8].Установлено что, в присутствии ТФГ наблюдается повышение чувствительности реакции. Полученные комплексы исследованы также методом кондуктометрического титрования [9]. Сравнение удельной электропроводности однородно и смешанолигандного комплексов скандия при рН 1 и рН 3 показывает, что Sc-R-ТФГ устойчивее, чем Sc-R. Изучение влияния посторонних ионов и маскирующих веществ на фотометрическое определение скандия (III) в виде бинарного и разнолигандного комплексов показало, что в присутствии ТФГ значительно увеличивается избирательность реакции. Установлено, что разработанная методика определения скандия(III) с 2,2/,3,4-тетраокси-3/-сульфо-5/-хлоразобензола 2,2/,3,4-тетраокси-3/-сульфо-5/-хлоразобензолом в присутствии ТФГ обладает высокой избирательностью. Вычислены константы устойчивости бинарного и смешанолигандного комплекса скандия(III).
Методика фотометрического определения скандия(III) в пирексените
Для анализа взяли образец горной породы-пирексенита. Содержание скандия(III) в образцах определяли фотометрическим методом. 5 г образца в чашке из стеклоуглерода растворяют в смеси 20 мл HF+15 мл HCl+5 мл HNO3. Полученную пасту обрабатывают 4–5 мл HNO3 при 60–70° С до полной отгонки HF. Полученный осадок растворяют в воде, фильтруют в колбе емкотью 50 мл и разбавляют водой до метки. При определении скандия(III) фотометрическим методом аликвотную часть полученного раствора помещают в колбу емкостью 25 мл, добавляют 2 мл 1·10–3 М раствора R, 1 мл1·10–3 М раствора ТФГ и разбавляют до метки раствором pH 1. Оптическую плотность растворов измеряют при 440 нм в кювете толщиной 1 см на КФК-2 относительно раствора контрольного опыта. Методом добавок установлено точность определения.
Таблица 2
Результаты определения скандия (III) в образцах вулканогенной породы
|
Образец |
Содержание по паспорту, Sc2O3, % |
Найдено, |
Sr |
|
I |
0,01 |
0,0065±0,002 |
0,009 |
Литература:
1. Марченко З.Фотометрическое определение элементов.М.:Мир.1971.501с.
2. Маслакова Т. И., Первова И. Г., Липунова Г. Н. Журнал Заводская лаборатория № 3. 2002 год.с. 10
3. Дегтев М. И., Мельников П. В. Журнал Заводская лаборатория № 5.1998 год.с.12
4. Гамбаров Д. Г. Дис.док.хим.наук. М.:,МГУ,1984, с.38
5. Лазарев А. И. Харламов И. П. Яковлев П. Я. Яковлева Е. Ф. Справочник химика-аналитика.М.: Металлургия, 1976. с.184
6. Бусев А. И. Практическое руководство по аналитической химии редких элементов. М.:Химия.1966.412с.
7. Булатов М. М. Калинкин Н. П. Практическое руководство по фотометрическим методам анализа.Л.: Химия,1986.с.432
8. Астахов К. В., Верникин В. Б., Зимин В. И., Зверькова А. Д. Журнал неорганической химии.1961, Т6, с2069
9. Худякова Т. А., Крешков А. П. Теория и практика кондуктометрического и хронокондуктометрического анализа. М.: Химия, 1976, 304 с.







