В статье рассматривается один из видов пассивной дозиметрии, принцип его действия, преимущества и недостатки.
Ключевые слова: пассивный дозиметр, ЭПР-дозиметр, магнитное поле, ретроспективная дозиметрия.
Пассивные дозиметры играют важную роль в обеспечении радиационного контроля. Ионизирующее излучение широко используется в атомной промышленности, медицинской диагностике, лечении. Мониторинг радиационного облучения необходим для предотвращения вредных последствий для здоровья, особенно для работников, которые находятся в радиационно-опасных условиях, и пациентов, проходящих диагностические или терапевтические процедуры. Несмотря на достижения в области технологий обнаружения радиации в режиме реального времени, пассивные дозиметры продолжают широко использоваться для долгосрочного мониторинга облучения благодаря их экономичности, портативности и простоте использования [1].
Когда твёрдые материалы подвергаются воздействию ионизирующего излучения, образуются электроны и дырки, которые могут быть захвачены дефектами или примесями, потенциально изменяя магнитные свойства материала. Эти дефекты могут переходить из диамагнитного состояния в парамагнитное, делая определённые компоненты спектра ЭПР чувствительными к излучению и, таким образом, пригодными для дозиметрии (см. рис.1а). В практической ЭПР-дозиметрии излучение индуцирует стабильные парамагнитные радикалы в твёрдых телах. Количество этих радикалов коррелирует с поглощённой дозой, а интенсивность сигнала ЭПР, которую можно измерить, даёт информацию о дозе [5]. Необходима калибровка, включающая воздействие известных доз для установления эталона.
В ЭПР-дозиметрии обычно используется ЭПР-спектроскопия с непрерывной волной (НВ). Этот метод измеряет поглощение микроволн при прохождении магнитного поля. Для минимизации низкочастотного шума применяется высокочастотная модуляция, и обычно анализируется спектр первой производной (см. рис.1б). Это требует тщательного интегрирования для расчёта общей интенсивности (см. рис. 1в). Однако обширные фоновые сигналы могут создавать помехи, что делает измерение амплитуды от пика к пику (см. рис.1г) практической альтернативой, хотя при этом предполагается, что форма спектра остаётся неизменной. Высокие дозы облучения могут изменять форму или расширять линии ЭПР из-за взаимодействия между парамагнитными центрами.
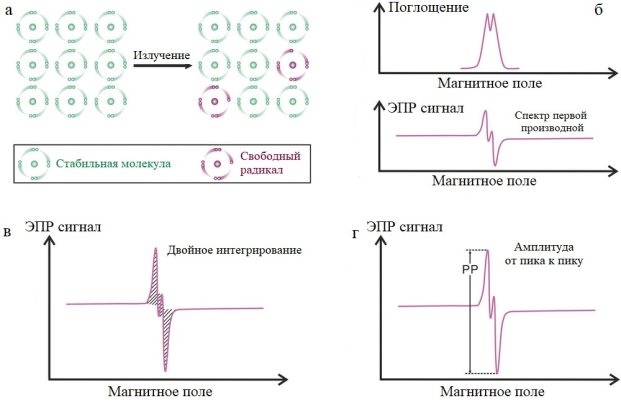
Рисунок 1. Принципы ЭПР-дозиметрии. а) Принципиальная схема образования свободных радикалов при облучении. б) Спектры поглощения и его первые производные спектры ЭПР-дозиметра после облучения. в) Оценка поглощенных доз на основе метода «двойного интегрирования». г) Оценка поглощенных доз на основе метода «амплитуда от пика к пику»
Для точной дозиметрии форма и интенсивность линии зависят от таких факторов, как мощность микроволнового излучения и амплитуда модуляции. При низкой мощности интенсивность ЭПР линейно возрастает, но при более высоких мощностях происходит насыщение из-за времени спиновой релаксации. Узкие линии, хотя и являются идеальными с точки зрения чувствительности, могут быстро насыщаться и снижать качество сигнала. Оптимальные параметры детектирования имеют решающее значение для точной оценки дозы, а анизотропия и неоднородность могут вызвать уширение, особенно в поликристаллических или стеклянных дозиметрах [3].
ЭПР-дозиметры обычно обладают более низкой чувствительностью, чем оптические или электрические дозиметры, из-за малого разделения энергий в спиновых состояниях электронов, которые менее чувствительны к условиям комнатной температуры. Однако более высокие микроволновые частоты или магнитные поля могут повысить чувствительность, хотя и за счет расширения спектра и усложнения работы с образцами. Наиболее широко используемые системы ЭПР работают в X-диапазоне (около 9,5 ГГц), обеспечивая баланс чувствительности и практичности.
Преимуществом ЭПР-дозиметрии является ее неинвазивный характер, поскольку измерение не изменяет информацию о дозе. Однако стабильность радиационно-индуцированных парамагнитных дефектов с течением времени имеет решающее значение. ЭПР-дозиметры часто не используются повторно, так как стереть данные дозиметра, сохранив при этом его чувствительность, довольно сложно.
ЭПР-дозиметрия началась в середине 20-го века с ранних исследований, выявляющих радиационно-индуцированные ЭПР-сигналы в облучённых костях черепа и изучающих потенциал использования таких материалов, как аланин, для дозиметрии. По мере развития метода его применение расширилось до биодозиметрии, ретроспективной дозиметрии, идентификации облученных пищевых продуктов и археологического датирования. Он часто дополняет другие методы, такие как термолюминесцентная и гелевая дозиметрия [4].
Дозиметры ЭПР должны соответствовать определенным требованиям, таким как узкополосность спектра, минимальный фоновый шум, высокая стабильность и короткое время простоя. Для биодозиметрии материалы должны быть эквивалентны тканям, а образующиеся радикалы должны точно соответствовать поглощённому излучению, не подвергаясь воздействию физических или биологических факторов, таких как травмы или инфекции.
Для дозиметрии ЭПР были разработаны две основные категории материалов. Одна группа состоит из материалов, рассчитанных на ожидаемые дозы облучения, часто в виде порошка или гранул, с калибровочными кривыми для преобразования интенсивности сигнала ЭПР в дозу. Эти системы недостаточно чувствительны к низким дозам, поскольку надежные измерения обычно начинаются примерно с 0,1 Гр. Распространённые материалы включают аланин, тартрат аммония и формиат лития, при этом аланин является основным стандартом в дозиметрии высоких доз и переносной дозиметрии [2].
Ко второй категории относятся повседневные материалы, такие как пластик, стекло, и биологические вещества, такие как зубы, кости и волосы, которые могут быть использованы для персональной дозиметрии в аварийных ситуациях. Хотя эти материалы могут быть менее однородными, они полезны для калибровки дозы от образца к образцу и даже для датировки окаменелостей.
Наконец, химический состав ЭПР-дозиметрических материалов сложен, и образование радикалов часто включает в себя несколько медленных стадий реакции. После облучения интенсивность и форма ЭПР-сигнала некоторых материалов значительно меняются, что означает, что между облучением и измерением часто требуется период ожидания.
Материалы для ЭПР-дозиметрической системы
L-аланин : L-аланин широко используется в дозиметрии благодаря стабильному ЭПР-сигналу, тканевой эквивалентности ( Z eff = 6,78) и линейному дозозависимому эффекту. Спектр ЭПР, в котором преобладает стабильный аланиновый радикал, охватывает дозы от нескольких Гр до 100 кГр и остаётся стабильным в течение длительного времени, что идеально подходит для измерения высоких доз.
2-метилаланин : Эта аминокислота образует радикал, аналогичный L-аланину, но с более высокой чувствительностью и линейным диапазоном доз от 0,5 до 100 Гр. Его ЭПР-сигнал стабилен, с небольшим первоначальным снижением, что делает его отличным кандидатом для измерений низких доз.
Тартрат аммония : Это соединение дает однострочный спектр ЭПР с линейной дозовой реакцией (от 0,5 до 4000 Гр) и практически эквивалентно тканям ( Z eff = 7,13). Несмотря на то, что сигнал ЭПР стабилен, после облучения требуется период ожидания не менее шести часов из-за медленных радикальных изменений.
Твёрдые сахара: Сахара, такие как сахароза, обладают стабильным ЭПР-сигналом и широким диапазоном доз (от 0,05 до 100 кГр). Хотя сахароза обладает высокой чувствительностью и полезна для облучения пищевых продуктов и экстренной дозиметрии, она немного гигроскопична, что со временем приводит к затуханию сигнала.
Формиаты: Формиат лития является высокочувствительным дозиметром с линейным диапазоном доз от 0,2 до 1000 Гр и стабильным сигналом в течение как минимум семи дней после облучения. Он более точен, чем L-аланин, в клинической лучевой терапии.
Самокалибрующиеся дозиметры: В этих дозиметрах используются чувствительные к излучению материалы, такие как L-аланин или сахароза, со стабильным внутренним стандартом (например, MgO, легированный Mn 2+ ). Соотношение двух сигналов устраняет необходимость в калибровке, обеспечивая более высокую точность и стабильность, хотя и с несколько меньшей чувствительностью по сравнению с системами без самокалибровки.
ЭПР-дозиметрия с использованием аланина обеспечивает точное измерение дозы для уровней до нескольких сотен кГр. Он также применим для оценки дозы лучевой терапии (в диапазоне от Гр до десятков Гр), хотя новые системы, такие как дозиметры на основе формиата лития, в будущем могут обеспечить несколько лучшую чувствительность. К основным преимуществам ЭПР-дозиметрии относятся низкая стоимость, быстрая оценка дозы и возможность неразрушающего измерения, что позволяет проводить повторные считывания и длительное хранение в архивных целях. При правильном хранении радиационно-индуцированные радикалы остаются заметными в течение длительного времени, от месяцев до десятилетий, с минимальным выцветанием некоторых материалов. ЭПР-дозиметрия также имеет неоценимое значение в ретроспективной дозиметрии при авариях, наряду с такими методами, как термолюминесценция (ТЛ) и оптически стимулированная люминесценция (ОСЛ), что даёт ей преимущество в определенных областях применения.
Однако ЭПР-дозиметрия имеет существенные ограничения. Её чувствительность относительно низкая, что делает её непригодной для применений, требующих определения очень низких доз (менее 0,1 Гр). Кроме того, такие факторы окружающей среды, как освещённость, температура и влажность, могут влиять на стабильность радиационно-индуцированных радикалов и качество образцов, что требует осторожного обращения для получения точных результатов. Ещё одним недостатком является высокая стоимость приборов ЭПР, особенно с ограниченными возможностями, такими как ограниченный диапазон действия магнитного поля. ЭПР-спектрометры редко используются в обычных физико-химических лабораториях, и эффективное использование этого метода требует специальных знаний как в области дозиметрии излучения, так и в области анализа ЭПР-сигналов.
Литература:
1. Баранова А. А., Оконечников А. П., Пустоваров В. А. Дозиметрия: учебно-методическое пособие. Екатеринбург: Издательство Уральского университета, 2020.
2. Иванов В. И. Курс дозиметрии: учебник для вузов. 3-е изд., перераб. и доп. М.: Атомиздат, 1987
3. Сивухин Д. В. Общий курс физики. В 5-ти томах. Том 5. Атомная и ядерная физика. М.: Физматлит, 2024.
4. Джонхун О, Чанг Ук Ку, Чон Ин Пак, Квон Чой, Джунен Ли, Хироси Хирата, Сон Чжун Е. Повышение точности ЭПР-дозиметрии зубов в L-диапазоне за счет реализации детектирования множественных гармоник. Измерения радиации, 107185, 2024
5. Себастьян Хефель, Михаэль Штеле, Феликс Цвикер, Михаэль К. Фикс, Малте Дрешер Практичная система ЭПР-дозиметрии для рутинного использования в лучевой терапии: анализ погрешностей дозиметров на основе формиата лития на уровне терапевтической дозы. Физика в медицине и биологии 66 (4), 045005, 2021







