1. Действие флавоноидов на фазовое состояние мембран.
Для флавоноидов, также как для многих других биологически-активных веществ, гидрофобность и, соответственно, способность взаимодействовать с биологическими мембранами является одним из необходимых условий проявления фармакологической активности [1].
Однако молекулы флавоноидов, которые являются полифенолами, располагают значительным числом гидроксильных групп, определяющих полярность молекулы, и ответственных за проявление слабых кислотных свойств. Обратная корреляция между числом гидроксильных групп и гидрофобностью флавоноидов была показана экспериментально в работе [2].
Кроме того, в исследованиях методом дифференциальной сканирующей калориметрией (ДСК) были обнаружены существенные различия в способности флавоноидов влиять на процессы плавления липидов (Рис. 1).
Так, действие гликозидов флавоноидов, например рутина, на процессы плавления липидов практически не наблюдалось. Это связано с тем, что гликозиды лучше растворимы в воде, чем соответствующие агликоны, и поэтому способны взаимодействовать только с поверхностью липидного бислоя, тогда как их влияние на плавление гидрофобной области незначительно [3, 4].
Такое же незначительное влияние на плавление липидов оказывают катехин и мирицетин (Рис. 1 С и D) – флавоноиды, известные как сравнительно гидрофильные соединения, слабо взаимодействующие с фосфолипидным бислоем [5].
Влияние таксифолина и кверцетина на плавление липидов было существенно большим. Увеличивалась ширина перехода, в то время как максимум перехода снижался на несколько градусов. Исследования, проведенные с использованием флуоресцентных красителей, показывают, что влияние кверцетина на плавление липида можно охарактеризовать как увеличение вязкости мембраны [3, 6].
Предполагается, что кверцетин локализуется на границе между полярной и неполярной областями бислоя. Действие кверцетина на жидкостные свойства мембраны сопоставимы с действием холестерина и предполагается возможность проникновения молекул кверцетина в гидрофобную область бислоя и взаимодействие с углеводородными цепями липида [2].
В соответствии с приведенными термограммами (Рис. 1), можно заключить, что действие таксифолина на плавление липидов было меньшим по сравнению с кверцетином. Объяснение обнаруженных различий можно найти при сравнении формы молекул. Предполагается, что плоская молекула кверцетина должна преодолевать меньшие стерические препятствия при проникновении между плотно упакованными углеводородными цепями липида по сравнению с изогнутой молекулой таксифолина.
2. Локализация флавоноидов в бислое
Сведения о локализации флавоноидов в бислое весьма противоречивы. По мнению некоторых исследователей они способны проникать глубоко в бислой, однако наличие большого числа гидроксильных групп позволяет молекулам полифенолов образовывать водородные связи с липидами, что способствует их взаимодействию с более полярными областями [7].
В действительности, многое зависит от рН среды, что определяет величину зарядов флавоноидов и липида. Чем ниже величина рН, тем меньше степень депротонирования флавоноидов и тем глубже они способны проникать в бислой [8].
Катехины, имеющие группы галлата (ECG, EGCG) адсорбируются бислоем в большей степени, чем катехины, не имеющие галлатов (EC, EGC). Различные методы исследования взаимодействия катехинов с липосомами показывают следующий ряд изменения сродства этих веществ к бислою липидов: ECG>EGCG>EC>EGC [ 9-12].
Указанный ряд коррелирует с липофильностью этих веществ, величина которой определяется как коэффициент распределения (LogP) в системе октанол:вода [10].
Многие исследования взаимодействия флавоноидов с мембранами проведены с использованием катехинов. После адсорбции бислоем все катехины проникают в область, находящуюся глубже фосфатных групп, и распределяются в плоскости бислоя благодаря латеральной диффузии. Молекулярное моделирование показывает [13], что в результате проникновения в мембрану на каждую молекулу EGCG происходит возрастание площади бислоя на 0,374 нм2. При этом с каждой молекулой EGCG взаимодействует в среднем 10,8 молекул липида. Липиды, примыкающие к молекуле EGCG, плотно упакованы и занимают площадь 0,51 нм2, что на 0,14 нм2 меньше, чем остальные молекулы. Все молекулы катехинов склонны к неравномерному распределению в плоскости бислоя и образованию агрегатов. Агрегация катехинов наблюдается как в молекулярных моделях липидного бислоя [14 ], так и в экспериментах с искусственными мембранами [9].
Появление агрегатов флавоноидов в бислое может приводить к возникновению дефектов бислойной структуры, нарушению целостности и росту проницаемости везикул .
Находясь в бислое, гидроксильные группы катехинов образуют водородные связи с атомами кислорода в молекулах липида. Чем больше гидроксильных групп, тем прочнее взаимодействие. Образование водородных связей между катехольными гидроксильными группами флавоноидов и атомами кислорода пероксидов липидов определяет антиоксидантные свойства катехинов.
ЯМР исследования показали также, что молекулы катехинов способны вращаться в бислое вокруг оси, наклоненной к плоскости бислоя под углом, приблизительно 55° [ 5], при этом расстояние от ближайшей фосфатной группы липида до карбонильного углерода катехина составляет 5,3±0,1 Å (Рис. 2).
Недавно проведенные исследования влияния флавоноидов на вязкостные свойства мембран клеток нескольких типов лейкоцитов, измеряемые с использованием мембранотропных флуоресцентных красителей, показали способность кверцетина и EGCG увеличивать анизотропию бислоя и рост трансмембранного потенциала, что предположительно, может быть существенно в проявлении антиоксидантных и регуляторных свойств этих флавоноидов.
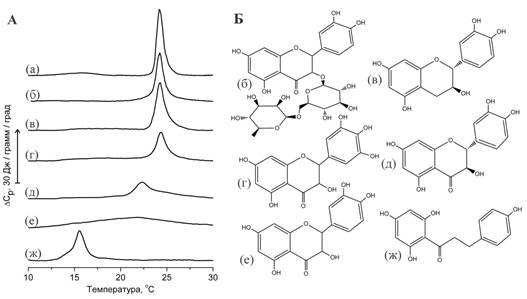
Рис.2. А - Данные ДСК мультиламеллярных липосом из димиристоилфосфатидилхолина (DMPC), содержащих флавоноиды (флавоноид/липид = 1:1 моль/моль): (а) – контроль DMPC, (б) – липосомы с рутином, (в) – катехином, (г) – мирицетином, (д) – таксифолином, (е) – кверцетином, (ж) – флоретином. Б – формулы перечисленных флавоноидов.
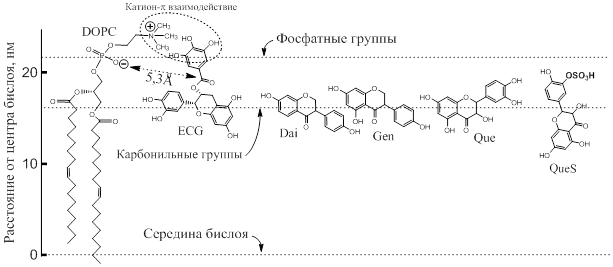
Рис.3. Расположение различных флавоноидов в фосфолипидном бислое. Для простоты показан монослой DOPC. Положение фосфатных и карбонильных групп показано горизонтальными пунктирными линиями. Показано также предпочтительное расположение в монослое эпикатехингаллата (ECg), даидзеина (Dai) и генистеина (Gen), а также кверцетина (Gue) и протонированной формы сульфата кверцетина (QueS).
Данные получены на основе рентгеновского рассеяния, ЯМР спектроскопии и молекулярного моделирования.
Литература:
1. Hendrich, A. B. Flavonoid-membrane interactions: possible consequences for biological effects of some polyphenolic compounds. // Acta Pharm.Sinica.- 2006. - V. 27. -N. 1. -P. 27-40.
2. Van Dijk, C., A. J. Driessen, and K. Recourt. The uncoupling efficiency and affinity of flavonoids for vesicles. // Biochem.Pharmacol. – 2000. - V. 60. - N. 11. - P. 1593-1600.
3. Hashimoto, T., S. Kumazawa, F. Nanjo, Y. Hara, and T. Nakayama. Interaction of tea catechins with lipid bilayers investigated with liposome systems. // Biosci.Biotechnol.Biochem. – 1999. -V. 63. - N. 12.- P. 2252-2255.
4. Arora, A., T. M. Byrem, M. G. Nair, and G. M. Strasburg. Modulation of liposomal membrane fluidity by flavonoids and isoflavonoids. // Arch.Biochem.Biophys.- 2000. - V. 373. - N. 1. - P. 102-109.
5. Scheidt, H. A., A. Pampel, L. Nissler, R. Gebhardt, and D. Huster. Investigation of the membrane localization and distribution of flavonoids by high-resolution magic angle spinning NMR spectroscopy. // Biochim.Biophys.Acta. – 2004. - V. 1663. - N. 1-2. - P. 97-107.
6. Tsuchiya, H., M. Nagayama, T. Tanaka, M. Furusawa, M. Kashimata, and H. Takeuchi. Membrane-rigidifying effects of anti-cancer dietary factors. // Biofactors. – 2002. - V. 16. - N. 3-4. - P. 45-56.
7. Pawlikowska-Pawlega, B., L. E. Misiak, B. Zarzyka, R. Paduch, A. Gawron, and W. I. Gruszecki. FTIR, 1H NMR and EPR spectroscopy studies on the interaction of flavone apigenin with dipalmitoylphosphatidylcholine liposomes. // Biochim.Biophys.Acta. - 2012. - V. 1828. - N. 2. - P. 518-527.
8. Movileanu, L., I. Neagoe, and M. L. Flonta. Interaction of the antioxidant flavonoid quercetin with planar lipid bilayers. // Int.J.Pharm.- 2000. - V. 205. N. 1-2. - P. 135-146.
9. Kajiya, K., S. Kumazawa, and T. Nakayama. Effects of external factors on the interaction of tea catechins with lipid bilayers. // Biosci.Biotechnol.Biochem. – 2002. - V. 66. - N. 11. - P. 2330-2335.
10. Kajiya, K., S. Kumazawa, and T. Nakayama. Steric effects on interaction of tea catechins with lipid bilayers. // Biosci.Biotechnol.Biochem. – 2001. - V. 65. - N. 12. - P. 2638-2643.
11. Kamihira, M., H. Nakazawa, A. Kira, Y. Mizutani, M. Nakamura, and T. Nakayama. Interaction of tea catechins with lipid bilayers investigated by a quartz-crystal microbalance analysis. // Biosci.Biotechnol.Biochem. – 2008. - V. 72. - N. 5. - P. 1372-1375.
12. Uekusa, Y., Y. Takeshita, T. Ishii, and T. Nakayama., Partition coefficients of polyphenols for phosphatidylcholine investigated by HPLC with an immobilized artificial membrane column. // Biosci.Biotechnol.Biochem.- 2008. - V. 72. - N. 12. - P. 3289-3292.
13. Sirk, T. W., E. F. Brown, M. Friedman, and A. K. Sum. Molecular binding of catechins to biomembranes: relationship to biological activity. // J.Agric.Food Chem. - 2009. - V. 57. - N. 15. - P. 6720-6728.
14. Sirk, T. W., M. Friedman, and E. F. Brown., Molecular binding of black tea theaflavins to biological membranes: relationship to bioactivities. // J.Agric.Food Chem. – 2011. - V. 59. - N. 8. - P. 3780-3787.







