Изучена сорбционная способность глауконита Бондарского месторождения Тамбовской области по отношению к катионам Ca2+, Mg2+, Fe2+ и Fe3+ и анионам Cl-, SO42-, которая позволяет рекомендовать глауконит как безопасный сорбент для доочистки питьевой воды. Для катионов Fe2+ изучена кинетика адсорбции в стационарном режиме. Показано, что сорбция их глауконитом составляет 70–74 % за 30–40 мин.
Ключевые слова: Глауконит, сорбционная способность, ионы, кальций, магний, железо (II и III), хлорид- и сульфат-анионы, водоподготовка.
В настоящее время остро стоит вопрос о качестве водопроводной воды во всех регионах РФ. Необходимо изменение и модернизация процессов в схемах водоподготовки. В связи с этим нами изучена перспектива использования неорганического материала — глауконита — для целей водоочистки. Глауконит — природный алюмосиликат с общей формулой (К, H2O)(Fe3+, Al, Fe2+, Mg) 2 [Si3AlO10](OH)2×nH2O, широко встречающийся на региональных месторождениях, обладающий высокой сорбционной активностью, большой емкостью, селективностью, термической и радиационной устойчивостью, наряду с низкой стоимостью. Следует отметить, что ранее в работах [1–6] подробно изучена адсорбционная способность глауконитов по отношению к фенолу, анилину, тяжелым металлам, пестицидам, ПАВ, радионуклидам, хлорорганическим соединениям. Показано, что этот минерал эффективно использовать для очистки сточных вод и в процессах дезактивации воды. Однако, свойства глауконитов, близких по строению, химическому составу, одного геологического возраста на разных месторождениях неодинаковы, поэтому не всегда пригодны для очистки воды [7]. Следует отметить, что работ по применению глауконитов в процессах очистки, точнее доочистки, водопроводной воды, не проводилось. Поэтому, нами были исследованы образцы глауконита Бондарского месторождения Тамбовской области для локальной очистки питьевой водопроводной воды. Проведенные нами исследования структурно-морфологических особенностей, физико-химических, ионнообменных характеристик глауконита данного месторождения показывают возможность применения его в схемах водоподготовки. Основные физико-химические показатели глауконита Бондарского месторождения приведены в табл.1.
Таблица 1
Основные физико-химические показатели глауконита
|
Удельная поверхность по БЭТ, м2/г |
Объем пор, см3/г |
Истинная плотность, г/см3 |
Пористость, % |
Диаметр пор, Å |
||
|
Микро |
Мезо |
Суммарный |
||||
|
20,56 |
0,0027 |
0,026 |
0,033 |
2,6712 |
8,1 |
65,11 |
В работе приведены результаты исследования сорбции глауконитом катионов Ca2+, Mg2+, Fe2+ и Fe3+ и анионов Cl-, SO42-. Установлено влияние сорбента на жесткость воды. Также, изучена кинетика адсорбции ионов Fe2+ на глауконите в стационарном режиме.
Для проведения исследований, водопроводную воду из центрального водоснабжения под давлением пропускали через ионообменник, заполненный глауконитом. Предварительно в водопроводной воде было определено содержание исследуемых ионов. Концентрацию общего железа оценивали фотометрическим методом с сульфосалициловой кислотой, катионов кальция и магния — прямым комплексометрическим титрованием трилоном Б с индикатором эриохромом черным Т, сульфат-анионов — турбидиметрическим методом, хлорид-ионов — титрованием азотнокислым серебром в присутствии хромовокислого калия в качестве индикатора. Все реактивы использовали квалификации ч. д.а. После ионообменника воду фильтровали и анализировали на содержание в ней катионов Ca2+, Mg2+, Fe2+ и Fe3+ианионов Cl-, SO42-.
Результаты снижения концентрации исследуемых катионов и анионов в процессе сорбции представлены в таблице 2.
Таблица 2
Результаты сорбции ионов глауконитом по данным химического анализа
|
Исследуемые ионы |
Массовая доля поглощенного адсорбата, % |
|
Fe2+ и Fe3+ |
33 |
|
Ca2+ |
82,7 |
|
Mg2+ |
77,6 |
|
Cl- |
73,5 |
|
SO42- |
71,43 |
Согласно полученным данным, глауконит Бондарского месторождения эффективно сорбирует ионы Ca2+, Mg2+,Cl-, SO42-, в меньшей степени катионы железа. А также, снижение жесткости, за счет сорбционной способности минерала, составило 79 %. Однако, как показал анализ имеющихся литературных данных, полученные результаты не следует распространять на другие ионы. Так, по Zn2+ сорбционная способность минерала практически равна нулю [1]. Вероятно, хорошее водоумягчающее действие Бондарского глауконита основывается на его способности поглощать из воды ионы кальция и магния, выделяя взамен, содержащиеся в нем ионы натрия. По мнению [6] этот процесс обратим: поглощенные ионы Ca2+и Mg2+легко переходят в раствор хлористого натрия, а их место занимает обменный натрий. Невысокую сорбируемость ионов двух- и трехвалентного железа (см. табл.2), можно объяснить наличием на боковых гранях этого слоистого силиката координационно ненасыщенных ионов Fe3+ и вероятно, возможностью катионов железа покидать кристаллическую структуру ионита. Поскольку изучение кинетики адсорбции только ионов Fe2+ показало, что поглощение этих катионов Бондарским глауконитом составляет 70–74 % и достигается за 30–40 минут. Исследование адсорбции ионов Fe2+ проводилось методом измерения кинетических кривых в стационарных условиях. Для этого навеску адсорбента массой 2 г выдерживали в дистиллированной воде (250 мл) 24 часа. После декантирования адсорбент во влажном состоянии заливали свежеприготовленным раствором FeSO4·7H2O с содержанием катионов Fe2+ 21±1 мг/л (в соотношении 2г сорбента и 100 мл раствора). Сорбцию катионов проводили в течение 40 минут (t) при непрерывном перемешивании магнитной мешалкой. Через определенные временные интервалы отбирались пробы и проводился их анализ рентгенофлюоресцентным способом по методу калибровочной кривой. На основании полученных данных проводился расчет равновесной концентрации ионов Fe2+(Ср) и их адсорбции (Г).
В таблице 3 и на рис.1 представлены результаты сорбции ионов Fe2+ глауконитом Бондарского месторождения.
Таблица 3
Результаты адсорбции глауконитом ионов Fe2+ во времени
|
t, мин |
Cр, мг/л |
Г·109, мг/см2 |
|
0 |
0 |
0 |
|
5 |
14,175 |
3,32 |
|
15 |
12,6 |
4,08 |
|
30 |
5,67 |
7,46 |
|
40 |
5,46 |
7,56 |
|
60 |
5,56 |
7,51 |
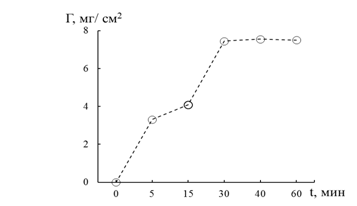
Рис. 1. Зависимость адсорбции ионов Fe2+ Бондарским глауконитом от времени. Использованы средние арифметические значения из трех измерений
Полученные экспериментальные данные свидетельствуют о том, что сорбционное равновесие достигается за 30–40 мин. Концентрация сорбированных катионов Fe2+ глауконитом в условиях равновесия составляет 15,54 мг/л или порядка 74 масс. % исходной величины.
Анализируя экспериментальные данные, можно сделать следующие выводы:
1) глауконит Бондарского района Тамбовской области обладает высокой сорбционной способностью по отношению к ионам Ca2+, Mg2+,Cl-, SO42-, что обуславливает возможность его использования, как природного умягчителя воды, в процессах водоподготовки;
2) адсорбция ионов Fe2+ глауконитом составляет 70–74 %, в то время как сорбируемость совместно ионов Fe2+ и Fe3+ из водопроводной воды — всего 33 %, что вероятно, связано, при определенных условиях, с выходом ионов трехвалентного железа из кристаллической решетки ионита.
В настоящее время, глауконит, в связи с уникальными сорбционными свойствами по отношению к ионам, обуславливающих жесткость водопроводной воды, используется в качестве ионита в ионообменниках на экспериментальной установке по водоподготовке на базе НПО «ИОНИТ». Как показал анализ образцов воды централизованной системы питьевого водоснабжения, прошедшей через такую экспериментальную установку, ее свойства после водоподготовки значительно улучшаются; по физическим, химическим и санитарно-бактериологическим показателям, утвержденным СанПином 2.1.4.1074–01 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества», испытательные образцы относятся к питьевой воде первой категории качества.
Литература:
1. Вигдорович В. И., Цыганкова Д. В., Николенко Д. В. и др. Адсорбционная способность глауконита Бондарского района Тамбовской области. // Сорбционные и хроматографические процессы. — Воронеж: Воронежский государственный университет. 2010. Т.10. Вып.1. С. 121–126.
2. Крупнова Т. Г., Зиганшина К. Р., Антонова Е. Л. Применение глауконита для очистки воды от радиоактивных загрязнений, ионов иттрия и редкоземельных элементов. // Успехи современного естествознания. Материалы конференций. — М.: Академия естествознания. 2004. № 10. С. 78–79.
3. Сухарев Ю. И., Кувыкина Е. А. Структурно-морфологические особенности глауконита Багрянского месторождения. // Известия Челябинского научного центра УРО РАН, раздел «Химия и химическая технология». 2000. № 3. С. 77–81.
4. Кацнельсон Ю. Я., Алексоньян О. М. Глауконитсодержащие микроконрекции как поглотители радионуклидов. // Минералогия и геохимия глауконита. — Новосибирск. 1981. С. 80–81.
5. Сухарев Ю. И., Черногорова А. Е., Кувыкина Е. А. Особенности структуры и сорбционно-обменные свойства глауконита Багрянского месторождения. // Известия Челябинского научного центра УРО РАН. 1999. № 3. С. 64–69.
6. Григорьева Е. А. Сорбционные свойства глауконита Каринского месторождения. Дисс. … канд. хим. наук. — Челябинск, 2004. 144 с.
7. Николаева И. В. Минералы группы глауконита и эволюция их химического состава. В кн.: Проблемы общей и региональной геологии. — Новосибирск: 1971. С. 320–336.







