Разработан способ синтеза 2-метилфенил-азо-4'-гидрокси-6-бромофенил-карбокси-3' и изучены его квантово-химические характеристики.
Радость от восприятия цвета — одно из старейших культурно-эстетических чувств человечества. Уже в древние времена люди заботились о том, чтобы окрасить одежду и предметы домашнего обихода в красивые цвета. В религиозно-культовых обрядах, напротив, использовали устрашающие и отталкивающие расцветки. Во все времена цвет имел символическое значение, как это и сейчас выражается в цветах гербов и национальных флагов. Когда в 50-е годы XIX столетия органическая химия начала своё триумфальное шествие, одной из важнейших проблем, стоявших перед нею, являлось получение природных красителей синтетическим путем. [1]
В химии синтетических органических соединений особое развитие приобрели направления тонкого органического синтеза веществ, среди которых значительная роль отводится производным азофенолов. Развитие этой отрасли органической химии является проблемой, требующей глубокой разработки и научно-обоснованных подходов.
Разработка нового способа получения или синтеза новых соединений на основе различных функциональных групп и их практическое применение имеет широкие перспективы в решении первоочередных задач развития, прежде всего, в фармацевтике, медицине и сельском хозяйстве. Поэтому поиск и синтез, а также технология получения производных азокрасителей является актуальной задачей современного органического синтеза.
Разработан технологический процесс, состоящий из одной технологической линии, процесс периодический. Метод получения 2-метилфенил-азо-4'-гидрокси-6-бромофенил-карбокси-3' заключается во взаимодействии 2-метиланилина с 4-бром-2-гидроксибензойной кислотой в присутствии диазотирующей смеси (HCI+NaNO2) по нижеприведенной схеме:
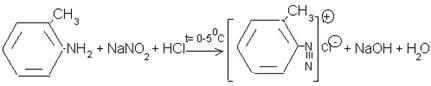
Азосочетания приводят к образованию азокрасителей.
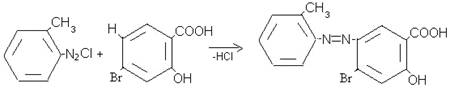
В процессе получения 2-метилфенил-азо-4'-гидрокси-6-бромофенил-карбокси-3' газообразные и твёрдые отходы не образуются. В качестве жидких отходов образуются водные слабые растворы NaCI и Н2О.
Готовый продукт 2-метилфенил-азо-4'-гидрокси-6-бромофенил-карбокси-3' представляет собой оранжевого цвета порошок с температурой плавления 217–2180С, растворяющийся в органических растворителях-НСООН, СН3СООН, ДМФА, ДМSО, нитробензоле, CCI4, ДМАЦ и многих других. Выход- 30,48 г (91 %)
Таблица 1
Физико-химические параметры красителя
|
Структурная формула |
Выход % |
ТплоС |
Rf |
Брутто формула |
Элем.анал.N, % |
|
|
Вычис % |
Найд. % |
|||||
|
|
91 % |
217–2180С |
0,64 |
C14H11BrN2O3 |
8,36 |
8,09 |
Молекулы азокрасителя содержат большую сопряженную систему и, кроме того, неподеленные пары на атомах азота. В зависимости от условий синтеза могут получаться таутомеры, цис-форма является нестабильным изомером, который быстро превращается в транс-форму-стабильный изомер с максимальным сопряжением [2].
Квантовая механика, в том числе, квантово-химическая характеристика, в принципе позволяет дать исчерпывающее объяснение любым экспериментальным данным о реакционной способности органических соединений и предсказать возможные направления реакций. Однако для реализации этих возможностей необходимо иметь мощные электронно-вычислительные машины и современные пакеты программ [3–4].
За последние годы в этих областях был достигнут существенный прогресс. Благодаря быстрому развитию квантовой химии были разработаны достаточно эффективные полуэмпирические и неэмпирические варианты методов изучения квантово-химических характеристик молекул, представляющих интерес, особенно для органической химии. С их помощью можно установить, какие факторы определяют направление и относительный выход продуктов реакции, а также получить недоступную для эксперимента информацию о геометрии и электронной структуре образующихся продуктов, а также переходных состояний. В большинстве прикладных квантово-химических работ приходится вычислять геометрию органических соединений. Такие расчеты проводят как для стабильных молекул, так и для короткоживущих — промежуточных интермедиатов и переходных состояний. Эти данные позволяют получить интересную информацию об их строении и поэтому представляют самостоятельный интерес с точки зрения органиков. Кроме того, знание геометрии молекулы необходимо для вычисления теплот образования, тепловых эффектов и энергии активации реакций. В связи с этим возникает вопрос о точности вычисления геометрии органических соединений приближенными методами квантовой химии, которые применяются повсеместно. Надо отметить, что сделать это на основе сравнения с экспериментом удается только для достаточно стабильных соединений.
Предсказание конкретной координации электронодонорных и акцепторных центров более сложных органических молекул, состоящих из разных гетероатомов, является весьма трудной и актуальной задачей органической химии. С развитием различных методов квантово-химических расчетов молекул, появилась возможность планирования экспериментальных исследований и проведения синтеза соединений с заранее заданной структурой и химическими свойствами [5]. Такие параметры также могут использоваться при определении технологических параметров процесса получения продуктов.
Исходя из этого были проведены исследования электронной плотности и распределения зарядов в молекулах исследованных соединений и определены их 3Д структуры полуэмпирическим кванто- химическим методом РМ 3. [6].
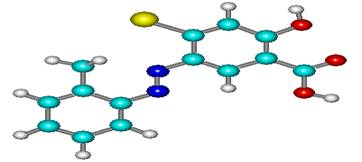
В качестве примера приведены результаты изучения геометрии и электронного строения, а также 3Д структуры 2-метилфенил-азо-4′-гидрокси-6-бромофенилкарбокси-3′. (Рис.1.)
|
Рис.1. (а) 3D структура 2-метилфенил-азо-4`-гирокси-6-бромо-фенил-карбокси-3` |
|
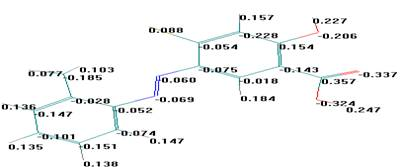
Рис.1. (б) Распределение зарядов в молекуле 2-метилфенил-азо-4`-гирокси-6-бромо-фенил-карбокси-3` |
|
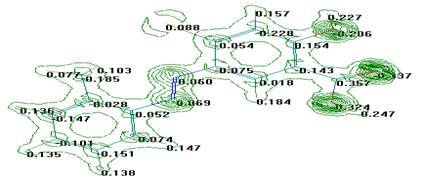
Рис.1. (в) Распределение электронной плотности по атомам 2-метилфенил-азо-4`-гирокси-6-бромо-фенил-карбокси-3` |
Рис.1. 3Д структуры (а), распределение зарядов (б) и электронной плотности (в) в молекуле 2-метилфенил-азо-4′-гидрокси-6-бромофенил карбокси-3′.
Из полученных данных видно, что распределение зарядов в молекуле 2-метилфенил-азо-4′-гидрокси-6-бромофенилкарбокси-3′ имеет сложный характер. Максимальный отрицательный заряд углерода (-0,228) находится в незамещенном С5 вфенильном кольце, содержащем карбоксильную группу. Минимальный отрицательный заряд углерода (-0,018) находится в незамещенном С2 втом же фенильном кольце. Углероды С2 и С5 фенильного кольца связаны с водородом. В С3 углерода имеется карбоксильная группа. Она является ориентантом второго рода, который уменьшает электронную плотность фенильной группы. За счет этого двойная связь между С3 иС4 смещается в сторону С3 углерода, а углерод С4 имеет положительный заряд (0,154). Электронная плотность двойной связи углеродов С5 – С6 смещается в сторону С5, заряд С5 равен -0,228, а С6 -0,054. Электронная плотность атома брома находящегося в С6 углерода бензольного кольца, во-первых, смещается в сторону фенильной группы, так как является ориентантом первой группы, повышающим электронную плотность. Во-вторых, связь Br-C6 является ковалентно полярной, за счет электроноотрицательности атома Br частично смещается в его сторону и имеет наименьший положительной заряд (0,088). За счет смещения электронной плотности π-связи в двойной связи (›С1=С2‹), С1 имеет значительной отрицательной заряд (-0,075), больший чем заряд С2 (-0,018) связанного с атомом водорода. Максимальный положительной заряд атома водорода наблюдается в гидроксильной группе. Эти полученные теоретически квантово-химические данные подтверждаются сопоставлением их информацией, полученной на практике.
Распределение электронной плотности по атомам в молекуле 2-метил-фенил-азо-4′-гидрокси-6-бромофенил-карбокси-3′ (Рис.1.(в) показывает, что максимальная электронная плотность наблюдается в гидроксильной и карбоксильной группах. На основе этого можно предполагать, что реакции замещения протекают за счет атома водорода этих групп, а реакция присоединения, возможно, протекает за счет карбонильной группы.
Таким образом, метод получения производного 2-метил-фенил-азо-4′-гидрокси-6-бромофенил-карбокси-3′ технически прост, селективен, удобен и эффективен, не требует специальной аппаратуры и проводится при комнатной температуре. Даёт экономический эффект из-за высокого выхода целевого продукта, легкой осуществляемости и стоимости исходных реагентов и растворителей.
Исследования в этой области продолжаются.
Литература:
1. Бурятский Государственный Университет Курсовая работа по органической химии «Получение синтетических красителей реакцией азосочетания на примере синтеза 3-окси-4-карбоксиазобензола» стр. Улан-Уде, 2003г.
2. Вязьмин С. Ю., Березина С. Е., Ремизова Л. А., Дамнин И. Н., Гляйтер Р. Синтез новых сопряженных диинов, содержащих карбаматные группы и изучение их свойств. //Ж. орган. химия, 2002, т. 38, № 6, С.817–829.
3. Степанов Н. Ф. Квантовая механика и квантовая химия.-Москва, 2001. –С. 128–129.
4. Кнунянс И. Л., Бояринов А. Д. Математическое моделирование. Москва, 2008. том 3. С. 1454–1465.
5. Нурманов С. Э. Моделирование процесса винилирования пиперидина // Кимёвий технология. Назорат ва бошкарув. Ташкент, 2006. № 5. С. 20–24.
6. Кобзев Г. И. Применение неэмпирических методов в квантого-химических расчетах. Оренбург: ГОУ ОГУ, 2004. 150с.