ВВЕДЕНИЕ
С каждым годом число онкологических больных неуклонно растет, при этом смертность от злокачественных опухолей прочно занимает второе место в мире после кардиоваскулярной патологии. Онкологические заболевания центральной нервной системы составляют не менее 8 % от общего числа опухолей. На метастатическое поражение приходится 3,5–52,8 % (в среднем 28 %) от общего числа опухолевого поражения головного мозга, и эта цифра продолжает увеличиваться. Причинами этого являются: рост числа злокачественных опухолевых заболеваний, увеличение продолжительности жизни онкологических больных и, как следствие, повышение вероятности метастазирования. По данным статистических исследований, проведенных в США и Европе, прижизненная диагностика метастазов в общей популяции онкологических больных составляет 13–20 %, а смертность от вторичного опухолевого поражения ЦНС достигает 70 000 ежегодно. Прогноз у данной категории больных достаточно плохой. Несмотря на качественную современную диагностику и проводимое лечение, продолжительность жизни больных с метастазами в головной мозг составляет в среднем около года. В то же время, как оказалось, именно от своевременности диагностики напрямую зависит продолжительность жизни данных больных. Метастазирование может происходить из опухолей любой локализации, однако наиболее частыми источниками являются рак легкого (26 %) и молочной железы (16 %), меланома различной локализации (40 %), рак почки (13 %) и злокачественные новообразования других органов (в среднем 5 %).
ЦЕЛЬ.
Изучить магнитно-резонансно томографические признаки метастатического поражения веществ головного мозга.
МАТЕРИАЛ И МЕТОДЫ.
Работа основана на данных обследования 46 пациентов с метастазами в головной мозг, находившихся в Научно Исследовательский Институте Нейрохирургии, в период 2012–2013 г. Мужчин было 28, женщин 18, в возрасте от 32 до 62 лет (средний возраст 47 лет).. Магнитно-резонансная томография головного мозга была выполнена всем 46 больным. Исследования проводились на аппаратеMAGNETOM OPEN VIVA (Siemens) с напряженностью магнитного поля 0,2 Т в трех взаимоперпендикулярных проекциях, в режимах Т2 трансверзальная проекция, толщина среза 6 мм, T1 сагиттальная проекция, толщина среза 5 мм. При подозрении на кистозный характер изменений дополнительно проводилось исследование в режиме FLAIR (последовательность IR с получением Т2 взвешенных изображений и эффектом поглощения воды) в трансверзальной проекции для оптимальной визуализации отмечаемых изменений.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ.
Результаты исследование показали, что наиболее часто визуализировались одновременно с двух сторон мозга 22 (47,8 %) наблюдений. Значительно реже они локализовались только справа 13(28,3 %), а только слева встречались в 11(23,9 %).
Очаги метастазов находились в височном доле мозга 12 (26 %), лобном доле мозга 9 (19,6 %), теменном доли мозга 9 (19,6 %), затылочном доли мозга 3 (6,5 %), в стволе мозга 5 (10,5 %), в мозжечке 5 (10,9 %) и в желудочковых системах составляли 3 (6,5 %).
Отмечено, что у 31 (67,4 %) больных метастазы располагались супратенториально, у 8 (17,4 %) больных — супра- и субтенториально, а у 7 (15,2 %) больных — субтенториально.
Множественные итракраниальные метастазы выявлена у 14 (30,4 %) больных, одиночные — у 52(69,6 %). Сведения о частоте поражения отдельных образований головного мозга приведены в табл. 1.
Таблица 1
Распределение множественных метастазов в головном мозге по локализации
|
Сочетание зон мозга |
Количества случаев |
|
|
абс. |
% |
|
|
Левая лобная доля и др. |
2 |
14,2 |
|
Правая лобная доля и др. |
1 |
7,2 |
|
Левая височная доли и др. |
4 |
28,5 |
|
Правая височная доля и др. |
2 |
14,2 |
|
Левая теменная доля и др. |
3 |
21,5 |
|
Правая теменная доля и др. |
1 |
7,2 |
|
Затылочная доля и др. |
1 |
7,2 |
|
ВСЕГО: |
14 |
100 |
Данные о распределении одиночных метастазов в головной мозг указаны в таб. 2.
Таблица 2
|
Сочетание зон мозга |
Количества случаев |
|
|
абс. |
% |
|
|
Левая лобная доля и др. |
7 |
13,5 |
|
Правая лобная доля и др. |
4 |
7,7 |
|
Левая височная доли и др. |
15 |
28,8 |
|
Правая височная доля и др. |
7 |
13,5 |
|
Левая теменная доля и др. |
11 |
21,1 |
|
Правая теменная доля и др. |
4 |
7,7 |
|
Затылочная доля и др. |
4 |
7,7 |
|
ВСЕГО: |
52 |
100 |
Таким образом чаще других метастазов выявлялись в теменных, лобных и височных долях, реже — в базальных ядрах и структурах задней черепной ямки. Как правило, метастазы локализовались на границе белого и серого вещества головного мозга.
Чаще — у 30 (65,2 %) пациента — встречались средние очаги размеры от 1.5 до 3.0 см в диаметре. Боле мелкие до 1.0 см 6 (13 %) визуализировались при множественном поражения и сочетались с боле крупными (боле 3.0 см) 10 (21,8 %) узлами метастазов.
Формы метастатического поражения головного мозга составило: неправильные 20 (43,5 %), шаровидные 14 (30,4 %), овальные 12 (26,1 %) формы узлов.
Однородная кистозная структура наблюдались у 38 (82,6 %) они на Т2 ВИ давали гиперинтенсивные сигналы по отношения окружающего мозгового ткани, а на Т1 ВИ слабо гипо или изо интенсивные сигналы. Ранним признаком некроза в метастазах в 5 (10,5 %) случаях было снижение интенсивности в их центральной части. Центральный некроз в 3 (60 %) наблюдениях давал гипоитенсивный сигналов режиме Т1 ВИ и гиперинтенсивный в режиме Т2 ВИ. Наличие некротических изменений проявлялось при МРТ гетерогенной кольцевидной структурой. Зона распада хорошо прослеживалось при использовании режима FLAIR, когда отчетливо дифференцировалось некроз.
3 (6,5 %) случаях кровоизлияния в метастазы характеризовались появлением гиперинтенсивной зоны на Т1 ВИ.
В 17 (36,55 %) наблюдениях метастазы были окружены еще более интенсивной в Т2 ВИ рельефной зоной перифокального отека, которая затрудняла визуализацию самого опухолевого узла (рис 1и 2).
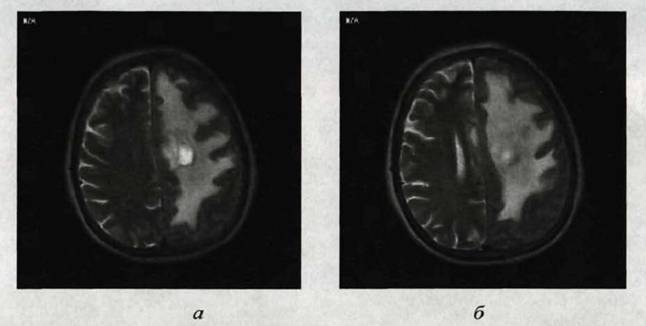
Рис. 1. МРТ головного мозга Одиночный метастаз в левую теменную долю головного мозга больной К., 61года. Метастаз имеет форму узла неправтльной овальной формы, сдавливая тело бокового желудочка. Видна рельефная зона перифокального отека, которая затрудняет визуализацию самого опухолевого узла(Т2 ВИ): а и б — асиальная проекции.
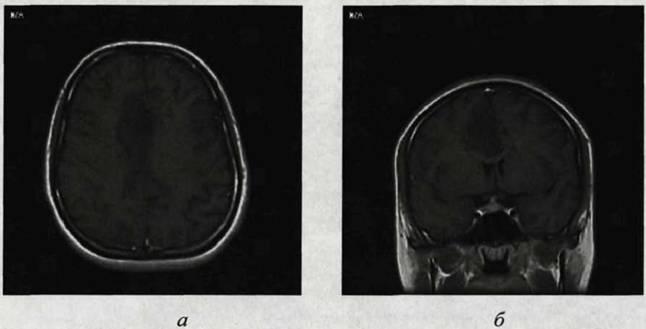
Рис. 2. МРТ головного мозга. Одиночный метастаз в правую лобную долю головного мозга боьной А., 42 лет. Перифокальный отек затрудняет визуализацию патологического очага (Т1 ВИ): а — аксиальная, б — фронтальная.
На Т1 ВИ в 2 (11,7 %) наблюдениях отек визуализировалось плохо в виде зоны пониженной интенсивности сигнала. У значительной части больных 15 (88,3 %) перифокальный отек был более выражен по полюсам — в виде так называемого симптома «пальцев». Данный вид отека не распространялся на серого вещество и практический никогда не пересекал мозолистое тело (рис. 3).
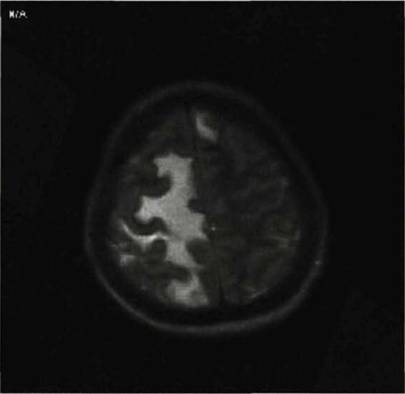
Рис. 3. Перифокальный отек более выражен по полюсам и имеет пальцевидную форму.
Наряду с перифокальными отеками, у 29 (63 %) случаев наблюдались так называемый симптом «масс эффект».
Высокая чувствительность МРТ как метод выбора позволяла более уверенно диагностировать объем поражения. В целом, при оценки МРТ — новообразований головного мозга метастатического характера, можно выделить как локальные признаки, так и общие проявления патологического процесса. По наших исследованиях видно что множественные и одиночные метастатические очаги локализируются в большинстве случаев в левая височно-теменном долях (см. таблицах 1 и 2.).
Проводимые МРТ — исследования в диагностике метастазов головного мозга показывают, что определенные трудности возникают при дифференцировке их с кровоизлияниями, злокачественными глиомами, абсцессами, гранулемами, паразитарными кистами, невриномами слухового нерва, менингиомами, инфарктом, радиационным некрозом, аденомой гипофиза, прогрессирующей мультифокальный лейкоэнцефалопатией, рассеянным склерозом в стадии обострения.
При дифференциальной диагностик постишимические изменений с метастатическими поражением ведущую роль играет анализ косвенных признаков, свидетельствующих об атрофических изменениях и дефиците веществ мозга. Высокая чувствительность МРТ — метода ведет и к дополнительным трудностям. Мелкоочаговые субкортикальное поражения встречается при большом количестве патологических процессов: цереброваскулярной болезни, демиелинизирующих процессах, воспалительных заболеваниях. В этом случае таки важные признаки, как множественность поражения и субкортикальная локализация, теряет свою значения. Заподозрить вторичных характер поражения позволяют лишь данные анамнеза и внутривенного контрастного усиления.
Некоторые первичные опухоли характеризуются мультифокальным ростом, например мультиформная глиобластома (Chadduk W. W. 1983). Опухоль происходит из белого вещества, но может также возникать в базальных ганглиях и таламусе, отличается агрессивном, инфильтрирующим ростом, может достигать поверхности мозга, вовлекать оболочки, распространяться через мозолистое тело в противоположное полушарие. Мультиформная глиобластома может быть неотличима от метастазов, лимфомы, других опухолей глиального ряда, множественных лакунарных инфарктов, рассеянного склероза, фокусов воспаления (Van der Knaap M. S., 1996).
Контраст хорошо усиливает изображения папиломы. Могут обнаруживаться признаки предшествующего кровоизлияния.
Астроцитома. При МРТ опухолевая ткань обычно слегка гипоинтесивна на Т1 ВИ и отчетливо гиперинтесивна на Т2 ВИ. Опухоль обычно выглядит гомогенной с хорошо очерченными границами, контрастное усиления наблюдаться при узловой или диффузной формах. Границы опухоли относительно хорошо очерчены. Перифокальный отек сопутствует редко.
Абсцессы. Абсцесс визуализируется в виде кольцевидно усиленного поражения с обширным отеком окружающего белого вещества. Капсула абсцесса нередко гиперинтенсивна на Т1 ВИ, возможно, из-за парамагнитных эффектов свободных радикалов. Центр абсцесса либо гипоинтенсивен, либо изоинтенсивен. На Т2 ВИ абсцесс обычно гиперинтенсивен. Капсула абсцесса заметно усиливается после введения котрастного вещества.
ВЫВОД.
МРТ — признаки, наиболее характерные для всех метастазов злокачественных новообразований в головной мозг:
1. Выраженный пальцевидный или диффузный перифокальный отек, вызывающий дислокацию структуру мозга.
2. Средние (от 1,5 до 3,0 см) и большие (более 3,0 см) опухолевого узла.
3. Шаровидной и неправильной округлой форма узлов.
4. Двухсторонний лобно-теменно-височная локализация процесса.
5. Преобладание одиночный характер метастазирования.
Независимости от гистологической структуры метастаза общие МРТ — проявления характеризовалось патологическим изменением интенсивности сигнала, а также деформацией структуры мозга, прилежащих к зоне поражения и изменяющихся в процессе бластоматозного роста. Общие проявления патологического изменений обусловлены, прежде всего, локализацией, размерами опухолевого узла и выраженностью перетуморозного отека.
Литература:
1. Щиголев Ю. С. Комплексное лечение метастазов злока-чественных опухолей в головной мозг(хирургические аспекты) // Дисс. Докт. М. — 1996.
2. Aghoula O., Benoit B., Cross p. et al. Prognostic factors de-rived from recursive partitioning analysis (RPA) of RTOG brain metastases trials applied to surgically resected and ir-radiated brain metastases cases // Int. J. Radiat. Oncol. Biol. Phys. — 1998. — Vol. 42. — P. 155–159.
3. Bigner S. H., Schold S. H. The diagnosis of metastases to central nervous system // Pathol. Annual. — 1984. — Vol. 19. — P. 89–119.
4. Bindal R. K., Sawaya R., Leavens M. E. Surgical treatment of multiple brain metastases // J. Neurosurgery. — 1993. — V. 79. — P. 210–216.
5. Borgelt B., Gelber R., Larson M.et al. Ultra-rapid high dose irradiation schedules for palliation of brain metastases: final results of two studies by the RTOG // Int. J. Radiat. Oncol. Biol. Phys. — 1981. — Vol. 7. — P. 1633–1638.
6. Carrier D. A., Mawad M. E., Kirkpatrick J. B. Metastatic ad-enocarcinoma to the brain // AJNR. — 1994. — Vol. 15. — P. 155–159.
7. Culine S., Bekradda M., Kramar A. et al. Prognostic factors for survival in patients with brain metastases from renal cell carcinoma // Cancer. — 1998. — V. 83. — P. 2548–2553.
8. Folkman J.Clinical application of research on angiogenesis // N. Engl. J. Med. — 1995. — Vol. 333. — Р. 1757–1763.
9. Gaspar L., Scott C., Rotman M. et al. Recursive partitioning analysis (RPA) of prognostic factors in three RTOG brain metastases trials // Int. J. Radiat. Oncol. Biol. Phys. — 1997. — Vol. 37. — P. 745 —751.
10. Gelber R. D., Larson M., Borgelt B. B.et al. Equivalence of radiation schedules for palliative treatment of brain metastases with favorable prognosis // Cancer. — 1981. — Vol. 48. — P. 1748–1753.
11. Glantz M. J., Cole B. F., Forsyth P. A.et al. Practice parameter: anticonvulsant prophylaxis in patients with newly diagnosed brain tumors. Report of the Quality Standards Subcomittee of American Academy of Neurology// Neurology. — 2000. — V. 54. — P. 1886–1893.
12. Graf A., Buchberger W., Langmayr H. Site preference of metastatic tumours of the brain //Virchows Arch. A Patchol. Anat. Histopathol. — 1988. — Vol. 412. — P. 493–498.
13. Greenberg H. S., Deck M. D., Vikram B.Metastasis to the base of the skull: clinical findings in 43 patients // Neurology. — 1988. — Vol. 31. — P. 530–537.
14. Greenberg M. S. Cerebral metastases // Handbook of Neu-rosurgery. Greenberg Graphics, Inc., Vol. 1. — P. 318.
15. Greenlee R. T., Hill-Harmon M. B., Murray T. et al. Cancer statistics 2001 // CA Cancer J. Clin. — 2001. — V. 51. — P. 15–36.
16. Gutin P. H. Corticosteroid therapy in patients with cerebral tumor: benefits, mechanisms, problems, practicalities // Semin. Oncol. — 1975. — V. 2. — P. 49–56.
17. Horton J., Baxter D. H., Olson K. B. The management of metastases to the brain by irradiation and corticosteroids // Am. J. Roengenol. Radium. Ther. Nucl. Med. — 1971. — Vol. 111. — P. 334–335.
18. Kristensen C., Kristjansen P., Hansen H.et al. Systemic chemotherapy of brain metastases from SCLC // J. Clin. Oncol. — 1992. — V. 10. — P. 1498–1502.
19. Lagerwaald F. J., Levendag P. C., Nowak P. J. et al. Identification of prognostic factors in patients with brain metastases. A review of 1292 patients // Int. J. Radiat. Oncol. Biol. Phys. — 1999. — Vol. 43. — P. 795–803.
20. Landes S., Murrey T., Bolden S.et al. Cancer statistics. C. A. Cancer J. Clin. — 1999. — Vol. 49. — P. 8–20.
21. Marin F., Kovacs K., Scheithauer B. W. et al. The pituitary gland in patients with breast carcinoma: a histologic and immunocytochemical study of 125 cases // Mayo Clinic Proc. — 1992. — Vol. 67. — P. 949–956.
22. Mintz A. H., Kestle J., Rathobone M. P. et al. A randomized trial to assess the efficacy of surgery in additional to radiotherapy in patients with a single cerebral metastasis // Cancer. — 1996. — V. 78. — P. 1470–1476.
23. Mintz A. P., Cairncross J. G. Treatment of single brain metastasis. The role of radiation following surgical excision // JAMA. — 1998. — Vol. 280. — P. 1527–1529.
24. Murrey K. J., Scott C., Greenberg H. M.et al. A randomized phase III study of accelerated hyperfractionation versus standard in patient with unresected brain metastases: a report of RTOG 9104 // Int. J. Radiat. Oncol. Biol. Phys. — 1997. — Vol. 39. — P. 571–574.
25. Nissbaum E. S., Djalilian H. R., Cho K. H. Brain metastases. Histology, multiplicity, surgery and survival // Cancer. — 1996. — V. 78. — P. 1781–788.
26. Oneschuk D., Bruera E.Palliative management of brain metastases // Support Care Cancer. — 1998. — V. 6. — P. 365–372.
27. Patchell R. A., Tibbs P. A., Wallsh J. W. et al. A randomized trial of surgery in the treatment of single metastases to the brain // N. Engl. J. Med. — 1990. — V. 322. — P. 494–500.
28. Patchell R. A., Tibbs P. A., Regine W. F. et al. Postoperative radiotherapy in treatment of single metastasis to the brain: rando-mized trial // JAMA. — 1998. — Vol. 280. — P. 1485–1489.
29. Percy A. K., Elveback L. R., Okazaki H.Neoplasms of central nervous system: epidemiologic considerations // Neurology. — 1972. — Vol. 22. — P. 40–48.
30. Postmus P., Haaxma-Reiche H., Sleijfer D.et al. High dose etoposide for brain metastases of SCLC. A phase II study. The EORTC Lung Cancer Cooperative Group // Br. J. Can-cer. — 1989. — V. 59. — P. 254–256.
31. Sampson J., Carter J. J., Friedman A. Demographics, prognosis, =therapy in 702 patients with brain metastases from malignant melanoma // J. Neurosurgery. — 1998. — V. 48. — P. 14–16.
32. Sause W. T., Scott C., Kirsch R. et al. PHASE I / II trial of accelerated fractionation in brain metastases RTOG 85–28 // Int. J. Radiat. Oncol. Biol. Phys. — 1993. — Vol. 26. — P. 653–657.
33. Sawaya R. Surgical treatment of brain metastases // Clin. Neurosurg. — 1999. — Vol. 45. — P. 41–47. 34.Sawaya R.Intracranial metastases //Blackwell Futura. — 2004. — P. 111.
34. Steward P. A., Hayakawa K., Farrell C. L. Quantitative study of microvessel ultrastructure in human peritumoral brain tissue. Evidence for a blood-barrier defect // J. Neurosurgery. — 1987. — Vol. 67. — P. 697–705.







