Введение
Анкилозирующий спондилит (АС) является наиболее характерным признаком серонегативного спондилоартрита. Боль в нижней части спины является наиболее частой причиной ограничения физической активности лиц трудоспособного возраст [2–4]. Около 70 % пациентов с анкилозирующим спондилитом (АС) через 10–15 лет теряют трудоспособность и имеют значительное снижение качества жизни [1,2].
Рентгенография все еще широко используется в диагностике анкилозирующего спондилита из-за своей более доступности относительно других методов лучевой диагностики. Основные рентгенологические изменения позвоночника у больных анкилозирующим спондилитом следующие: передний и задний спондилит, спондилодисцит, изменения синовиальных суставов, синдесмофиты, оссификация связок, остеопороз, переломы позвонков и синдесмофитов. Передний и задний спондилит проявляются как краевые эрозии в области лимбуса с последующим развитием остеосклероза («лоснящиеся углы» тел позвонков). Характерно эрозирование всей переднебоковой поверхности тел с утратой вогнутости (квадратизация тел позвонков). Эти рентгенологические изменения являются относительно ранними. Спондилодисцит проявляется в виде эрозий и склероза замыкательной костной пластинки тела вдоль межпозвоночного диска. Деструкция может быть разных размеров, иногда значительна (блюдцеобразные или чашевидные дефекты), сужение межпозвоночных промежутков наблюдается не постоянно. По обзорным данным М. Cawley et al., частота спондилодисцита составляет от 1 до 28,5 %. Возможна любая локализация, чаще Th8-L2, и изменения нескольких сегментов. В большинстве случаев спондилодисцит выявляется на поздних стадиях АС на фоне анкилозирования позвоночника, но известны более ранние случаи. По данным рентгенографии шейного отдела позвоночника изменения (в том числе клинически бессимптомные) дугоотростчатых суставов были выявлены у 28,0 %, а атлантоаксиального сустава — у 19,8 % пациентов с АС, средняя длительность болезни у которых составляла 10,7 года. Для АС характерны краевые несмыкающиеся и смыкающиеся синдесмофиты, которые развиваются вследствие оссификации наружных слоев фиброзной части межпозвоночных дисков и обнаруживаются в основном спереди, но также и сзади. Формируются на поздних стадиях болезни, первоначально в переходных отделах позвоночника. Реже отмечаются парасиндесмофиты (оссификация превертебральной соединительной ткани). На поздних стадиях АС закономерно происходит оссификация межостистых и желтых связок, а также (редко) задней продольной связки позвоночника. При АС развивается остеопороз позвоночника как следствие воспаления и ограничений подвижности. Морфометрический анализ тел позвонков грудного и поясничного отдела обнаружил остеопоротические деформации у 16,7 % пациентов с АС достоверно чаще, чем в контрольной группе (2,6 %); продолжительность АС у пациентов с деформациями позвонков была больше, чем у пациентов без деформаций. В поздних стадиях АС возможно возникновение стресс-переломов анкилозированных структур позвоночника и остеопоротичных позвонков. Переломы могут возникать на любом уровне, но чаще отмечаются в нижнешейном, верхнегрудном и тораколюмбальном переходном отделах. Наиболее часто отмечаются трансдисковые переломы. Также наблюдались другие изменения позвоночника при анкилозирующем спондилите такие как, изменение физиологического искривления позвоночного столба, сглаживание поясничного лордоза, гиперкифоз грудного отдела. В отдельных случаях наблюдается кальцификация межпозвонковых дисков.
Магнитно резонансная томография (МРТ) эффективно используется как первичный метод оценки изменений в хряще периферических суставов. По данным нескольких авторов [6,7] метод способен выявлять изменения при анкилозирующем спондилите (АС) за счет отека костного мозга и контрастного усиления суставной поверхности.
Магнитно-резонансная томография (МРТ) у больных с анкилозирующим спондилитом (АС) привлекает большое внимание, поскольку является единственным методом, потенциально позволяющим выявить воспалительные изменения крестцово-подвздошных суставов, позвоночника и других отделов опорно-двигательного аппарата, которые малодоступны непосредственному осмотру. Вместе с тем уточнены далеко не все клинические и диагностические аспекты этого метода при АС. Неясна чувствительность МРТ для диагностики воспаления позвоночника, не изучены в достаточной мере взаимосвязь зон воспаления, выявляемых с помощью МРТ, с клиническими показателями активности заболевания, эволюция МРТ-изменений по мере развития заболевания.
Цель.Сравнение эффективности рентгенографии и МРТ в выявлении изменений позвоночника больных с анкилозирующим спондилитом (АС).
Материалы и методы:
Исследовано 36 больных (22 мужчин и 14 женщин) проходивших обследование и лечение в II-клинике ТМА в связи с подозрением на анкилозирующий спондилит, которым в соответствии с модифицированными Нью-Йоркскими критериями [11] был установлен диагноз определенного идиопатического АС. В целях данного исследования, помимо общей длительности болезни, отсчитываемой от любых первых клинических симптомов АС, на основании расспроса пациентов определялась длительность спондилита (болей воспалительного характера в позвоночном столбе). На момент исследования высокая общая активность заболевания была у 21 пациента. Боли воспалительного характера в различных отделах позвоночника отмечались у 33 пациентов. Всем пациентам проведена (не более чем за 6 мес. до МРТ-исследования) стандартная рентгенография всех отделов позвоночника в прямой и боковой проекциях. Рентгенография шейного отдела позвоночника выполнялась в положении больного стоя. Прямая (или переднезадняя) проекция — центрация в горизонтальной плоскости на середину вертикальной линии между верхушкой сосцевидного отростка и надключичной ямкой. Боковая проекция — центрация на угол нижней челюсти. Кассета размером 18 х 24 см. Технические условия проведения исследований составляли в среднем 60 kV, 100 mA и 200 ms, в зависимости от приемника изображений и массы пациента. Рентгенография грудного отдела позвоночника выполнялась в положении больного лежа на спине и боку. Прямая (или переднезадняя) проекции — центрация на середину тела грудины. Боковая проекция — центрация на точку, расположенную по задней подмышечной линии на уровне нижнего угла лопатки. Кассета размером 30 х 40 см. Технические условия проведения исследований составляли в среднем 67 kV, 100 mA и 600 ms, в зависимости от приемника изображений и массы пациента. Рентгенография поясничного отдела позвоночника выполнялась в положении больного лежа на спине и боку. Прямая (или переднезадняя проекция) — центрация на 3 см выше пупка (уровень Lm позвонка). Боковая проекция — центрация на нижний край реберной дуги. Кассета размером 30 х 40 см. Технические условия проведения исследований составляли в среднем 70 kV, 200 mA и 600 ms, в зависимости от приемника изображений и массы пациента. Оценивалось наличие или отсутствие изменений, характерных для АС, такие как передний и задний спондилит, спондилодисцит, синдесмофиты, оссификация связок. Для количественной оценки изменений на рентгенограммах использовался Берлинский счет. Для этого выделяются так называемые вертебральные единицы (BE), расположенные между двумя параллельными линиями, проведенными через середину тел соседних позвонков. В шейном отделе выделяется 6 BE (от С2-С3 до С7-Th1), в грудном — 10 BE (от Тh3-Th4 до Th12-L1, в поясничном — 5 BE (от L1-L2 до L5-S1). Изменения в каждой BE оцениваются от 0 до 6 баллов (0 — отсутствие изменений, 1 — подозрение на склероз, 2 — небольшие эрозии и/или квадратизированные позвонки, 3 — небольшие единичные синдесмофиты и/или более крупные эрозии, 4 — два и более синдесмофитов и/или спондилит/спондилодисцит, 5 — смыкающиеся синдесмофиты двух позвонков, 6 — полные костные мостики). Максимальный счет = 6x21 = 126.
МРТ выполнялась в отделении лучевой диагностики III-клинике ТМА на аппарате Siemens Magnetom Open напряженностью магнитного поля 0,2 Т в режимах Т1, Т2, STIR. Толщина срезов была 3 мм во всех режимах с 1 мм расстояниями между срезами. Исследование проводилось в положении пациента на спине, без какой-либо предварительной подготовки. Шейный, грудной и пояснично-крестцовый отделы позвоночника исследовались отдельно. Отдел для исследования выбирался на основании преимущественной локализации болей, а у 3 больных, не предъявлявших жалобы на боль в момент исследования, выбор области сканирования (в двух случаях грудной отдел, а в третьем — грудной и поясничный отдел) основывался на локализации болей в прошлом. У всех больных оценивались изображения, полученные в режимах Т2, Т2 FS (Fat saturation) и Т1 в сагиттальной плоскости. С целью лучшей визуализации дужек, отростков позвонков, фасеточных суставов, а в ряде случаев атланто-зубовидного сустава у большинства больных также выполнялась томография в аксиальной плоскости. Томография в этой плоскости проводилась либо прицельно (в случае обнаружения на сагиттальных томограммах воспалительных изменений в указанных выше структурах), либо (при отсутствии изменений в сагиттальной плоскости) избирались позвоночные сегменты (обычно 6–7), соответствующие болевым ощущениям пациентов. Томография в аксиальной плоскости была проведена 29 пациентам (23 — грудного отдела, 7 — шейного отдела и 11 — поясничного отдела). Количество томограмм в сагиттальной плоскости составляло 12–15, а толщина среза — 4 мм в сагиттальной плоскости и 3 мм — в аксиальной плоскости.
В данной работе анализировались только воспалительные изменения позвоночника. Воспалительными считались изменения, которые характеризовались повышенной интенсивностью сигнала на Т2 FS-взвешенных изображениях. Последовательность Т1 использовалась в основном для оценки структурной патологии, как обусловленной АС, так и сопутствующей (протрузии и грыжи межпозвоночных дисков, грыжи Шморля и др.).
Подсчет воспалительных изменений проводился только у 29 пациентов, обследованных более полно (МР-томография позвоночника как в сагиттальной, так и в аксиальной плоскостях). Использовались два метода подсчета. С целью уточнения локализации воспаления подсчитывались изменения отдельных анатомических структур. За одно воспалительное изменение принимались (на одном Т2 FS-взвешенном изображении): а) каждая отдельная зона отека в теле позвонка, окруженная неизмененной костной тканью; б) отек субхондральныхотделов костей в области реберно-позвоночных или поперечно-реберных суставов; в) изолированный отек дужек позвонков, г) изолированный отек поперечных или остистых отростков; г) отек надостистых или других связок позвоночника; д) выпот вполости атланто-зубовидного или фасеточных суставов. Результаты этого метода подсчета представлены в табл.1
Таблица 1
Число и локализация воспалительных изменений, выявленных на мрт изображениях в сагиттальной и аксиальной плоскостях
|
Отделы позвоночника |
Шейный (n = 7) |
Грудной (n = 23) |
Поясничный (n = 11) |
|
Тела позвонков |
|||
|
Передний спондилит |
7 |
31 |
10 |
|
Задний спондилит |
5 |
63 |
5 |
|
Задние структуры позвоночника |
|||
|
Поперечные отростки |
_ |
27 |
3 |
|
Остистые отростки |
_ |
5 |
8 |
|
Артрит дугоотростчатых суставов |
1 |
_ |
11 |
|
Дужки |
_ |
7 |
4 |
|
Головки ребер |
_ |
27 |
_ |
|
Межостистые и надостистые связки |
1 |
2 |
_ |
|
Другие изменения |
Артрит атланто-зубовидного сустава (1) |
Артрит реберно-поперечных суставов (1), отек передней продольной связки (1) |
_ |
n — общее число изображений позвоночника (в сагиттальной и аксиальной плоскостях).
Результаты и обсуждение:
Показатель Берлинского счета в группе исследования вычисленных на рентгенограмммах варьировался от 76 до 113 (среднее значение 91+4.2). Краевые эрозии в области лимбуса (передний, задний спондилит, спондилодисцит) на рентгенограммах преимущественно выявлялся в шейной отделе у 9 (25 %) пациентов, в грудном отделе у 13 (36 %) пациентов, в поясничном отделе у 11 (30.5 %) пациентов. У 3 (8 %) пациентов степень эрозивных изменений была одинаковой в грудном и поясничном отделах. Эрозирование всей переднебоковой поверхности тел с утратой вогнутости (квадратизация тел позвонков) наблюдалось у 16 (44 %) пациентов(Рис.1). Сужение межпозвоночных промежутков и анкилоз наблюдались у 18 (50 %) пациентов (у 5 преимущественно в шейном отделе, у 11 в грудном отделе и у 2 в поясничном отделе). Синдесмофиты, развивающиеся вследствие оссификации наружных слоев фиброзной части межпозвоночных дисков отмечалось у 16 (44 %) пациентов, из них у 12 в передних отделах, у 4 в задних отделах. Оссификация межостистых и желтых связок выявился у 5 (14 %) пациентов. Рентгенологический выявляемый остеопороз позвонков наблюдался в 8(22 %) случаях (Рис.1). Поясничный лордоз был выпрямлен у 5 (14 %) пациентов. Гиперкифоз грудного отдела отмечался у 6 (17 %) пациентов. У 4 (11 %) отмечался кальцинация в проекции межпозвонковых дисков.
У 36 больных АС было получено всего 50 МРТ-изображений различных отделов позвоночника (30– грудного, 12 — поясничного и 8 шейного отдела). У 10 из них были получены МРТ-изображения нескольких отделов позвоночника. МРТ-признаки воспаления позвоночника были найдены у 35 (97 %) больных.табл.1 Изменения в задних структурах позвоночника в большинстве случаев были видны на сагиттальных томограммах и лишь подтверждались и детализировались на аксиальных срезах(Рис.2).
Однако 26 % всех зон воспаления были найдены на аксиальных томограммах, чаще в поясничном (32 %), реже в грудном (26 %) и шейном (14 %) отделах. Причем у 3 пациентов с небольшой длительностью спондиалгий признаки воспаления определялись только на аксиальных томограммах (дугоотростчатые суставы в поясничном отделе, реберно-позвоночные и реберно-поперечные суставы, поперечные и остистые отростки). Количественный подсчет воспалительных изменений в отдельных анатомических структурах позвоночника проведен на 41 изображении, полученном в двух плоскостях (сагиттальной и аксиальной) у 29 больных (табл.1). Зоны отека обнаруживались в углах тел позвонков (задний и передний спондилит) (рис. 2), в поперечных и остистых отростках, головках ребер и дужках. У большинства (у 26 из 29; 90 %) наиболее полно обследованных с помощью МРТ больных, которые предъявляли жалобы на боль в том или ином отделе позвоночника, локализация воспалительных МРТ-изменений точно соответствовала области болей. Несоответствие локализации болей и воспаления по данным МРТ отмечено только у трех больных. У пациентов с большей длительностью болей воспалительные изменения в телах позвонков отмечались достоверно чаще, чем у пациентов с небольшой длительностью болей.
Для облегчения интерпретации МРТ-данных мы старались отбирать больных молодого возраста с относительно небольшой давностью заболевания. При выборе укладки пациентов, плоскостей томографии, количества срезов, их толщины, а также режимов MPT-исследования мы, в основном, следовали рекомендациям группы немецких авторов [9, 10, 15], располагающих, видимо, наибольшим опытом. В соответствии с рекомендациями K.Puhakka и соавт. [11], дополнительно применялась томография в полуаксиальной плоскости. Пять анатомических зон «интереса» в области каждого КПС избирались нами так же, как и в исследовании B.Muche и соавт. [10].
Наши данные подтверждают существующие рекомендации о необходимости получения МРТ-изображений позвоночника при АС с применением трех режимов (Tl, Т2 и T2-FS) для полноценного анализа этой анатомической области. В Т1-режиме вследствие более высокой интенсивности сигнала лучше визуализируются хрящ, замыкательная костная пластинка и, следовательно, границы между хрящевой и костной частью КПС. Поэтому на Т1-взвешенных изображениях легче проводить поиск структурных изменений, в первую очередь эрозий. При использовании Т2-режима более четко визуализируются зоны отека, поскольку интенсивность сигнала от них усилена (Рис.3). Для уточнения характера изменений всегда необходимо сопоставление интенсивности сигнала в зонах «интереса» на Т2- и Т1-взвешенных изображениях. Принято считать, что в зонах отека интенсивность сигнала на Т2- взвешенных изображениях усилена, а в Т1-взвешенных изображениях снижена. В случае фиброза или склероза костного мозга интенсивность сигнала понижена и на Т1- и на Т2-взвешенных изображениях. Зоны жирового костного мозга характеризуются повышенной интенсивностью сигнала на Т2- и Т1-взвешенных изображениях. Частое наличие в крестце и подвздошной кости очагов жирового костного мозга в норме у лиц молодого возраста [11, 12] диктует обязательное получение T2-FS- изображений, на которых удается отличить воспалительный отек (интенсивность сигнала от этих зон остается повышенной, а сигнал от жира подавляется). Некоторые авторы считают достаточным применение только Т1- и T2-FS режимов, полагая, что Т-2 режим сам по себе не позволяет получить дополнительную информацию в отношении воспалительных изменений [13].
В настоящее время основное внимание уделяется изучению возможностей МРТ в ранней (дорентгеновской) диагностике сакроилиита и спондилита. Опубликованы результаты первых исследований, которые демонстрируют реальность такого подхода. Так, в исследовании L.Heuft-Dorenboschn соавт. [17] у больных СА с небольшой длительностью болей в позвоночнике (менее 2 лет) воспалительные МРТ- изменения были выявлены в 14 рентгенологически неизмененных КПС; у 5 больных по данным МРТ отмечался двухсторонний сакроилиит. Обращает на себя внимание тот факт, что воспалительные
МРТ-изменения не были найдены в 15 рентгенологически измененных КПС, а МРТ-изменения в целом (как воспалительные, так и структурные) отсутствовали в 13 рентгенологически измененных суставах. Из этого следует, что МРТ не может полностью заменить рентгенографию КПС в диагностике сакроилиита.
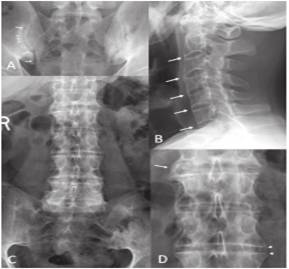
Рис. 1. Рентгенологические изменение в КПС и позвоночника при АС (А). Рентгенограмма КПС больного Ж. 23 года показывает АС.
Радиологические признаки анкилозирующего спондилоартрита позвоночника и крестцово-подзвдошного сочлинения.
Рентгенограмма КПС 23 летнего мужчины показывают подтвержденный анкилозирующий спондилит. Билатеральные эрозии являются причиной отдельных участков понижения плотности субхондральных участков и выраженное расширение суставной щели (стрелки) и слабая выраженность краев в других отделах (головки стрелок). Двусторонний субхондральный склероз более выражен слева.
(B)–(D) Рентгенограмма позвоночника 47 летнего мужчины с распростроненным анкилозом. В шейных позвонках отмечается экстенсивное формирование синдесмофитов которые формируют соединение передних краев тел позвонков. Некоторые грани суставов срощены, в особенности в С2-С3. Анкилоз поясничного отдела позвоночника (C; увеличение L1-L4 в D).
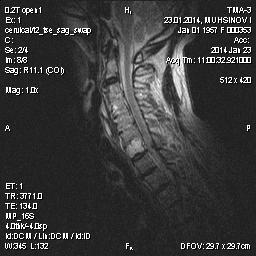
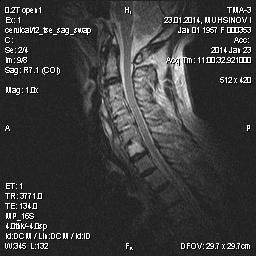
Рис. 2. Больной З., длительность АС 6 лет. Т2-взвешенная МРТ шейного отдела позвоночника. Зоны отека в передних углах тел С-3 (передний спондилит) и задне-верхнем углу С-6 (задний спондилит).
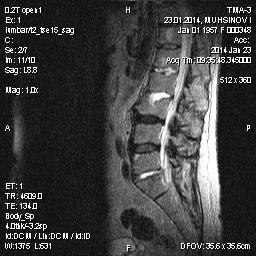
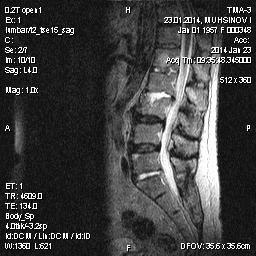
Рис. 3. Больной И., длительность АС 6 лет. На Т2 ви отмечается слерозирование межпозвонокового сочленения L2-L3, L5-S1.
Выводы:проведенное исследование позволило подтвердить высокое преимущество МРТ над рентгенографией в выявлении изменений позвоночника при АС. Наиболее часто эти изменения обнаруживались в грудном отделе, как в телах позвонков, так и в различных задних анатомических структурах (дугоотростчатых, реберно-позвоночных и реберно-поперечных суставах, отростках и надостистых связках). Изменения в задних элементах позвоночника отмечались достоверно чаще при небольшой давности спондилита, что указывает на необходимость повышенного внимания к этой локализации воспаления при ранней диагностике АС и обосновывает целесообразность проведения МРТ не только в сагиттальной, но и в аксиальной плоскости. Ориентиром для выбора отдела (отделов) позвоночника, которые избираются для МРТ-исследования, могут служить клинические данные (указание пациента на локализацию болей). Традиционную рентгенографию можно применять в качестве исследования для выявления динамики в изменениях позвоночника при АС. Различные принятые критерии рентгенологической оценки позвоночника при АС, такие как SASSS, RASSS, Берлинский счет, позволяют сравнить изменения на рентгенограммах не только качественно, но и количественно.
Литература:
1. Baraliakos X., Landewe R., Hermann K. G. et al. Inflammation in ankylosing spondylitis: a systematic description of the extent and frequency of acute spinal changes using magnetic resonance imaging. Ann. Rheum. Dis., 2005,64,730–734.
2. Maksymowych W. P., Inman R. D., Salonen D. et al. Spondyloarthritis Research Consortium of Canada magnetic resonance imaging index for assessment of spinal inflammation in ankylosing spondylitis.Arthr.Rheum. 2005,53,502–509.
3. Maksymowych W. P., Lambert R. G. W. Magnetic resonance imaging for spondyloarthritis — avoiding the minefield (editorial). J. Rheumatol., 2007,34,259–265.
4. Braun J., Baraliakos X., Golder W. et al. Magnetic resonance imaging examinations of the spine in patients with ankylosing spondylitis, before and after successful therapy with infliximab: evaluation of a new scoring system. Arthr.Rheum., 2003,48,1126–1136.
5. Baraliakos X. Davis J., Tsuji W., Braun J. Magnetic resonance imaging examinations of the spine in patients with ankylosing spondylitis before and after therapy with the tumor necrosis factor-α receptor fusion protein etanercept. Arthr.Rheum., 2005,52,1216–1223.
6. Sieper J., Baraliakos X., Listing J. et al. Persistent reduction of spinal inflammation as assessed by magnetic resonance imaging in patients with ankylosingspondylitis after 2 yrs of treatment with the anti-tumour
6.necrosis factor agent infliximab. Rheumatology, 2005,44,1525–1530.
7. Braun J., Landewe R., Hermann K-G. et al. Major reduction in spinal inflammation in patients with ankylosing spondylitis after treatment with infliximab. Results of a multicenter, randomized, double-blind, placebo-controlled magnetic resonance imaging study. Arthr.Rheum., 2006,54,1646–1652.
8. Heuft-Dorenbosch L., Landewe R., Weijers R. et al. Combining information obtained from magnetic resonance imaging and conventional radiographs to detect sacroiliitis in patients with recent onset inflammatory back pain. Ann. Rheum. Dis., 2006,65,804–808.
9. Puhakka K. B., Jurik A. G., Schiottz-Christensen B. et al. Magnetic resonance imaging of sacroiliitis in early seronegativespondylarthropathy. Abnormalities correlated to clinical and laboratory findings. Rheumatology, 2004,43,234–237.
10. Brandt H. C., Spiller I., Song I-H. et al. Performance of referral recommendations in spondyloarthritis. Ann. Rheum. Dis., 2007, doi: 10.1136/ard.2006.068734.
11. Van der Linden S., Valkenburg H. A., Cats A. Modified New York criteria 1984 (Evaluation of diagnostic criteria for ankylosing spondylitis: a proposal for modification of the New York criteria). Arthr.Rheum.,1984,27,361–368.
12. Mirowitz S. A., Apicella P., Remus W. R., HammermanA. M. MR imaging of bone marrow lesions: relative conspicuousness on T1-weighted, fat-suppressed T2-weighted, and STIR images. Amer. J. Roentgenol., 1994,162,215–221.
13. Rudwaleit M., Schwarzlose S., Hilgert E. S. et al. Magnetic resonance imaging (MRI) in predicting a major clinical response to anti-TNF-treatment in ankylosing spondylitis. Ann. Rheum. Dis., 2007;doi: 10.1136/ard.2007.073098.
14. Sieper J., Braun J., Rudwaleit M. et al. AAnkylosingspondylitis: an overview. Ann. Rheum. Dis., 2002,61(suppl III),iii8–iii18.
15. Goh L., Suresh P., Gafoor A. et al. Disease activity in longstanding ankylosing spondylitis—a correlation of clinical and magnetic resonance imaging findings. Clin.Rheumatol., 2007;doi: 10.1007/s10067–007–0726–7.
16. Weber U., Pfirrmann C. W. A., Kissling R. O. et al. Whole body MR imaging in ankylosing spondylitis: a descriptive pilot study in patients with suspected early and active confirmed ankylosing spondylitis. BMC Musculoskeletal Disorders, 2007,8,20–27.
17. Crowther S. M., Lambert R. G. W., Dhillon S. S.,Maksymowych W. P. High frequency of inflammatory lesions in the posterior structures of the spine in patients with ankylosingspondylitis (AS): a systematic evaluation by MRI.ACR/ARHP Ann. Scien.Meeting, 2007, Presentation Number, 2019 (abstract).







