Введение
В настоящее время значительная часть болезней человека связана с ухудшением экологической обстановки. Ионы многих металлов, в том числе алюминия, содержащиеся в окружающей среде, способны накапливаться в организме человека, оказывая отрицательное воздействие. [1]
Нами разработана методика экстракционно-фотометрического определения алюминия (III) в водных средах, основанная на образовании экстрагируемого ионного ассоциата фторидного комплекса алюминия с бриллиантовым зеленым. [3]. Экстрагенты — толуол и толуол с добавкой ундецилового спирта. В качестве полярного сорастворителя использовали ундециловый спирт. При описании методики не приводятся количественные характеристики процесса экстракции указанного ионного ассоциата.
Цель настоящей работы заключалась в расчете количественных характеристик экстракции окрашенного ионного ассоциата, образованного гексафторидным комплексом алюминия и бриллиантовым зеленым, толуолом и толуолом с добавками ундецилового спирта. Аналогичные исследования применительно к экстракционно-фотометрическому определению ионов алюминия в литературе отсутствуют.
Определение основано на измерении оптической плотности экстракта ионного ассоциата фторидного комплекса алюминия (III) с бриллиантовым зеленым.
Экспериментальная часть
Определение количественных характеристик экстракции
На основании экспериментальных данных были рассчитаны коэффициенты распределения, константа устойчивости, коэффициент концентрирования и степень извлечения из водной фазы ионного ассоциата [AlF4]-BrZ+ толуолом и толуолом с добавкой ундецилового спирта. [4]
Для нахождения коэффициента распределения и определения степени извлечения ионного ассоциата [AlF4]-BrZ+ использован метод последовательного экстрагирования. [5]
Построены графики зависимости оптической плотности экстракта от числа экстракций для обоих экстрагентов.Результаты представлены на Рисунке 1.
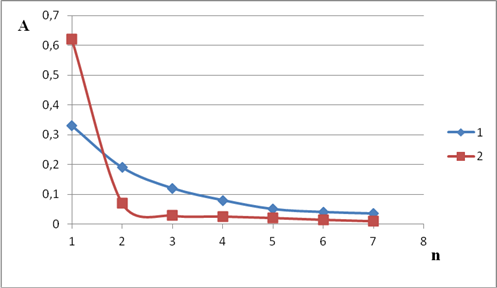
Рис. 1. Зависимость оптической плотности от числа экстракций (n) (С(Al3+)=0,18 мг/л, l=1 см); при использовании различных экстрагентов: 1 — толуол; 2 — толуол + ундециловый спирт.
Из Рисунка 1 можно сделать вывод о том, что добавление небольшого количества спирта приводит к увеличению оптической плотности экстракта и, следовательно, коэффициента распределения.
Расчет коэффициента распределения D и степени извлечения Е, % проводился по формулам:
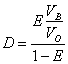
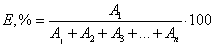 , где
, где
А1, А2, А3,..., Аn — значения оптической плотности экстракта ионного ассоциата после первой, второй, третьей,..., n-ой экстракции соответственно.
VB, VO — объемы водной и органической фаз.
Значения коэффициентов распределения (D) и степени извлечения (Е, %) ионного ассоциата [AlF4]-BrZ+из водной фазы толуолом с добавкой ундецилового спирта из водной фазы для растворов с различной концентрацией алюминия представлены в Таблице 1. Указанные характеристики экстракции остаются постоянными при изменении концентрации алюминия (III) в растворе.
Таблица 1
Коэффициенты распределения (D) и степени извлечения (Е, %) ионного ассоциата [AlF4]-BrZ+ из водной фазы толуолом и толуолом с добавкой ундецилового спирта из водной фазы при различных концентрациях Al(III) в растворе.
|
СAl, мг/л |
D |
E, % |
||
|
Без добавки |
С добавкой ундецилового спирта |
Без добавки |
С добавкой ундецилового спирта |
|
|
0,05 |
58±3 |
67±3 |
74±5 |
86±5 |
|
0,1 |
61±3 |
68±3 |
76±5 |
87±5 |
|
0,2 |
62±3 |
68±3 |
79±5 |
88±5 |
|
0,3 |
58±3 |
67±3 |
77±5 |
87±5 |
При использовании смешанного экстрагента достигнуто более полное извлечения ионного ассоциата из водной фазы, поэтому добавление ундецилового спирта увеличивает чувствительность определения и уменьшает погрешность.
Экстракцию в рассматриваемой системе можно характеризовать константой экстракции Kex:
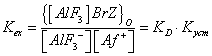 , где
, где
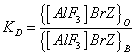 - константа распределения ионного ассоциата,
- константа распределения ионного ассоциата,
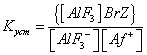 — константа устойчивости ионного ассоциата.
— константа устойчивости ионного ассоциата.
Так как величина коэффициента распределения (D) не изменяется при изменении концентрации алюминия (III), можно считать его равным константе распределения KD. Значение константы экстракции Kexрассчитывали, используя метод Бента-Френча. Следовательно Куст =Кex/D.
В Таблице 2 представлены значения Kex, Kуст для ионного ассоциата алюминия при нескольких концентраций алюминия (III).
Таблица 2
Значения Куст, Кexдля ионного ассоциата алюминия при нескольких концентрациях алюминия (III).
|
СAl, мг/л |
Куст |
Кex |
Состав ионного ассоциата |
|||
|
Без добавки |
С добавкой ундецилового спирта |
Без добавки |
С добавкой ундецилового спирта |
|||
|
0,05 |
(5,0±0,3)·102 |
(6,5±0,4)·102 |
(3,8±0,4)·102 |
(4,4±0,4)·102 |
1:1 |
1:1 |
|
0,1 |
(4,8±0,3)·102 |
(6,2±0,4)·102 |
(3,6±0,4)·102 |
(4,2±0,4)·102 |
1:1 |
1:1 |
|
0,2 |
(5,3±0,3)·102 |
(6,4±0,4)·102 |
(3,7±0,4)·102 |
(4,3±0,4)·102 |
1:1 |
1:1 |
|
0,3 |
(5,5±0,3)·102 |
(6,9±0,4)·102 |
(3,9±0,4)·102 |
(4,6±0,4)·102 |
1:1 |
1:1 |
Как следует из данных Таблицы 2, состав образующегося ионного ассоциата и значение константы устойчивости остаются постоянными в указанном диапазоне концентраций алюминия (III). Причем ионные ассоциаты, извлекаемые из водной фазы с использованием в качестве экстрагента толуола с добавкой ундецилового спирта более устойчивы, по сравнению с ионными ассоциатами, полученными с использованием в качестве экстрагента толуола.
Из представленных результатов следует, что образующийся ионный ассоциат обладает достаточной устойчивостью. Времени, в течении которого оптическая плотность остается постоянной, достаточно для проведения анализа.
Заключение
Рассчитаны количественные характеристики экстракции окрашенного ионного ассоциата, образованного гексафторидным комплексом алюминия и бриллиантовым зеленым, толуолом и толуолом с добавками ундецилового спирта.
Определены коэффициенты распределения, константа устойчивости, коэффициент концентрирования и степень извлечения ионного ассоциата [AlF4]-BrZ+ экстрагентами из водной фазы.
Установлено, что методика определения алюминия, в которой в качестве экстрагента используется толуол с добавкой ундецилового спирта, дает лучшие результаты.
Из представленных результатов следует, что образующийся ионный ассоциат обладает достаточной устойчивостью, а методика характеризуется хорошей воспроизводимостью и точностью результатов анализа.
Литература:
1. Давыдова С. Л. О токсичности ионов металлов. М.: Наука, 1991. — 31 с.
2. Кутырева И. А., Калугин А. А., Зорин А. Д., Занозина В. Ф. Вестник Нижегородского университета им. Н. И. Лобачевского, 1 (1), 2012. — 318 с.
3. Козырева А. Ю., Калугин А. А. Ежемесячный научный журнал «Молодой ученый», № 12 (59) / 2013. — 209 с.
4. Умланд Ф. и др. Комплексные соединения в аналитической химии: теория и практика применения. М.: Мир, 1975. — 536 с.
5. Булатов М. И., Калинкин И. П. Практическое руководство по фотометрическим методам анализа. — 5-е изд., перераб. — Л.: Химия, 1986. — 432 с.







