Введение:
Острый панкреатит (ОП) — одна из нерешенных проблем ургентной абдоминальной хирургии. По данным разных авторов больные ОП составляют 5–20 % от общего числа пациентов хирургического профиля. У 15–20 % больных ОП развивается панкреонекроз (ПН) [1, 4].
Нарушения микроциркуляции — ключевые факторы патогенеза ОП [2], которые во многом определяют объем некроза железы, что в свою очередь влияет на тяжесть заболевания и прогноз [7]. В процессе выполнения оперативного вмешательства хирургом проводится субъективная верификация объема некроза. Для объективизации результатов дифференцировки некротизированных тканей и исследования микроциркуляции представляется актуальным использование методов количественной оценки перфузии, основанных на различных физических принципах.
Есть работы, доказывающие обоснованность применения для изучения перфузии поджелудочной железы (ПЖ) лазерной допплеровской флоуметрии (ЛДФ), компьютерной томографии (КТ) с болюсным контрастным усилением [6]. Нет сообщений о результатах использования лазерной спектроскопии (оптической биопсии) для оценки органной микроциркуляции при ОП.
Цель исследования:
Улучшить результаты лечения больных острым деструктивным панкреатитом.
Задачи исследования:
1. Исследовать диагностические возможности метода лазер-индуцированной флуоресцентной спектроскопии на модели очагового панкреонекроза.
2. Изучить динамику микроциркуляторных нарушений после моделирования очагового панкреонекроза, методами лазерной флуоресцентной спектроскопии.
3. Разработка экспресс-метода интраоперационной оценки тяжести ОП и распространенности деструктивного процесса в железе.
Материалы и методы:
Работа выполнена в научно-образовательном центре «Хирургия» КрасГМУ на кафедре хирургических болезней им. проф. А. М. Дыхно с курсом эндоскопии и эндохирургии ПО. Экспериментальные исследования выполнены на базе Института молекулярной медицины и патобиохимии КрасГМУ.
Работа носит экспериментальный характер, выполнена на беспородных кроликах-самцах (n=10). В эксперименте были определены референсные показатели микроциркуляции, измеренные с помощью лазер-индуцированной флуоресцентной спектроскопии здоровой и некротизированной ткани ПЖ.
Общая анестезия животных обеспечивалась внутрибрюшным введением 1 % раствора тиопентала натрия в дозе 70 мг на 1 кг массы тела животного. Хирургическая стадия наркоза наступала через 5–10 минут после введения препарата.
После выполнения лапаротомии,врану выводили желудок, тонкую кишку и ПЖ, далее проводился выбор оптимального участка железы с максимально гомогенным распределением железистой ткани и с отсутствием крупных сосудов в исследуемой зоне. После выбора оптимального участка, ПЖ прошивалась в четырех точках нитью PDS 3/0 и бралась на лигатуры. Для перемещения и фиксации диагностического зонда над поверхностью ПЖ нами использовалась стереотаксическая рамка SR-6R, инструментальные кронштейны которой были развернуты наружу рамки. Там же производилось крепление шпателя с помощью дополнительных кронштейнов под прямым углом к стереотаксической рамке (рис.1).

Рис. 1. Стереотаксическая рамка, подготовленная к эксперименту
Перед моделированием ПН выполнялись контрольные измерения интенсивности аутофлуоресценции на прямоугольной области размером X*Y=5*10 мм выбранного участка железы. Измерения производились с шагом 1 мм в обоих в направления вдоль сторон прямоугольника (всего 50 точек).
Для записи спектров флуоресценции использовался бесконтактный метод: оптический зонд устанавливался над участком исследуемой ткани и оставался неподвижным в течение периода записи спектра над каждой зоной, экспозиция составляла около 220 сек. Спектры флуоресценции записывались in situ в диапазоне 390‑590 нм с шагом в 10 нм.
Для возбуждения аутофлуоресценции ткани использовалось излучение УФ импульсного лазера на молекулярном азоте (337,1 нм) с линией магнитного сжатия в цепи возбуждения. Частота повторения импульсов лазерного излучения составила 500 Гц, энергия импульса — 50 мкДж.
Моделирование деструктивного панкреатита в эксперименте осуществляли с помощью термокоагуляции ПЖ. Для этой модели характерна высокая выживаемость животных, в связи, с чем возможно исследование динамики патологических процессов после альтерации. Предварительный нагрев коагулятора осуществлялся в воздушном стерилизаторе ГП-20–3 по стандартной программе в течение 45 минут при температуре 120 °С. Далее выполнялась контактная коагуляция, со временем экспозиции 10 сек., вызывающая некроз ткани железы, без ее обугливания. Далее поверхность ткани охлаждалась физиологическим раствором.
Спонтанная аутофлуоресценция ткани ПЖ регистрировалась in situ в зоне некроза и здоровой ткани, с помощью экспериментального лазерного спектрофлуориметра с оптоволоконной доставкой излучения.
После завершения измерений с помощью лазер-индуцированной флуоресцентной спектроскопии животное выводилось из эксперимента. Путем внутривенной струйной инфузии троекратной разовой дозы тиопентала натрия, после остановки сердца осуществлялся забор органов и тканей для гистологического исследования ткани ПЖ.
Для подтверждения модели очагового ПН производили забор ткани ПЖ и выполняли гистологическое исследование препаратов.
При микроскопическом исследовании в зоне повреждения ПЖ имелись признаки острого геморрагического ПН. Отмечались очаги некроза паренхимы (экзокринной и эндокринной) (рис.2) и стромы, с выраженной перифокальной инфильтрацией нейтрофильными гранулоцитами (рис. 3), а также — жировой клетчатки, окружающей железу, с геморрагическим пропитыванием (рис. 4).



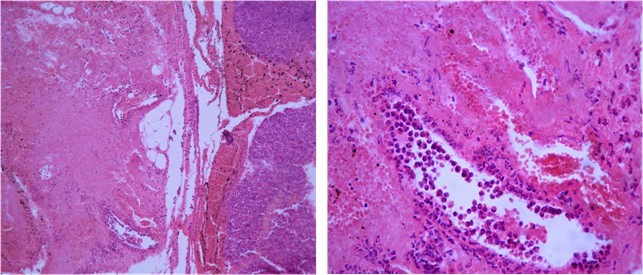
Рис. 2. Очаговый ПН с выраженной перифокальной лейкоцитарной инфильтрацией. а — очаг некроза паренхимы и стромы (указан стрелками) х100; б — нарушения кровообращения, лейкоцитарная инфильтрация х400. Окр. гематоксилином и эозином

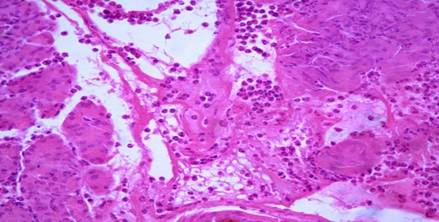
Рис. 3. Панкреонекроз. Очаг стеатонекроза (указан стрелкой). х400. Окр. гематоксилином и эозином

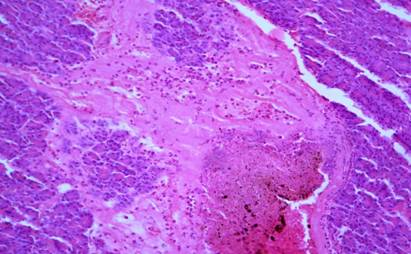
Рис. 4. Очаговый панкреонекроз. Острое воспаление с некрозами и кровоизлияниями (указаны стрелками), с сохранившимися остатками ацинусов ПЖ в зоне некроза. х400. Окр. гематоксилином и эозином
У животных были проведены контрольные измерения, определены показатели лазер-индуцированной флуоресцентной спектроскопии здоровой и некротизированной ткани ПЖ.
Полученные данные измерений лазерным спектрофлуориметром представлялись в виде двумерного массива, где I(i,j) i — определяет номер серии эксперимента, j — индекс длины волны. Обработка данных включала:
А) Нормировку, которая позволяла сравнивать спектры, полученные в разных сериях и устранять амплитудные искажения, вызванные различием расстояния от волоконного датчика до объекта. Нормировка осуществлялась делением значений интенсивности на разных участках спектра на среднее значение интенсивности, полученное по всему спектру.
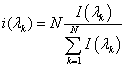
Нормированные на среднее значение спектры разносились на соответствующие для некроза и интактной ткани.
Б) Вычисление средних нормированных спектров для зоны некроза и интактной ткани поджелудочной железы.
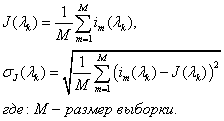
В) Нахождение нормированного разностного спектра
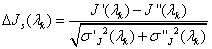
Нормированный разностный спектр позволяет выявлять наиболее значимо отличающиеся участки спектров в исследуемых выборках. В качестве этих участков выбирались длины волн, соответствующие максимумам и минимумам нормированного разностного спектра. Критерием значимости выбиралось превышение амплитуды нормированного разностного спектра на величину, большую или равную единице, что соответствовало различию между спектрами на выбранном интервале на величину, превышающую стандартное отклонение σ.
На рисунке 5. представлены нормированные спектры флуоресценции некротизированной и интактной ткани ПЖ при возбуждении УФ лазерным излучением с длиной волны 337,1 нм.
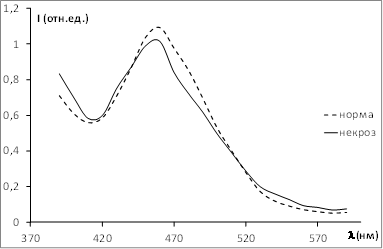
Рис. 5. Нормированные спектры лазер-индуцированной аутофлуоресценции ПЖ для интактной паренхимы и очага некроза
Характерный пик люминесценции на длине волны 465–470 нм обусловлен люминесценцией НАД(Ф)Н, являющимся основным тканевым флуорофором при ультрафиолетовом облучении.
Положение наиболее выраженных пиков разностного спектра — минимум на длине волны 470 нм, который соответствует пику люминесценции НАД(Ф)Н, максимум на длине волны 540 нм, который соответствует пику b — полосы оксигемоглобина (рис. 6).
Менее выраженный пик в области 410–430 нм может быть также приписан пикам полос Соре окси- и дезоксиформ гемоглобина. Таким образом, на фоне общего снижения интенсивности аутофлуоресценции, вызванного уменьшением пула НАД(Ф)Н, происходит снижение самопоглощения излучения флуоресценции на пиках полос окси- и дезоксиформ гемоглобина, что, очевидно, вызвано локальными нарушениями микроциркуляции.
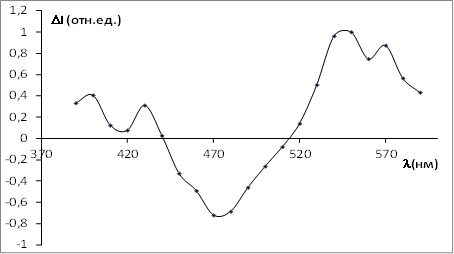
Рис. 6. Нормированный разностный спектр ткани поджелудочной железы для интактной паренхимы и очага некроза
Мы полагаем, что развитие некроза ткани ПЖ ассоциировано со снижением флуоресценции НАД(Ф)Н вследствие его свободно-радикального окисления в условиях нарастающего окислительного стресса и нарушения регенерации пиридиновых нуклеотидов из-за развившейся в ткани энергетической катастрофы, обусловленной деполяризацией мембран митохондрий и истощением АТФ, чему способствует гипоксия, обусловленная микроциркуляторными изменениями. В исследовании использовалось отношение интенсивностей люминесценции на длинах волн 540 и 470 нм для получения спектрального критерия, позволяющего дифференцировать здоровую и некротическую ткань. В зоне некроза этот показатель составил 0,2±0,08, что достоверно (p<0,001) выше контрольного значения (0,127±0,04).
В исследовании для расчетов использовали спектральный критерий (спектральный метаболический индекс):
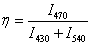 (4)
(4)
На рисунке 7 показано пространственное распределение вдоль оси, перпендикулярной зоне коагуляции, параметра h нормированного на интактное значение в периоде 1 и 12 часов после термокоагуляции.
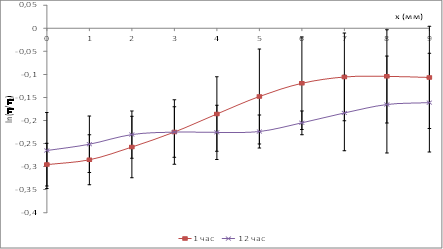
Рис. 7. Пространственное распределение спектрального метаболического индекса в различные периоды наблюдений после моделирования ОП
Как видно из приведенного рисунка указанный спектральный критерий позволяет достоверно выявить изменения в ткани ПЖ, как в зоне некроза, так и перифокальной зоне в отсроченном (12 часов) и в раннем периоде (1 час) после термокоагуляции.
Таким образом, применение спектрального критерия, основанного на отношении люминесценции на длинах волн 540, 470 и 430 нм позволяет достоверно дифференцировать здоровую и некротическую ткань ПЖ при экспериментальной панкреатите.
Выводы:
1. Метод лазер-индуцированной спектроскопии характеризуется высокими диагностическими возможностями в отношении верификации некроза поджелудочной железы. Пики интенсивности флуоресценции в интактной зоне и в зоне некроза на длинах волн 430 нм (полоса дезоксигемоглобина), 470 нм (полоса НАДН) и 540 нм (полоса оксигемоглобина) позволяют оценить метаболические изменения, возникающие при панкреонекрозе.
2. На основании полученных экспериментальных данных можно утверждать, что снижение интенсивности аутофлуоресценции ткани в зоне ПН по отношению к здоровой ткани является критерием для объективной оценки площади поражения ПЖ при ПН на ранних стадиях. Этот подход представляет интерес для разработки экспресс-метода интраоперационной оценки тяжести ОП и распространенности деструктивного процесса в железе.
Заключение:
На основании полученных экспериментальных данных, можно утверждать, что снижение интенсивности аутофлуоресценции ткани в некротизированной зоне по отношению к здоровой ткани ПЖ является критерием для объективной оценки объема поражения ПЖ после моделирования ПН. Информативность метода спектроскопии очень высокая. Применение спектрального критерия, основанного на люминесценции тканей на длинах волн 540 нм, 470 и 430 нм позволяющего дифференцировать здоровую и некротическую ткань ПЖ. В зоне некроза этот показатель составил 0,2±0,08, что достоверно (p<0,001) выше контрольного значения.
Лазерная спектроскопия позволяет объективно дифференцировать очаг некроза и здоровой ткани, а также выявляет объемные нарушения микроциркуляции в перифокальной зоне. В переходной зоне, несмотря на увеличение перфузии в тканях, происходят метаболические нарушения, которые способствуют распространению зоны некроза.
Литература:
1. Абдульянов, А. В. Диагностика и хирургическое лечение больных деструктивным панкреатитом / А. В. Абдульянов, А. З. Фаррахов, М. А. Бородин // Практ. медицина. — 2010. — № 47. — С. 30–37.
2. Александрова, Н. П. Реология крови и микроциркуляция в динамике острого панкреатита в эксперименте / Н. П. Александрова, Е. Б. Петухов, С. С. Рябова // Бюл. эксперим. биологии и медицины. — 1988. — № 1. — С. 106–108.
3. Берлиен, Х. П. Прикладная лазерная медицина / Х. П. Берлиен, Г. И. Мюллер. — М.: Интерэксперт, 1997. — 356 с.
4. Гульман, М. И. Исследование органного кровотока поджелудочной железы при экспериментальном панкреонекрозе / М. И. Гульман, Ю. С. Винник, Д. В. Черданцев // Применение лазерной допплеровской флоуметрии в медицинской практике: материалы Первого Всерос. симп. — М., 1996. — С. 27.
5. Саркисов, К. Г. Лазерная допплеровская флоуметрия как метод оценки состояния кровотока в микрососудах / К. Г. Саркисов, Г. В. Дуфак // Методология флоуметрии: сб. ст. — М., 1999. — С. 9–14
6. Тучин, В. В. Лазеры и волоконная оптика в биомедицинских исследованиях / В. В. Тучин. — М.: ФИЗМАТЛИТ, 2010. — 352 с
7. Фирсова, В. Г. Острый панкреатит: современные подходы к хирургическому лечению / В. Г. Фирсова, В. В. Паршиков // Вестн. эксперим. и клин. хирургии. — 2012. — № 4. — C. 715–721







