Исследования по выживанию микроорганизмов при замораживании показывают, что скорость замораживания и размораживания влияет на жизнеспособность дрожжей. Медленное замораживание дает возможность дрожжевым клеткам приспособиться к низкотемпературным условиям, за счет преобразования внутриклеточной воды во внеклеточный лед. Быстрое замораживание приводит к внутриклеточному замораживанию, поскольку изменения температуры происходят быстрее, чем вода проходит сквозь клеточные мембраны [1, с. 152, 2, с. 30]. Возможно, предположить, что небольшие кристаллы льда, образующиеся в процессе внутриклеточного замораживания, трансформируются в большие кристаллы, вследствие вторичной кристаллизации в течение размораживания и повреждают дрожжевые клетки [3, с. 20].
Жизнеспособность дрожжевых клеток теряется под воздействием «влияния растворов», если охлаждение происходит со скоростью выше оптимальной, и/или внутриклеточного образования льда, если охлаждение происходит со скоростью ниже оптимальной. Скорость охлаждения оптимальна, если она не вызывает внутриклеточного образования льда, но при этом достаточно высока, чтобы сократить длительность, в течение которой дрожжевые клетки подвергаются воздействию растворов.
Концепция стеклования полезна при изучении способов увеличения срока годности пищевых продуктов, при их холодильном хранении. Применение криопротекторов снижает рост кристаллов льда и препятствует миграции молекул гидратной воды белков. Тg (температура стеклования) может быть полезным индикатором эффективности конкретных криопротекторов, например, моно- и дисахаридов, глицерина, сорбита, фосфатов, аскорбиновой кислоты, карбоксиметилцеллюлозы (КМЦ), камедей и трегалозы. К криозащитным белковым механизмам пищевых продуктов относятся:
- избирательное исключение криопротектора из белкового продукта. Согласно этой теории, присутствие криопротектора увеличивает химический потенциал и белка, и криопротектора, в результате чего, белок становится более стойким к диссоциации и денатурации, которые увеличивают термодинамически неблагоприятную площадь поверхности контакта между белком и криопротектором;
- избирательная гидратация молекул белка, через функциональные ‑ОН или ионо-генные группы; при этом уменьшается количество воды, теряемой белком при замораживании;
- пониженная мобильность молекул воды в окружающей белок незамороженной фазе, благодаря повышению вязкости и переходу в стеклообразное состояние.
В рамках традиционных технологий холодильного хранения, жизнеспособность дрожжевых клеток обеспечивается за счет добавления специальных криопротекторов. Многие из них представляют собой вещество с относительно небольшими молекулами, которые легко проникают сквозь клеточные мембраны [4, c. 254].
В качестве криопротекторов используются фруктоза и сорбит, однако недостатком их использования, является сладковатый вкус хлеба, который может быть нежелательным для потребителя. Нами был выбран криопротектор пониженной сладости — пектин.
Результаты исследования, методом микроскопирования, показали, что криопротекторы по-разному влияют на связывающую способность воды в клетке, в связи, с чем тесто имеет различные физические свойства.
На срезе из теста замороженного полуфабриката с расстойкой в течение 1 часа и без расстойки были отмечены явные различия [5, c. 68].
В размороженном образце, при расстойке теста, наблюдались различия в контрольном образце и образцах с пектином, сорбитом и фруктозой рисунок 1.
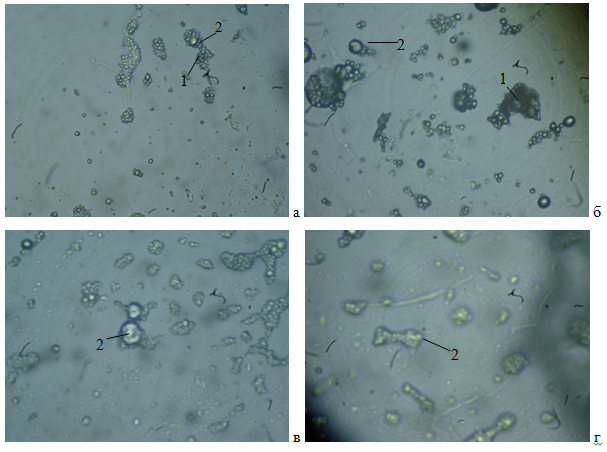
Рис. 1. Микрофотографии замороженного дрожжевого теста с расстойкой в течение часа: а) контроль; б) добавление пектина; в) добавление сорбита; г) добавление фруктозы (1 — белок, 2 — крахмальные зерна)
В образце без добавления криопротектора полимерные цепи крахмала и белка, представляют собой сжатую уплотненную структуру. При добавлении пектина во время замеса теста, на срезе образца явно видно увеличение полимерных цепей за счет образования белково-полисахаридных комплексов, на стеклование полимерной цепи влияют количество и размер замещающих групп. В случае присоединения пектина к полимерным цепям белка и крахмала, его боковые цепи выступают в роли пластификатора и понижают температуру стеклования. Такой же механизм влияния на температуру стеклования отмечен и в случае добавления сорбита и фруктозы, но менее выражен. Полученные результаты позволяют сделать вывод, что добавление криопротекторов приводит к образованию белково-полисахаридных комплексов, позволяющих снизить температуру стеклования.
Другим фактором, влияющим на температуру стеклования, является молекулярная масса полимера. Увеличение молекулярной массы полимера снижает температуру стеклования. В наших исследованиях добавление криопротекторов, увеличивает молекулярную массу полимеров и это тоже является положительным фактором при замораживании тестовых полуфабрикатов [6, c. 93, 7, c. 93].
Лучший результат при проведении данного эксперимента, был получен в варианте с применением пектина.
При замораживании тестовых заготовок после замеса теста, были также получены результаты, показывающие связывающую способность пектина и других криопротекторов. Фотографии микроскопирования срезов теста: контрольный образец без криопротектора, с пектином, сорбитом и фруктозой представлены на рисунке 2.
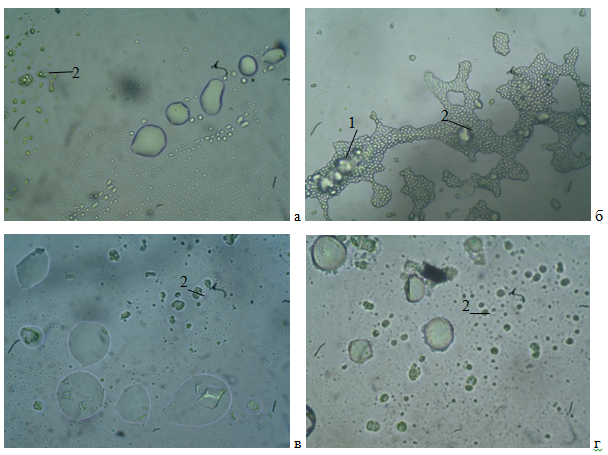
Рис. 2. Микрофотографии замороженного дрожжевого теста без расстойки: а) контроль; б) добавление пектина; в) добавление сорбита; г) добавлением фруктозы (1 — белок, 2 — крахмальные зерна)
Из рисунка 2 видно, что и в этом случае пектин обладал наибольшей связывающей и комплексообразующей способностью с образованием белково-полисахаридных комплексов. При добавлении сорбита и фруктозы, в этом эксперименте полимерные цепи были значительно меньше, по сравнению с образцом, где был добавлен пектин. Такой результат можно объяснить меньшей водопоглотительной способностью сорбита и фруктозы.
Таким образом, можно сделать заключение, что добавление пектина при замесе теста предназначенного для замораживания, позволяет снизить температуру стеклования, за счет увеличения молекулярной массы полимера, образовывая белково-полисахаридные комплексы, кроме того, боковые цепи пектина в разветвленной структуре полимера выступают в роли пластификатора и дополнительно понижают температуру стеклования.
Литература:
1. Бебко, Д. А. Применение инновационных энергосберегающих технологий / Д. А. Бебко, А. И. Решетняк, А. А. Нестеренко. — Германия: Palmarium Academic Pudlishing, 2014. — 237 с.
2. Нестеренко, А.А., Решетняк, А.И., Потокина, Ю.В., Потрясов, Н.В. Использование пектина в производстве мясопродуктов / А. А. Нестеренко, А. И. Решетняк, Ю. В. Потокина, Н. В. Потрясов // Вестник НГИЭИ. — 2012. № 8. — С. 30–36.
3. Кенийз, Н.В., Сокол, Н. В. Разработка технологии хлебобулочных полуфабрикатов с применением криопротектора / Н. В. Кенийз, Н. В. Сокол // Новые технологии. — 2013. — № 1. — С. 19–24
4. Kenijz, N.V., Sokol, N. V. Pectic substances and their functional role in bread-making from frozen semi-finished products / N. V. Kenijz, N. V. Sokol // European Online Journal of Natural and Social Sciences. — 2013. — Т. 2. № 2. — С. 253- 261
5. Кенийз, Н.В. Влияние пектина как криопротектора на водопоглотительную способность теста и дрожжевые клетки / Н. В. Кенийз // Вестник Казанского государственного аграрного университета. — 2013. — Т. 3. № 29. — С. 67–69.
6. Кенийз, Н.В., Сокол, Н.В. Влияние дефростации в технологии хлеба из замороженных полуфабрикатов на качество готового продукта / Н. В. Кенийз, Н. В. Сокол // Вестник НГИЭИ. — 2011. — Т. 2. № 2 (3). — С. 92–101.
7. Кенийз, Н.В., Сокол, Н.В. Технология производства хлеба из замороженных полуфабрикатов с использованием пектина в качестве криопротектора / Н. В. Кенийз, Н. В. Сокол // Вестник Мичуринского государственного аграрного университета. — 2011. № 2–2. — С. 92–94.







