Ключевые слова непереносимость к металлическим протезам, микроэлементы в слизистой оболочке полости рта, атомно-абсорбционная спектрометрия.
Актуальность проблемы
Значительная распространенность и тенденция к росту числа пациентов с непереносимостью к металлам зубных протезов, а также увеличение частоты токсического воздействия смесей конструкционных металлов на ткани полости рта и организм в целом, определяют актуальность данной проблемы (Онищенко В. С.1993, Павленко О. В., Тимофеев А. А. 2003, Кордияк А. Ю. 2008). Выявлено, что с увеличением количества ортопедических конструкций в полости рта, в ротовой жидкости увеличивается количество ионов металлов, которые могут иметь патологическое воздействие на организм пациента, который носит протезы (Karov.J., Hinberg J., 2001, Sutow E. J., Mailet W. A. 2004). По данным ученых выраженность отрицательного влияния зависит от срока нахождения протезов в полости рта (Fovet Y., 2000, Taher N. M.2003).
Сплавы металлов, которые используются в современной ортопедической практике имеют большое количество положительных свойств, но вместе с тем у них присутствует ряд существенных недостатков: химическая нестабильность в жидкой среде полости рта; комбинация металлов и неметаллических примесей в дентальных сплавах, которая направлена на улучшение литейных, антикоррозионных, прочностных и ценовых качеств, изменяет, в основном, стандартный потенциал и пассивационные свойства основного металла. Это приводит к гальванической коррозии макроэлементов. К тому же, разность потенциалов на поверхности каждого металла, возникающая в результате химической неоднородности, шероховатости поверхности, неравномерного деформированного уплотнения отливки, двух — и более фазовых структур, наличия границ зерен в однофазной структуре приводит к гальванической коррозии микроэлементов.
Таким образом коррозионные процессы приводят к тому, что компоненты сплавов металлов служат источником поступления в организм пациента.
Итак, ротовая жидкость, являясь сложным раствором электролитов и неэлектролитов [1,2], подчиняется законам электрохимии, согласно которым является проводником второго рода [1,3], носителем электрического заряда в котором есть ионы [1,3]. При контакте с проводником первого рода (металл), происходят электрохимические процессы (электроны металлов вступают во взаимодействие с ионами растворов) с образованием химического источника электрической энергии [3]. Следствием таких электрохимических процессов является выделение продуктов электролиза сплавов металлов в РЖ [1, 5, 6, 8, 9], что ведет к изменению соотношения микроэлементов в полости рта [7]. Ионы железа, никеля, хрома, золота, серебра, кобальта, палладия, ртути, которые попали в слюну в результате коррозионных процессов, способны замещать ионы металлов в ферментах слюны и других белковых системах.
Стоматологические сплавы состоят из элементов, которые под действием коррозионных процессов, происходящих в ротовой полости, выходят в нее в виде ионов. К большинству стоматологических сплавов, используемых в ортопедической стоматологии, принадлежат следующие элементы: Co, Cr, Ni, Cu, Zn, Mo, Fe. Известно, что эти металлы относятся к группе «тяжелых металлов». Данные металлы принимают активное участие в биологических процессах, входят в состав многих ферментов [11]. Согласно классификации Н. Реймерса, к группе тяжелых металлов относят те, которые имеют плотность 8 г/см3.
За сутки человек глотает 1.5 литра слюны, вместе с которыми заглатываются те микроэлементы, которые вымываются из сплавов. Вследствие этого постепенно растут дозы микроэлементов в биологических жидкостях — ротовой жидкости, мягких тканях ротовой полости, крови, мочи. [9,11]. Попав в организм человека, токсичные металлы распределяются в нем неравномерно.
Так как ионы металлов, которые входят в состав стоматологических сплавов имеют свойство накапливаться в организме пациента, который носит протезы, то актуальным остается определение уровня накопления ионов металлов в мягких тканях, которые прилегают к искусственным коронкам.
Материалы и методы исследования:
Для решения поставленных задач были использованы данные литературы, комплекс клинико-лабораторных и специальных методов исследований. Клинические, специальные исследования пациентов проводились в стоматологическом медицинском центре НМУ имени акад. А. А. Богомольца. Исследования микроэлементного состава ротовой жидкости проводились на атомно-абсорбционном спектрофотометре Perkin Elmer 3110 с атомизацией в пламени. Согласно цели нашего исследования было обследовано 28 пациентов, которые были разделены на две исследовательские группы. В I группу (основная группа) 20 человек вошли пациенты, которые имели жалобы на непереносимость к металлам зубных протезов. Во II группу (контрольная группа) вошли пациенты 8 человек, которые не имели жалоб и клиническую картину непереносимости. Пациенты всех исследовательских групп были распределены по возрасту и полу. (Таб. 1)
Таблица 1
Распределение пациентов исследуемой группы в зависимости от возраста и пола
|
Пол |
|||
|
Возраст |
40–50 |
50–60 |
|
|
Мужчины |
(n) |
3 |
5 |
|
% |
15 |
25 |
|
|
Женщины |
(n) |
4 |
8 |
|
% |
20 |
40 |
|
|
Всего: |
(n) |
7 |
13 |
|
% |
35 |
65 |
|
Как мы можем видеть из данной таблицы, подавляющий процент пациентов с синдромом непереносимости к металлам зубных протезов были женщины (60 %).
Для выявления зависимости между микроэлементным составом в мягких тканях и материалом, из которого были изготовлены протезы, исследуемая группа была распределена на подгруппы:
1 подгруппа состояла из 7 пациентов (из них 3 мужчины и 4 женщины), которые имели в ротовой полости штамповано-паяные конструкции, изготовленные из нержавеющей стали.
2 подгруппа состояла из 6 пациентов (из них 2 мужчины и 4 женщины), которые имели в ротовой полости цельнолитые мостовидные протезы облицованы пластмассой, которые были изготовлены из кобальто-хромового сплава.
3 подгруппа состояла из 7 пациентов (из них 3 мужчины и 3 женщины) которые имели в ротовой полости цельнолитые мостовидные протезы облицованы керамикой, которые были изготовлены из кобальт-хромового сплава.
Так же в наше исследование вошла 1 пациентка, у которой в полости рта была коронка на основе диоксида циркония.
Данное исследование проводилось по четкому алгоритму. После сбора анамнеза и заполнения медицинской документации у пациента было получено согласие на проведение оперативного вмешательства с целью получения части мягких тканей для дальнейшего изучения микроэлементного состава. В большинстве случаев часть материала бралась в области прилегающего протеза с небной стороны, или при удалении зубов забирались части десен, непосредственно прилегающие к металлическим протезам. Данный материал помещался в пробирку с формалином и передавался в лабораторию для дальнейшего изучения. Анализ проводили на атомно-абсорбционном спектрофотометре Perkin Elmer 3110 с атомизацией в пламени.
Забор материала всегда проводился под инъекционным обезболиванием, после чего пациенту были даны рекомендации по уходу за раной.
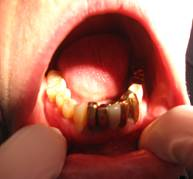
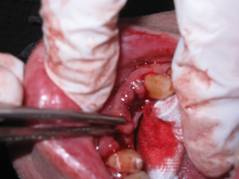
При сборе анамнеза большое внимание уделялось жалобам. Среди всех жалоб наиболее распространенными были отмечены такие как: изменение вкусовой чувствительности и боль слизистой оболочки полости рта (СОПР), которая наблюдалась почти у 9 % случаев, металлический и кислый привкус у 12.48 %, жжение СОПР у 1.56 %, ощущение прохождения тока у 11 % случаев, изменение вкусовой чувствительности у 7 % и сухость полости рта почти у 6 %. Из приведенных данных следует, что наиболее выраженная клиническая картина наблюдалась у женщин.
Таблица 2
|
Жалобы |
Мужчины |
Женщины |
Всего: |
|||
|
n |
% |
N |
% |
N |
% |
|
|
Жжение СОПР |
1 |
0,78 |
1 |
0,78 |
2 |
1,56 |
|
Изменение вкусовой чувствительности |
3 |
2,34 |
11 |
8,58 |
14 |
10,92 |
|
Металлический и кислый привкус |
5 |
3,9 |
11 |
8,58 |
16 |
12,48 |
|
Сухость во рту |
2 |
1,56 |
5 |
3,9 |
7 |
5,46 |
|
Повышенное слюноотделение |
1 |
0,78 |
2 |
1,56 |
3 |
2,34 |
|
Повышенная усталость |
3 |
2,34 |
3 |
2,34 |
6 |
4,68 |
|
Бессонница |
3 |
2,34 |
3 |
2,34 |
5 |
4,68 |
|
Ощущение прохождения тока |
5 |
3,9 |
9 |
7,02 |
14 |
10,92 |
|
Боль в СОПР |
3 |
2,34 |
8 |
6,24 |
11 |
8,58 |
При сборе анамнеза обращали внимание на сроки возникновения проявлений непереносимости к МЗП после протезирования.
По данным нашего исследования у 25 % пациентов первые проявления непереносимости наблюдались от 1 до 6 месяцев после установки металлических зубных протезов. 55 % пациентов отмечали возникновения проявлений сразу после установки зубных протезов. И 20 % пациентов наблюдали возникновение типичных симптомов через 6 мес. Таб. 3.
Таблица 3
Распределение пациентов по срокам появления первых клинических симптомов невосприятия МЗП
|
Срок пользования металлическими протезами |
Женщины |
Мужчины |
||
|
(n) |
(%) |
(n) |
(%) |
|
|
Сразу после установки |
5 |
25 |
- |
- |
|
Один месяц — шесть месяцев |
6 |
30 |
5 |
25 |
|
Более шести месяцев |
1 |
5 |
3 |
15 |
Обращает внимание то, что большинство коронок (46 единиц) и мостовидных протезов (14 протезов) были изготовлены из стали с нитрид-титановым покрытием, что составило 44.23 % от общего количества единиц МЗП. Цельнолитых облицованных керамикой 33 единицы, что составило 29.2 %. Цельнолитых облицованных пластмассой 28 единиц, или 24.7 %, керамических реставраций на основе диоксид циркония — 1.76 % Таб. 4.
Таблица 4
Характеристика распределения единиц несъемных металлических конструкций пациентов исследуемой группы
Тип сплава |
Исследуемая группа |
||
|
(n) |
% |
||
|
Протезы |
Штамповано-паяные мостовидные из стали |
4 |
3,53 |
|
Штамповано-паяные мостовидные из стали с нитрид-титановым покрытием |
46 |
40,7 |
|
|
Цельнолитые с пластмассовой облицовкой |
28 |
24,77 |
|
|
Цельнолитые с керамической облицовкой |
33 |
29,2 |
|
|
Керамические реставрации на основе диоксид циркония |
2 |
1,76 |
|
|
Всего |
113 |
100 |
|
Подавляющее число осмотренных МВ были с дефектами в виде пор раковин — штамповано-паяные мостовидные протезы. Приведенные нами данные их осмотра подчеркивают конструктивные недостатки этих протезов, которые предварительно заложены в технологии их изготовления — соединение между собой двух разнородных сплавов металлов с помощью многокомпонентного третьего — припоя.
Результаты исследования.
Проанализировав данные нашего исследования было выявлено повышение концентрации микроэлементов в исследуемом материале, что подтверждает мнение многих ученых о диссоциации металлов МЗП в биологических средах. Данный факт, по нашему мнению, непосредственно влияет на развитие местных и общих патологических проявлений, связанных с использованием металлосодержащих зубных протезов. Анализируя данные концентраций микроэлементов по исследуемым группам можно сделать вывод, что в 1 подгруппе (пациенты, которые были запротезированы штамповано-паяными конструкциями) выявлено повышение концентрации железа, меди, никеля и цинка; это связано с тем, что эти элементы входят в состав припоя и, выходя в ротовую полость, приводят к повышению их концентрации в ротовой жидкости и дальнейшее накопление в слизистой оболочке ротовой полости. Анализируя данные 2 и 3 подгрупп выявленное нами повышение концентрации кобальта, хрома, никеля можно связать с выходом этих элементов из сплавов, которыми были запротезованы пациенты.
В данной таблице приведены результаты концентрации микроэлементов в мягких тканях ротовой полости пациентов исследуемых групп (в мкг / мл).
|
Co |
Cr |
Ni |
Fe |
Zn |
Cu |
|
|
1 группа |
1,48 |
1,37 |
10,29 |
617,8 |
18,87 |
23,75 |
|
2 группа |
0,4 |
1,91 |
10,96 |
134 |
4,178 |
3,34 |
|
3 группа |
0,92 |
0,17 |
3,5 |
122 |
2,46 |
2,47 |
|
Контрольная группа |
0,3 |
0,2 |
0,91 |
111 |
0,97 |
1,34 |
Данные сводной таблицы указывают на значительное повышение всех элементов, входящих в состав сплавов металлов, а именно по нашим данным в первой исследуемой (пациенты, у которых были штамповано-паяные конструкции) группе уровень кобальта был в 4.9 раз выше по сравнению с контрольной, хрома почти в 7 раз, никеля в 11 раз, железа в 6 раз, цинка в 18 и меди в 23 раза. Интересным фактом является то, что пациенты данной исследуемой группы пользовались несъемными конструкциями в течение 4–6 лет.
У пациентов второй исследуемой группы (у которых были цельнолитые облицованы пластмассой несъемные конструкции) наблюдалось повышение хрома в 10 раз, никеля в 11 раз, цинка в 4 и меди в 3 раза.
У пациентов третьей исследуемой группы (у которых были цельнолитые облицованы керамикой несъемные конструкции) наблюдалось повышение кобальта в 3 раза, никеля в 3.5 раза, цинка в 2 раза и меди в 2 раза.
Результаты нашего исследования подтверждают факт накопления ионов металлов в мягких тканях ротовой полости у пациентов с патологическими состояниями, которые обусловлены использованием металлосодержащих зубных протезов.
Литература:
1. Bergendal T., Isacsson G. A. Combined clinical, mycological and histological study of denture stomatitis // Acts Odontol. Scand. — 1983. — Vol.41, N1. — P.33–44
2. Бабина О. А. Бондаренко В. В., Гранько М. А. Источники активных форм кислорода в тканях ротовой полости в норме и патологии // Стоматология.1999.Т.78, № 5С.9–11
3. Stenberg T., Bergman B. Release and uptake of cobalt from cobalt-chromium alloy immplants// Acta odontol. Scand. — 1983. — Vol. 41, N3. –P. 149–154
4. Подорожная Р. П., Петрович Ю. А., Белоклицкая Г. Ф. Железо ротовой полости при воспалении пародонта //Вісник стоматології. — 1995. –№ 4. — С.244–248
5. Пырков С. Г., Погодин В. С., Подкин Ю. С. Клинические проявления аллергических реакций на металлические зубные протезы. — Свердловск, 1989. — 10с. — Деп. во ВНИИМИ. МЗ СССР. № 19067–89.)(58)
6. Грінішин А. В., Іваненко Ю. О., Луньяк К. Б. Продукція супероксиду при гострому стресі щурів //Актуальні проблеми експериментальної та клінічної медицини:Тез. доп. — Полтава. –2001. –С.47–51
7. Семенюк В. М., Вагнер В. Д., Онгоев П. А. Непереносимость материалов зубных протезов из нержавеющей стали и кобальт-хромового сплава. Реабилитация больных с явлениями непереносимости материалов зубных протезов // Стоматология ортопедическая в вопросах и ответах. –М.: Мед. книга, 2000. –С.100–107
8. Овруцкий Г. Д., Ульянов А. Д. Аллергия к хрому при пользовании зубными протезами из стали // Стоматология. — 1976. –№ 5. –С. (60–62.)
9. Адо А. Д., Адо М. А., Пыцкий В. И. Патологическая физиология. М.: Триада-Х, 2000. 574 с.
10. Тимофеев А. А. Особенности диагностики, клинического течения и лечения пациентов с металлическими включениями в полости рта / А. А. Тимофеев // Соврем. стоматология. — 2006. — № 1. — С. 106–110.
11. Тимофеев А. А. Этиологическая роль металлических включений ротовой полости в возникновении предопухолевых заболеваний и опухолей челюстно-лицевой области / А. А. Тимофеев, Е. В. Горобец // Соврем. стоматология. — 2003. — № 4. — С. 86–90.







