Показана возможность и оптимизированы условия амперометрического титрования Bi(III), Pd(II), Ag(I), Cu(II)вводных, смешанных и неводных средах. Разработанная амперометрическая методика определения Bi(III), Pd(II), Ag(I), Cu(II)оценены метрологически, результаты которых вполне пригодны для анализа различных по природе стандартных образцов, руд, минералов, хвостов и природных объектов.
Ключевые слова:амперометрия, электроды, ток, потенциал, металлы, буфер, реагент.
Введение. Важность Bi(III), Pd(II), Ag(I), Cu(II) металлов и в науке, технике, промышленности и народном хозяйстве огромна, поскольку они обладают уникальными свойствами и оригинальными характеристиками. Вследствие способности к адсорбции газов благородные металлы, главным образом палладий применяется в качестве специфичных катализаторов при гидрогенизации и окислении различных веществ. Каталитическая активность благородных металлов особенно увеличивается при использовании их черни.
В последнее время в амперометрическом титровании (АТ) в качестве титрующих реагентов широко применяются различные органические серосодержащие соединения, отвечающие общей формуле R-CS-NH2 (тиоамиды), нашедшие применение в быту, экологии и различных областях народного хозяйства, особенно в медицине, химии и парфюмерии. Как известно серосодержащие соединения специфичны к ионам различных металлов, поэтому важно получение новых органических комплексообразующих веществ, на основе доступных, импортзамещяющих и дешевых компонентов, обладающих рядом ценных аналитических свойств с целью их использования в качестве подходящих и селективных реагентов на ионы различных металлов, в особенности благородных элементов.
Из известных тиоамидов наиболее универсальным, доступным, дешевым и взаимодействующим почти со всеми металлами сероводородной группы и сернистого аммония, является тиоацетамид (ТАА).
Учитывая все преимущества и достоинства Bi(III), Pd(II), Ag(I), Cu(II) иих соединений, а также важность этих металлов в народном хозяйстве возникла необходимость установления их макро-, микро- и следовых концентраций в природных объектах и промышленных материалах, поскольку их микроколичества порою играют важную и определяющую роль в решении различных аналитических, медицинских, социальных, экологических, технических, народно-хозяйственных и других задач.
Теоретический анализ. Как известно, АТ представляет собой объемный метод анализа, в котором для индикации конечной точки титрования (КТТ) используется диффузионный ток, наблюдаемый на ртутно-капающем, вращающемся платиновом или другом твердом электроде. Благодаря экспрессности выполнения анализа, дешевизне, доступности и простоте аппаратурного оформления разработанные методики АТ вполне могут быть использованы для определения Bi(III), Pd(II), Ag(I), Cu(II) вразличных по природе объектах окружающей среды, в производственных и промышленных материалах в стационарных и полевых (портативных) условиях.
Методика эксперимента. Для проведения исследования было изучено влияние потенциала, подаваемого на индикаторные электроды (0,5–1,0 В), на форму кривых и результаты АТ титрования Bi(III), Pd(II), Ag(I), Cu(II) раствором ТАА, ТНЛД, РК и ДТЗ в уксусной кислоте. Как правило, концентрация реагенты на несколько порядков должна превышать количество определяемых металлов. Титрант прибавляют небольшими порциями прецизионной поршневой микробюреткой, благодаря чему разбавлением исследуемого раствора можно пренебречь.
Универсальные буферные смеси с необходимыми значениями рН среды готовили смешиванием 0,04 М растворов фосфорной, уксусной и борной кислот с 0,2 М NaOH различного объема [1].
0,1 М раствор ТАА, готовили растворением (1,829 г) навески свежеперекристаллизованного и хорошо высушенного препарата в 96 % этиловом спирте. Для титрования раствором ТАА пользовались поршневой микробюреткой на 2,0 мл, позволяющей дозировать титрант с точностью до 0,001 мл [2].
Эксперименты показали, что 0,005- 0,1 М растворы ТАА практически не изменяют своего титра (при условии их хранения в темноте и на холоду) в течение 10–15 сут.
Результаты и их обсуждение.
Влияние напряжения. На основании выявленных вольтамперных характеристик тиоацетамидом (ТАА), тионалидом (ТНЛД), рубеановодородной кислотой (РК) и дитизоном (ДТЗ) на платиновым дисковом микроаноде в присутствии различных фоновых электролитов в уксусной кислоте следует, что амперометрическую индикацию КТТ ионов различных металлов с двумя индикаторными электродами необходимо проводить при напряжении 0,50–0,65 В, 0,90–1,25 в и 0,50–0,85 В при титровании растворами ТАА, ТНЛД и РК соответственно в зависимости от природы применяемого фона. В случае использования ДТЗ на различных по природе фонах по возникающему анодному току титранта АТ следует проводить в диапазоне потенциалов 0,60–0,80 В и 0,75–0,95 В соответственно. При титровании более кислых растворов ионов исследуемых металлов потенциал необходимо повысить соответственно на 0,1–0,2 В. При проведении АТ ионов металлов с двумя индикаторными электродами минимальное напряжение на платиновых электродах должно быть 0,40 В, чтобы одновременно могли протекать окисление ДТЗ на аноде (Е мин. = 0,60 В) и восстановление кислорода на катоде (Емакс= 0,2В). Если же напряжение будет превышать минимальное значение на 0,2–0,3 В, то в случае титрования серебра (I) или меди (П) перед достижением КТТ будут одновременно протекать окисление дитизонатного комплекса на аноде и восстановление титруемых катионов на катоде. Тогда вместо _/ -образной кривой АТ получится кривая с максимумом на левой ветви (рис.1).
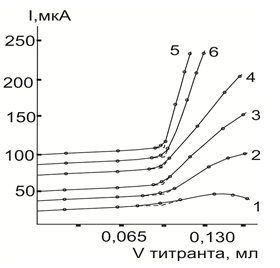
Рис. 1. Влияние напряжения на форму кривых АТ палладия (П) раствором ТАА на фоне 0,15 М по нитрату лития в уксусной кислоте. Величина напряжения, В: 1–0,10; 2- 0,30; 3- 0,50; 4- 0,70; 5- 0,90; 6- 1,1
Правильность этих предложений о возможности проведения АТ ионов металлов и о форме кривых титрования подтвердилось экспериментальными данными. Серебро (I), висмут (III) и медь (II) при прочих равных условиях титруются достаточно быстро и правильно с хорошей воспроизводимостью, при этом относительное стандартное отклонение не более 0,031.
Эксперименты показали, что при АТ ионов металлов в уксусной кислоте получаются комплексы составов Ме: Реагент=1:1 для одновалентных, 1:2- двухвалентных и 1:3 — трехвалентных металлов. Достаточно хорошо соблюдается пропорциональность между взятыми количеством металлов (Особенно это видно из результатов титрования ионов серебра) и затраченными объемами реагентов в т. э.
В серии опытов, поставленных с целью выявления характера влияния этого фактора на форму кривых и результаты АТ ионов металлов раствором ТАА исследования осуществляли при следующих оптимальных условиях: фон- 1015М нитрат лития, концентрация титранта -0,001М, объем анализируемого раствора — 10,0 мл, температура около 20 oC, растворитель- безводная уксусная кислота или другой протеолитический растворитель. Напряжение на индикаторных электродах изменяли в пределах 0,1–1,1 В ступенями в 02, В. Для каждого случая изучения величины напряжения титрование повторяли не менее 3–5 раз. Было показано, что изменение величины этого параметра на электродах в указанном диапазоне оказывает влияние на крутизну обеих ветвей кривой титрования и на длину ее прямолинейных участков, (рис.1), но в то же время практически не влияет на результаты АТ ионов исследуемых металлов.
Эксперименты показали, что среднее значение расхода титранта в КТТ, как и следовало ожидать, не зависит от величины подаваемого на индикаторные электроды напряжения. Однако при очень малых его значениях (менее 0,3В) правая ветвь кривой получается слишком пологой и быстро теряющей свою прямолинейность, приводящей к ухудшению воспроизводимости и правильности получаемых результатов.
При таком диапазоне значений напряжения индикаторный ток т. э. обусловлен восстановлением титруемых катионов на катоде и окислением следов воды на аноде. После прохождения КТТ диффузионный ток начинает возрастать за счет восстановления кислорода на катоде и окисления свободного титранта на аноде.
Было показано, что наилучшие по форме кривые АТ наблюдаются в диапазоне значений напряжения 0,50–0,75В (в зависимости от природы фона и титруемой среды) и выше. Но в силу того, что при более высоких величинах потенциалов на электродах одновременно с окислением реагента начинают протекать и другие побочные процессы, сильно влияющие на полезный аналитический сигнал. То поэтому оптимальное напряжение при титровании ионов металлов в неводных средах необходимо было держать в области значений, указанных выше. Результаты титрований, полученные при различных величинах напряжения, достаточно точны, причем, наиболее правильные из них установлены на нитратном и хлоридном фонах с относительным стандартным отклонением, не превышающим 0,05.
Влияние природы и концентрации фонового электролита. Ввиду того, что кислотно-основные свойства и концентрация фонового электролита оказывает весьма существенное влияние на ход, условия и результаты АТ ионов металлов, то установление влияния его природы и содержания было необходимо в первую очередь.
Условия титрования, проводившихся с этой целью, были следующими: напряжения 0,5–0,65 В (в зависимости от природы фона и протеолитического растворителя), объем исследуемого раствора — 10,0 мл; температура 18–20 0С; концентрация титранта 0,01 М. Содержание исследуемого фонового электролита в растворе изменялось в диапазоне 0,025–0,5 М.
Как уже отмечалось, ионы благородных, а также тяжелых металлов относятся к числу катионов, образующих весьма прочные комплексные соединения с ТАА, ТНЛД, РК и ДТЗ, поэтому необходимо было прежде всего проверить возможность АТ ионов вышеуказанных металлов в неводных уксуснокислых средах.
Предварительные опыты показали, что серебро(I) наиболее быстро и правильно титрируется раствором ТНЛД на ацетатах калия и аммония, а также на перхлорате лития [3–4]. В отличие от серебра(I) при АТ палладия(II) и висмута(III) наблюдалось некоторые отклонения от стехиометричности реакции их комплексооброзования. Было выявлено, что по окончании титрования исследуемый раствор постепенно мутнеет и наблюдается выпадение окрашенного осадка тионалидного комплекса соответствующего катиона. Получившиеся при этом кривые АТ имеют аномальную по форме левую и прямолинейную, круто восходящую правую ветвь. На левой ветви в самом начале наблюдается не большой максимум, после прохождения которого ветвь остается на большом протяжении изогнутой, а затем становится практически прямолинейной и нисходящей под большим углом к оси объемов (рис.2). При повторном титровании без предварительной обработки электродов хромовой смесью левая ветвь становится все менее и менее наклоненной к оси абсциссе, приближаясь к горизонтальному положению, что с пассивацией индикаторных электродов.
Максимум в начале левой ветви кривой исчезает полностью; если в титруемый раствор вести небольшое количество поверхностно-активное вещество (ПАВ) (ОП-10–1 % раствор в уксусной кислоте), как это видно из рисунка 2.
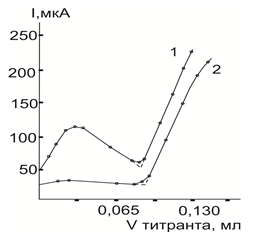
Рис.2. Кривые АТ серебра(I) раствором ТНЛД на фоне 0,25 М по ацетату калия в уксусной кислоте при Е=0,60 В. 1 — без добавления ПАВ, 2 — в присутствии ПАВ.
Обнаруженный факт свидетельствует о том, что причиной аномальной формы левой ветви является, во-первых, способность образующихся в начале АТ коллоидных частиц–комплексов ионов определяемых металлов (особенно серебра) с ТНЛД окисляться на аноде, и, во-вторых, постепенная пассивация электродов образующимся малорастворимым тионалидным комплексом соответствующего катиона. Благодаря возможности окисления коллоидных частиц тионалидного комплекса титруемого металла на аноде и одновременного восстановления не связанных ионов серебра или палладия на катоде возникает незначительный рост тока в самом начале титрования. Введение в титруемый раствор ПАВ (ОП-10) предотвращает возможность разрядки коллоидных частиц на аноде вследствие чего условия для появления максимума исчезают. Уменьшение же прямолинейного участка левой ветви кривой связанно, очевидно, с непрерывно возрастающей пассивацией индикаторных электродов.
На кривых АТ серебра(I) раствором ТНЛД имеется лишь небольшой участок плавного искривления при переходе левой ветви к правой, что благоприятствует точному нахождению т. э. обычным графическим способом. Как показали эксперименты, форма кривой АТ серебра(I) и четкость выражения на ней КТТ ухудшаются по мере уменьшения концентрации фонового электролита, начиная с 0,07 М и ниже, что связано с резким снижением электропроводимости исследуемого раствора. Правая ветвь кривой начинает при этом быстро искривляться по направлению к оси объемов, в результате чего воспроизводимость и правильность результатов АТ ионов металлов резко снижаются. Поэтому во всех дальнейших опытах концентрация фонового электролита в анализируемых растворах составляла не менее 0,15 М.
Эксперименты показали, что при АТ серебра(I), висмута(III) и меди(II) раствором ДТЗ в уксуснокислых средах на фоне ацетата калия кроме их первичных дитизонатов в незначительном количестве (менее 5 %) образуются и вторичные, вследствие чего расход титранта в т. э. получается несколько заниженным.
Для получения только первичных дитизонатов исследуемых металлов были проведены АТ вышеуказанных катионов в более кислых растворах, полученных при замене ацетата калия на перхлорат лития, а также с добавлением к последнему (до 2.10–3М) хлорной кислоты.
Предварительные опыты, проведенные на фоне 0,20 М по перхлорату лития показали, что АТ необходимо проводить при напряжении на электродах 0,60–0,65 В, а полученные при этом кривые по форме аналогичны таковым при титровании этих же катионов на фоне 0,25 М по ацетату калия.
Медь(II) и палладия(II) достаточно хорошо титруются при использовании РК [5–6], как на фонах ацетатов калия и аммония, так и на фоне перхлората лития, а также в растворах, содержащих кроме перхлората лития одновременно и свободную хлорную кислоту при ее концентрациях, не превышающих 0,005 М. Кривые АТ ионов этих металлов имеют нормальную восходящую форму с горизонтальной левой и круто восходящей правой ветвями (рис.3). Положение т. э. хорошо совпадает с точкой, в которой молярное соотношение Ме: РК=1:1. Титруемый раствор палладия при этом приобретает красновато-коричневую, а меди(II) – зеленоватую окраску. Причем, если концентрация палладия(II) превышает 2,10–5М, то раствор сначала мутнеет, а затем наблюдается выпадение красно-коричневого осадка.
На фоне 0,2–0,5 М по хлориду и нитрату лития кривые АТ палладия(II) и меди(II) также имеют четкую -образную форму, но положение КТТ отвечает образованию комплексов с соотношением Ме: РК = 1:2, а простейшему составу, как было установлено в присутствии ацетатного и перхлоратного фонов.
Полученные на хлоридном в присутствии ацетатного и перхлоратного фонов. Полученные на хлоридном и нитратном фонах растворы окрашиваются в более светлые тона: зеленоватый для Cu (II) и красновато-коричневый для Pd (II). Рис. 3.
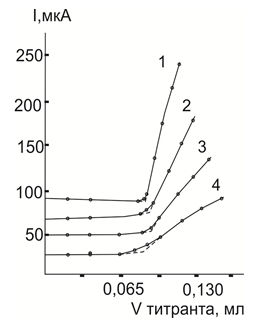
Рис.3. Кривые АТ палладия (II) раствором РК на различных по природе фоновых электролитах в уксусной кислоте при Е= 0,70 В.1–0,25М ацетат калия; 20–0,25 М ацетат аммония; 3–0,20 М перхлорат лития; 4–0,20М по перхлорату лития; 0,005 М по хлорной кислоте.
Результаты АТ различных количеств серебра (I) раствором ДТЗ, а также меди(П) и паладия (П) раствором РК и различных фоновых электролитах свидетельствует о правильности и воспроизводимости разработанных методик.
Таким образом, оптимальной концентрацией фона в исследуемом растворе при проведении АТ ионов металлов следует считать область от 0,1 до 0,3М.
Влияние природы и концентрации добавляемого инертного растворителя. Для решения вопроса о возможности применения разработанного амперометрического метода к определению палладия (П), платины (IУ) и других металлов непосредственно в экстрактах, получаемых при экстракционном отделении или концентрировании, а также в органических объектах, не растворимых в воде, но хорошо растворимых в органических средах. Необходимо было изучить влияние возрастающих добавок к титруемому раствору хлороформа, четыреххлористого углерода, бензола, гексана, метилэтилкетона и др. инертных растворителей, как наиболее часто и широко использующихся в качестве подходящих (специфичных) экстр агентов.
Следует отметить, что резкость наклона кривых титрования после т. э. во всех случаях увеличивается с повышением концентрации (до предельно допустимых содержаний) любого из изученных инертных растворителей, что свидетельствует об увеличении ЭКУ образующегося при титровании комплекса.
Эксперименты показали, что добавление к уксусной кислоте инертного растворителя сначала почти влияет на форму кривой и даже значительно увеличивает крутизну ее правой восходящей ветви, однако затем ее наклон начинает непрерывно снижаться. Тем не менее в присутствии до 30 и даже 40–50 об % этого растворителя кривая все еще остается достаточно четкой и только при содержании, большем 50 об % правая восходящая ветвь кривой титрования становится слишком пологой и практически с малым прямолинейным участком. На рис. 4 в качестве примера приведены кривые титрования палладия(II) в присутствии различных количеств инертных растворителей в уксусной кислоте, поскольку для других изученных катионов наблюдаются аналогичные закономерности. Средний расход титранта в т. э. при содержании изученных инертных растворителей 40–50 об. % и более (за исключением хлороформа и бензола) получается несколько завышенным. Рис. 4.
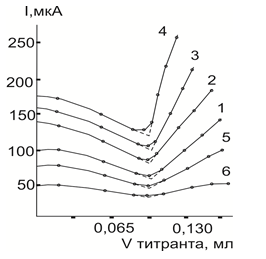
Рис.4. Кривые АТ палладия (II) раствором ТАА в присутствии хлороформа на фоне 0,15 М по нитрату лития в уксусной кислоте. Содержание инертного растворителя, об. %: 1–0; 2–10,0; 3–20,0; 4–30,0; 5–40,0; 6- 60,0
АТ ионов металлов в присутствии инертных растворителей при использовании ТНЛД проводились на фоне 0,25 М по ацетату калия при потенциале 0,60–0,75 В и в объеме исследуемого раствора 10,0мл.
Содержание толуола и бензола в анализируемой смеси до 40 % не оказывает существенного влияния на форму кривой и результаты АТ ионов металлов [7–8]. Влияние добавок метилэтилкетона адекватно таковому бензола и толуола, однако, в этом случае область плавного искривления между ветвями кривой увеличивается гораздо быстрее по мере повышения его содержания в анализируемом растворе. Наклоны правых и левых ветвей для всех трех растворителей практически не изменяются с увеличением их содержания до 35–40 %. Лишь при дальнейшем увеличения их концентрации правая ветвь начинает резко наклоняться и быстро искривляться по направлению к оси объемов.
Заключение. Таким образом, метрологические характеристики АТ металлов растворами исследуемых серосодержащих реагентов на различных по природе фоновых электролитах при оптимизированных условиях свидетельствуют о высокой точности предлагаемых методик.
Подводя итог рассмотрению АТ ионов различных металлов растворами ТАА, ДТЗ, ТНЛД, РК в неводных и смешанных средах можно заключить, что для определяющих количеств палладия(II), платины(IV), золота(III), ртути(II), свинца(П) и др. металлов обнаружены весьма достоверные, надежные, правильные и воспроизводимые результаты, а между введенными и найденными количествами ионов металлов на основании t0.95статистик значимых расхождений не обнаруживается. Нижняя граница (СН) определяемых содержаний металлов в 10,0 мл анализируемого раствора составляет 0,5–1 мкг в зависимости от природы титруемых металлов.
Литература:
1. Лурье Ю. Ю. Справочник по аналитической химии. М.: Химия. 1989. С. 267–275.
2. Геворгян А. М., Яхшиева З. З., Алламбергенов Б. А. Амперометрическое титрование платины, палладия и золота раствором тиоацетамида. Фармац. журн. 2010. № 2. С. 32–35.
3. Геворгян А. М., Яхшиева З. З. Оптимизация условий амперометрического определения некоторых благородных металлов раствором тиоацетамида. //Журн. Хим. пром. Санк-Петербург. 2010. Т.87. № 2. С.85–88.
4. Москвин Л. Н., Царицына Л. Г. Методы разделения и концентрирования в аналитической химии. М. Химия. 1991. 234.с.
5. Байзер М. М. Электрохимия органических соединений. / М.; Мир. 1976. 728 с.
6. Геворгян А. М., Талипов Ш. Т., Хадеев В. А., Мирзоян И. И. Вольтамперные кривые окисления тионалида на платиновом микроаноде в ледяной уксусной кислоте. // Депонир. в ВИНИТИ № 4616–81 от 24.09.81. С.1–3.
7. Геворгян А. М., Хадеев В. А., Талипов Ш. Т., Костылев В. С. Анодные вольтамперные кривые окисления тионалида на платиновом микроаноде в пропаноле. // Узб. хим. журн. 1981. № 3. С.22–24.
8. Геворгян А. М., Талипов Ш. Т., Хадеев В. А., Мухамеджанова Д. В. Вольтамперометрическое поведение диэтилдитиокарбамината натрия на платиновом аноде в среде диметилформамида. // Журн. аналит. химии. 1980. Т.35. № 10. С.2026–2028.







