В данной статье рассматриваются различные подходы к классификации способов иммобилизации ферментов, дана характеристика наиболее широко используемых методов и приведены частные случаи применения этих методов для иммобилизации липаз.
Ключевые слова: иммобилизация ферментов, липазы.
Иммобилизация — это включение молекул фермента в какую-либо изолированную фазу, которая отделена от фазы свободного раствора, но способна обмениваться с находящимися в ней молекулами субстрата, эффектора или ингибитора. Присоединение фермента к нерастворимому носителю имеет ряд преимуществ. Иммобилизованные ферменты легко удалять из реакционной смеси простой фильтрацией. Они используются многократно, что экономически целесообразно, несмотря на затраты, связанные с иммобилизацией. В процессе исследования таких ферментов оказалось, что многие из них значительно более устойчивы к внешним воздействиям, чем свободные.
Независимо от своей природы и способа получения, иммобилизованный фермент, по своему определению, выполняет две функции [1]:
1. Некаталитические функции, которые разрабатываются для отделения катализатора от среды применения с целью повторного использования катализатора и в особенности контролирование процессом;
2. Каталитические функции, которые разрабатываются для превращения субстратов в желаемых условиях.
За последние десятилетия в научной литературе были описаны тысячи протоколов и освещены различные стратегии иммобилизации. Ферменты можно присоединить к носителю взаимодействиями, варьирующими от обратимых физической адсорбции и ионного связывания до прочных ковалентных связей. При этом классификация методов иммобилизации зависит от взглядов авторов.
Классической считается классификация методов иммобилизации на физические и химические [2]:
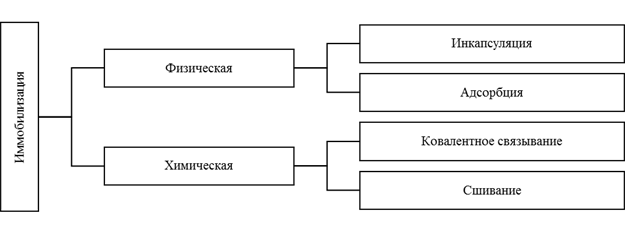 Рис. 1. Классическая классификация методов иммобилизации ферментов
Рис. 1. Классическая классификация методов иммобилизации ферментов
Sheldon [3] предлагает иную классификацию методов иммобилизации ферментов:
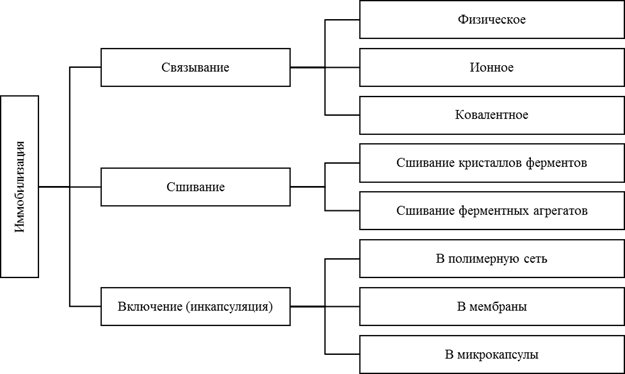
Рис. 2. Классификация методов иммобилизации по типу фиксации фермента в носителе
При этом автор отмечает, что проведение чёткой границы между методами связывания фермента и его инкапсуляцией представляет собой довольно сложную задачу. В своей работе он определил связывание как метод, при котором иммобилизация фермента производится на подготовленном заранее носителе, а при инкапсуляции иммобилизация фермента производится одновременно с приготовлением носителя (в одной среде).
Другая классификация, предложенная Brena и сотр. [4] разделяет методы иммобилизации, в зависимости от силы связывания фермента и носителя, на обратимые и необратимые. Необратимая иммобилизация подразумевает столь прочное связывание, что отделение фермента от носителя невозможно без потери биологической активности фермента и/или разрушения носителя. А при обратимой иммобилизации возможно отделение фермента от носителя при мягких условиях.
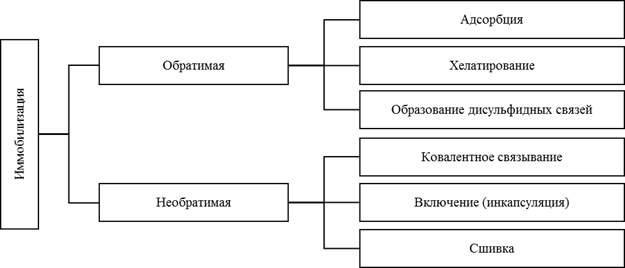
Рис. 3. Классификация методов иммобилизации, основанная на обратимости процесса
Ключевым моментом классификации Сao [1] является иммобилизация фермента с носителем или без него. При иммобилизации с носителем фермент фиксируется на носителе физическим или химическим связыванием. В противоположность этому подходу, ферменты, иммобилизованные без носителя, не нуждаются в дополнительной неактивной массе.
Ниже рассмотрены основные техники, применяемые для иммобилизации ферментов: адсорбция, ковалентное сшивание с носителем (перекрестное сшивание) и включение/инкапсуляция. [5]
Адсорбция — это процесс, при котором действие межмолекулярных сил, приводит к аккумуляции фермента на твёрдой поверхности. Так как адсорбция сильно зависит от межмолекулярных взаимодействий поверхностей носителя и фермента, такие свойства фермента как его заряд и полярность становятся крайне важными для полного и воспроизводимого покрытия носителя ферментом. Образующиеся при этом связи между ферментом и носителем являются слабыми (в основном это Ван-дер-Ваальсовы силы, водородные связи и гидрофобные взаимодействия), и оказывают малый эффект на каталитическую активность. Однако, именно потому, что эти связи такие слабые, фермент можно легко десорбировать от носителя. Адсорбция является наиболее легкой и наименее дорогой техникой иммобилизации для подготовки биокатализаторов на твёрдых носителях. [2]
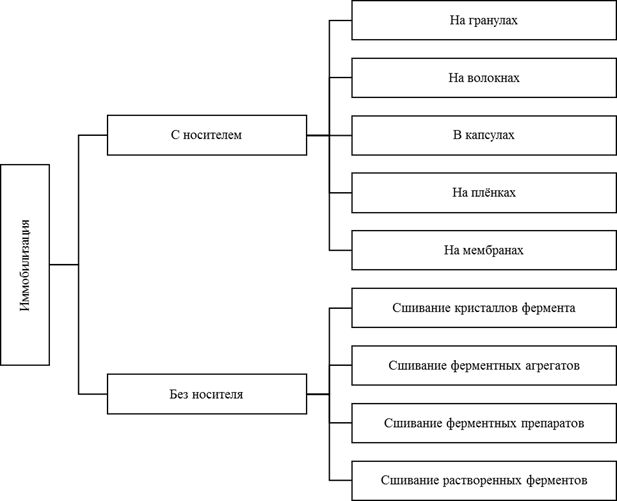
Рис. 4. Классификация методов иммобилизации в зависимости от наличия носителя
Процесс адсорбции можно описать двумя основными этапами:
1. Диффузия фермента из основной части раствора к поверхности носителя;
2. Связывание фермента в местах адсорбции на поверхности носителя.
Скорость связывания липазы с поверхностью носителя гораздо выше скорости диффузии, поэтому процесс адсорбции часто регулируется именно диффузией. Однако, в случае с некоторыми непористыми носителями, такими как зеолит типа Y, процесс адсорбции контролируется поверхностной кинетикой. [6]
При адсорбции на гидрофобных носителях большинство липаз проявляют значительное повышение активности. Было показано, что эта особенность связана с конформационными изменениями фермента при адсорбции, образующими открытый и доступный для субстрата активный сайт. Таким образом, липазы узнают гидрофобные поверхности похожие на их природные субстраты и подвергаются поверхностной активации в процессе иммобилизации. Особое внимание уделяется специфичной адсорбции липаз на нестандартных сильно гидрофобных поверхностях носителя. [7] [6]
Shah и соавт. провели адсорбцию липаз Candida rugosa на многослойных углеродных нанотрубках с высоким сохранением их биологической активности (97 %). Начальная скорость переэтерификационной активности полученного иммобилизованного биокатализатора повысилась по сравнению с лиофилизованным порошковым ферментом в 2,2 раза в безводной гексановой, и в 14 раз в водо-несмешиваемой ионной жидкости. В обоих случаях иммобилизованный фермент показал в 4,5 раза больший выход бутилбутирата в сравнении со свободным ферментом на протяжении 24 часов. Исследования на трансмисионном электронном микроскопе подтвердили, что иммобилизованный фермент прикреплен на многослойных нанотрубках. Авторы предпологают, что взаимодействие с гидрофобной поверхностью нанотрубок вызвало конформационные изменения, которые привели структуру липазы в состояние «открытой крышки». Подобные техники иммобилизации ферментов на наноразмерных носителях создают почву для разработки биореакторов меньших размеров и миниатюрных биосенсорных устройств. [8]
I.E. de Fuentes и др. определяли ферментативную активность липаз Rhizomucor miehei иCandida cylindracea после адсорбции на трёх различных филлосиликатах — сепиолит, палыгорскит и монтмориллонит (были получены из месторождений в Испании). Полученные данные сравнивали с результатами экспериментов со схожей техникой иммобилизации на широко используемой анионообменной смоле Doulite A-568. При гидролизе различных этиловых эфиров, ферменты, иммобилизованные на волокнистых материалах (палыгорскит и сепиолит) проявили наиболее высокую гидролитическую активность по сравнению с иммобилизованными на слоистых силикатах (монтмориллонит) и сферических частицах (Duolite A-568). [9]
Иммобилизация липаз с помощью нековалентной адсорбции оказалась полезной в безводных системах, благодаря низкой растворимости липаз в органических растворителях, в которых десорбция незначительна. По этой причине и благодаря простоте процедуры, использование адсорбированных липаз широко распространено в промышленном масштабе при катализе в гидрофобных растворителях. [6]
При иммобилизации ферментов посредством ковалентного сшивания с носителем происходит образование прочных химических связей между ферментом и носителем, что делает невозможным растворение фермента в реакционной среде.
Методы сшивания в общем можно разделить на два основных класса:
1. Активация носителя добавлением реакционной функции к полимеру
2. Модификация скелета полимера для получения активированной группы.
Процессы активации в общем проектируются с целью создания электрофильных групп на носителе, которые на этапе сшивания реагируют с сильными нуклеофильными группами на поверхности белков. Наиболее часто используемые реакции затрагивают следующие боковые цепи аминокислот: лизин (ε-аминогруппа), цистеин (тиольная группа), аспарагиновая и глутаминовая кислоты (карбоксильные группы). [4]
Липаза Candida rugosa была ковалентно иммобилизована на целлюлозу, производные целлюлозы (ацетат целлюлозы и фталеат целлюлозы) и целлюлозные композитные мембраны с использованием таких активирующих агентов, как периодат натрия или карбодиимид. Также были подготовлены и использованы для иммобилизации другие нецеллюлолитические мембраны (нейлон, полиуретан, хитозан и гидроксиэтилметакрилат). [10]
Выделенная и очищенная липаза Pseudomonas aeruginosa SRT9 была иммобилизована на три(4-формилфенокси)цианурат с формированием основания Шиффа. Выход иммобилизации составил 85 %. Свободная и иммобилизованная липазы использовались при гидролизе оливкового масла в водной среде. Сравнительное исследование выявило, что иммобилизованная липаза показала сдвиг оптимума pH с 6,9 (свободная липаза) до 7,5, а также сдвиг в температурном оптимуме с 55°С до 70°С. При этом термостабильность иммобилизованной липазы возросла на 20–25 %, начальная активность составила 75 % после 7-ми циклов. Также препарат показывал хорошую стабильность в органических растворителях (особенно в 30 % ацетоне и метаноле). [11]
Метод иммобилизации путём включения основан на фиксации фермента внутри полимерной сети, которая удерживает фермент, а также позволяет субстрату и продуктам катализа проходить сквозь неё. В отличие от ковалентного метода, при иммобилизации включением, фермент не связывается с носителем или мембраной. Существуют разные способы включения ферментов, например, включение в гель или волокна, а также микроинкапсулирование. Практическое использование этих методов ограничивает пределы переноса масс сквозь мембраны или гели. [4] [6] [12]
M.Phisalaphong с соавт. исследовали получение биодизеля из пальмового масла с использованием свободной и иммобилизованной форм липазы Candida rugosa. Было изучено три метода иммобилизации: 1. адсорбция липазы на CaCO3: 2. включение липазы в Ca-альгинатный гель; 3. включение CaCO3-иммобилизованной липазы в Ca-альгинатный гель. Липаза, включенная в Ca-альгинатный гель после 48 часов ферментации показала наиболее высокий выход этилового эфира (74 %), по сравнению с липазами, иммобилизованными другими методами, тогда как при использовании свободных липаз наблюдался выход этилового эфира в 83 % после 24 часов. [13]
Таким образом, при грамотно подобранных способов иммобилизации — метода, носителя, условий процесса, можно получать такие комплексы фермент-носитель, который будет превосходить нативный фермент по многим показателям. Иммобилизация биокатализаторов позволяет значительно расширить сферы применения определённых ферментов, что открывает новые горизонты для биотехнологической промышленности.
Литература:
1. Linqiu Cao Luuk van Langen, Roger A.Sheldon Immobilised enzymes: Carrier-bound or carrier-free? [Journal] // Current Opinion in Biotechnology. — [s.l.]: Elsevier, 2003. — pp. 387–394.
2. Mohd Basyaruddin Abdul Rahman Noor Mona Md. Yunus, Siti Salhah Othman, Abu Bakar Salleh, Mahiran Basri Immobilized Enzymes [Book Section] // New Lipases and Proteases / ed. al. A. B. Salleh et. — [s.l.]: Nova Science Publishers, Inc., 2006.
3. A.Sheldon Roger Enzyme Immobilization: The Quest for Optimum Performance [Journal] // Adv. Synth. Catal.. — Weinheim: Wiley-VCH Verlag GmbH & Co., 2007. — pp. 1289–1307.
4. Beatriz Brena Paula Gonzalez-Pommbo, Francisco Batista-Viera Immobilization of Enzymes: A Literature Survey [Book Section] // Methods in Molecular Biology: Immobilization of Enzymes and Cells / ed. M.Guisan Jose. — New York: Humana Press, 2013.
5. Michael J.Moehlenbrock Shelley D.Minteer Introduction to the Field of Enzyme Immobilization and Stabilization [Book Section] // Methods and Protocols: Enzyme Stabilization and Immobilization. — [s.l.]: Humana Press, 2011.
6. Zorica D. Knezevic Slavica S. Siler-Marinkovic, Ljiljana V. Mojovic Immobilized Lipases as Practical Catalysts [Journal] // APTEFF. — 2004. — pp. 151–164.
7. M.Guisan Jose New Opportunities for Immobilization of Enzymes [Book Section] // Methods in Molecular Biology. — New York: Humana Press, 2013. — 3: Vol. 1051.
8. Shweta Shah Kusum Solanki and Munishwar N Gupta Enhancement of lipase activity in non-aqueous media upon immobilization on multi-walled carbon nanotubes [Journal] // Chemistry Central Journal. — November 29, 2007.
9. Isidoro Emilio de Fuentes Cesar Antonio Viseras, Daniela Ubiali, Marco Terreni, Andreas Rafael Alcantara Different phyllosilicates as supports for lipase immobilisation [Journal] // Journal of Molecular Catalysis B: Enzymatic. — 2001. — pp. 657–663.
10. M. G. Carneiro-da-Cunha J. M. S. Rocha, F.A. P. Garcia, M. H. Gil Lipase immobilisation on to polymeric membranes [Journal] // Biotechnology Techniques. — 1999. — pp. 403–409.
11. Borkar Prita Khobragade Chandrahas, P. Venkata Ramana, Bodade Ragini, M. Swetha Immobilization and stabilization of Pseudomonas aeruginosa SRT9 lipase on tri(4-formyl phenoxy) cyanurate [Journal] // Korean Journal of Chemical Engineering. — 2011. — pp. 867–874.
12. Cao Linqiu Carrier-Bound Immobilized Enzymes.Principles, Applications and Design [Book]. — Weinheim: WILEY-VCH Verlag GmbH & Co. KGaA, 2005.
13. N. Sawangpanya C. Muangchim, M. Phisalaphong Immobilization of Lipase on CaCO3 and Entrapment in Calcium Alginate Bead for Biodiesel Production [Journal] // Science Journal Ubon Ratchathani University. — 2010. — pp. 46–51.







