Нарушение функциональной активности клеточных элементов соединительной ткани при недифференцированной дисплазии соединительной ткани (НДСТ) способствует изменению репаративных процессов и образованию неполноценного коллагена, а также может быть весомым патогенетическим механизмом развития атрофии слизистой оболочки желудка. В ходе данного исследования бнаружена существенная динамика атрофии антрального отдела желудка на фоне применения антихеликобактерной схемы с коллоидным висмутом у больных с НДСТ (р<0,05). Это свидетельствует о положительном цитопротекторном эффекте препарата коллоидного висмута в антихеликобактерной схеме, а также о преобладании неопределённых атрофий у больных с НДСТ, требующих дифференциальной диагностики именно на фоне цитопротекторной терапии.
Ключевые слова: эрадикация, воспаление, атрофия, гастрит, Н. pylori
Введение
Современные научные данные по проблеме хронических заболеваний верхних отделов желудочно-кишечного тракта (ЖКТ), протекающих на фоне врожденной дисплазии соединительной ткани ограничены, касаются преимущественно анатомических аномалий и очень редко направлены на выявление гистологических особенностей патоморфоза с учетом нарушений синтеза коллагена [3,7]. Кроме того, отсутствует единое мнение относительно патогенетической роли данного синдрома в развитии заболеваний ЖКТ.
Синдром дисплазии соединительной ткани объединяет системные наследственные дифференцированные синдромы, в основе которых лежат хорошо известные дефекты генов (синдром Марфана, синдром Элерса — Данлоса и др.) и недифференцированные дисплазии соединительной ткани (НДСТ), при которых отмечаются микроаномалии со стороны практически всех органов и систем в той или иной комбинации [2,6]. Неполные, стертые формы, затрудняют своевременную диагностику и могут иметь необратимые последствия за счет развития тяжелых, а иногда и фатальных осложнений.
Детально изучены многие фенотипические признаки НДСТ, которые условно разделяют на внешние, выявляемые при физикальном обследовании, и внутренние анатомические признаки дисплазии соединительной ткани. Клинические проявления НДСТ отличаются вариабельностью, поэтому комплексная оценка фенотипических маркеров позволяет не только заподозрить, но и достоверно диагностировать наличие НДСТ уже на этапе физикального обследования больного [5,6].
Целью данного исследования стала оценка состояния слизистой оболочки желудка у пациентов с недифференцированной дисплазией соединительной ткани, а также динамика этих изменений на фоне антихеликобактерной терапии в зависимости от наличия стигм дисэмбриогенеза.
Материалы и методы
С целью изучения особенностей течения и лечения сочетанной патологии верхних отделов ЖКТ проводили сравнение результатов лечения у 132 Н. pylori-инфицированных больных с хроническими гастритами (ХГ) и стигмами дисембриогенеза, которые характерны для НДСТ (74 человека) и без них (58 человек). Все больные, независимо от наличия фенотипических признаков дисплазии соединительной ткани, были разделены на две группы, однородные по возрасту и полу: основную и контрольную. В контрольной группе пациенты получали лечение тройной антихеликобактерной терапией, включавшей кларитромицин, амоксициллин и эзомепразол в стандартных дозах в течение двух недель. Основную группу составили пациенты, которые лечились по схеме: коллоидного висмута субцитрат по 120 мг четыре раза в сутки + амоксициллин по 1000 мг дважды в сутки + кларитромицин по 500 мг дважды в сутки + эзомепразол по 20 мг дважды в сутки также в течение двух недель. С целью верификации диагноза хронического гастрита особое внимание уделяли результатам таких методов инструментальной диагностики как эзофагогастродуоденоскопия, морфология и рН-метрия. Инфицированность Н. pylori подтверждали ИФА, быстрым уреазный тестом и гистологическим методом. Морфологическую оценку гистологических препаратов слизистой оболочки желудка (СОЖ) проводили в соответствии с Сиднейской классификацией, Хьюстонского пересмотра, по модифицированной визуально аналоговой шкале системы Operative Link for Gastritis Assessment (шкала OLGA) [1,8] с полуколичественной оценкой инфицированности Н. pylori, активности воспаления и выраженности атрофии (от 0 до 3х баллов). Оценку фенотипических признаков недифференцированной дисплазии соединительной ткани проводили по стандартной методике [4]. Вероятность выявленных изменений определяли параметрическими и непараметрическими методами вариационной статистики.
Результаты и обсуждение
Все больные, с признаками и без признаков дисплазии соединительной ткани, имели морфологически подтвержденные атрофические и неатрофические гастриты, ассоциированные с хеликобактерной инфекцией. При детальном анализе данных об атрофических изменениях, наблюдалось существенное преобладание атрофии среди пациентов с НДСТ. Так, среди 34 больных с атрофическими гастритами (45,9 %) сочетание атрофии в антральном отделе и теле желудка наблюдалось у 11 человек, у 9 — атрофию обнаружили лишь в теле и у 14 — в антральном отделе. Среди 7 обследованных без НДСТ (12,1 %) сочетание атрофии в теле и антральном отделе желудка наблюдалось только в 2-х случаях, а в теле желудка — в 1 случае. Кишечная метаплазия в антральном отделе регистрировалась до лечения у 19 человек с НДСТ (25,7 %), причем у двоих она сочеталась с интестинальной метаплазией в теле желудка. В группе больных без НДСТ интестинальная метаплазия встречалась в 3-х случаях (5,2 %) и только в антральном отделе. Существенное преобладание атрофических изменений у больных с НДСТ по сравнению с больными без признаков НДСТ может свидетельствовать о роли дисплазии соединительной ткани в развитии и прогрессировании атрофических изменений наряду с персистенцией Н. pylori.
В контрольной группе антихеликобактерная схема с кларитромицином, амоксициллином и эзомепразолом имела эрадикационную эффективность — 82,8 %. У всех пациентов контрольной группы до лечения наблюдались выраженные воспалительные изменения в антральном отделе. В теле желудка активность воспалительного процесса была несколько меньше, но существенно не отличалась от показателя в антральном отделе. Гистологические изменения слизистой оболочки желудка у 64 пациентов до и после назначения антихеликобактерной терапии демонстрируют несущественное снижение активности воспалительного процесса в обоих топографических областях как у пациентов с ХГ без НДСТ, так и при ХГ с НДСТ (рис. 1).
Среди 68 человек основной группы эрадикационная эффективность антихеликобактерной схемы, включающей эзомепразол, амоксициллин, кларитромицин и коллоидного висмута субцитрат составила 88,2 %, что достоверно не превышает показатель полученный при лечении тройной схемой в контрольной группе. До назначения антимикробного лечения у всех пациентов основной группы отмечались гистологические изменения в антральном отделе, и частично — в теле желудка.
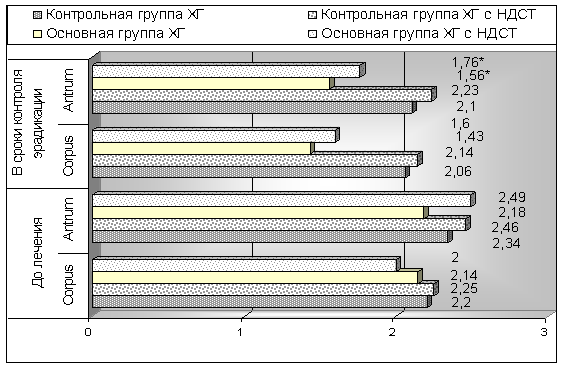
Рис. 1. Гистологические изменения слизистой оболочки желудка на фоне лечения в зависимости от наличия или отсутствия НДСТ
Примечание. * — Доcтоверная разница с аналогичным показателем (р<0,05), полученным до лечения.
При сравнении активности воспалительного процесса у всех больных наблюдалась несущественная разница между показателями тела и антрального отдела. Активность воспалительного процесса в антральном отделе у больных с НДСТ была выше, чем у пациентов без НДСТ. Однако, при сравнении этих данных с динамикой гистологических изменений в контрольной группе по топографическим отделам и наличию фенотипических стигм разницы не обнаружено. Общие показатели также указывают на несущественное преобладание степени активности гистологических изменений в теле по сравнению с антральным отделом в основной группе.
Морфологические показатели, полученные в сроки контроля эрадикации, свидетельствуют об общем снижении активности воспалительного процесса как в теле, так и в антральном отделе вне зависимости от наличия стигм дисэмбриогенеза. Наблюдается достоверное (р<0,05) снижение степени активности воспалительного процесса у пациентов основной группы (рис. 1). Важно отметить, что у пациентов контрольной группы такой динамики не зарегистрировано. Этот факт дополнительно свидетельствует о большей эффективности антихеликобактерной схемы с висмутом, чем схемы, которая применялась в контрольной группе.
Кроме активности воспалительного процесса привлекает внимание динамика атрофических изменений (рис. 2). В целом, этот показатель имел тенденцию к несущественному снижению. Однако, при более детальной оценке, выявлены достоверные различия (р<0,05) между данными полученными до лечения и в сроки контроля эрадикации в зависимости от наличия стигм дисэмбриогенеза, характерных для НДСТ. Этот факт можно объяснить с одной стороны цитопротекторным эффектом препарата коллоидного висмута в антихеликобактерной схеме, а с другой стороны — большим процентом больных с неопределёнными атрофиями при НДСТ.

Рис. 2. Динамика атрофии антрального отдела желудка на фоне лечения у пациентов основной и контрольной групп в зависимости от наличия или отсутствия НДСТ.
Примечание. * — достоверная разница с аналогичным показателем (р<0,05) полученным до лечения.
Положительные изменения гистологической картины у пациентов основной группы свидетельствуют о высокой цитопротекторной эффективности назначенной антихеликобактерной схемы, которая состоит из эзомепразола, амоксициллин, кларитромицина и коллоидного висмута. Полученные данные свидетельствуют о беспорной патогенетической роли дисплазии соединительной ткани в развитии и прогрессировании атрофических изменений, наряду с хеликобактерной инфекцией.
Выводы исследования
Учитывая высокий процент атрофических изменений слизистой оболочки желудка у больных с признаками НДСТ рекомендуется проводить оценку эрадикации инвазивными методами и дифференцировать истинные атрофии и неопределённые атрофии после курса антихеликобактерной терапии с обязательным использованием препарата коллоидного висмута.
Литература:
1. Аруин Л. И. Международная классификация хронического гастрита: что следует принять и что вызывает сомнения / Л. И. Аруин, А. В. Кононов, Мозговой С. И. // Арх. пат. — 2009. — Вып. 4. — С. 11–18.
2. Земцовский Э. В. Малые аномалии сердца и диспластические фенотипы / Э. В. Земцовский, Э. Г. Малев // СПб.: Изд-во «ИВЭСЭП»,2011. — 160 с.
3. Кононов А. В. Морфогенез атрофии слизистой оболочки желудка как основа фенотипа хронического гастрита / А. В. Кононов, С. И. Мозговой, М. В. Маркелова, А. Г. Шиманская //Арх. пат. — 2011. — Вып. 3. — С. 26–31.
4. Наследственные нарушения соединительной ткани. Российские рекомендации, разработанные комитетом экспертов Всероссийского научного общества кардиологов. — Москва, 2012. — 76с.
5. Beighton P. Ehlers-Danlos syndromes: Revised nosology, Villefranche, 1997/ P. Beighton, A. De Paepe, B. Steinmann, P. Tsipouras, R. J. Wenstrup //American Journal of Medical Genetics. — 1998. — Vol. 77, № 1. — Р. 31–37.
6. Grahame R., Bird H. A., Child A. The revised (Brighton, 1998) criteria for the diagnosis of benign joint hypermobility syndrome (BJHS) /R. Grahame, H. A. Bird, A. Child // Journal of Rheumatology. — 2000. — Vol. 27, № 7. — Р. 1777–1779.
7. Goldenring J. R. Oxyntic atrophy, metaplasia, and gastric cancer /J. R. Goldenring, K. T. Nam // Prog. Mol. Biol. Transl. Sci. — 2010. — Vol. 96. — P. 117–131.
8. Rugge M. OLGA staging for gastritis: a tutorial / M. Rugge, P. Correa, F. Di Mario et al. // Dig. Liver Dis. — 2008. — Vol. 40, № 8. — P. 650–658.







