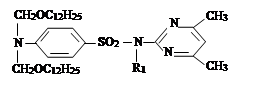
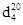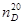On the basis of α - chlorine-alkyl and alkenyloxymethyl aethers and chlorazon have been synthesized 8 new derivative sulfadimezine organic connections. It has been conducted their researches as inhibitors protection against corrosion of metals. These new connections (especially connections V-VIII), containing some functional groups and 7 atoms of nitrogen even at concentration 2,5; 5; 10 mg/l are highly effective inhibitors.
На основании α-хлор-алкил и алкенилоксиметил эфиров и хлоразона были синтезированы 8 новых производных сульфадимезиновых органических соединений. Проведено их исследования в качестве ингибиторов защиты от коррозии металлов. Эти новые соединения (особенно соединения V-VIII), содержащие несколько функциональных групп и 7 атомов азота даже при концентрации 2,5; 5; 10 мг/л являются высокоэффективными ингибиторами.
В результате ранее проведенного нами синтеза азот и серосодержащих органических соединений и их исследования в качестве ингибиторов [1–2] было установлено, что действительно соединения, содержащие несколько функциональных групп и много атомов азота обладают высокоэффектив-ными свойствами ингибиторных веществ [3].
В связи с этим, в результате продолженных работ по синтезу и исследованию, нами на основе a-хлор-октоксиметил, a-хлор-десоктиме-тил, a-хлор-ундесоксиметил и 2,6-дихлор-5-оксогексен-2 эфиров, а так же на основе хлоразона были получены производные сульфадимезина (услов-но названные органическими соединениями I-VIII). Синтез и исследования были проведены известными методами в литературе [4–7].
Синтез был проведен в несколько нижеследующих этапов:
I. На первом этапе был проведен синтез a-хлор-алкенилок-симетил эфиров на основании нижеследующих реакций известными методами в литературе [4–6]:
CH2O + ROH + HCl  ROCH2Cl + H2O
ROCH2Cl + H2O
где, R= – C8H17; –C10H21; –C12H25; –CH2–CH=CCl–CH3.
Структура и элементный анализ синтезированных a-хлор-октоксиме-тил, a-хлор-десоксиметил, a-хлор-ундесоксиметил и 2,6-дихлор-5-оксогек-сен-2 эфиров были определены известными методами. Полученные результаты соответствуют известным в литературе [4-6] показателям.
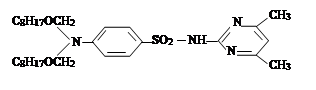
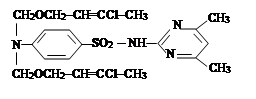
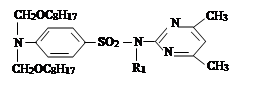
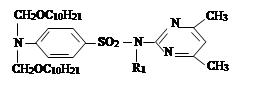
II. На втором этапе была проведена реакция a-хлор-алкил и алкенилоксиметил эфиров с сульфадимезином и были синтезированы новые органические соединения I–IV. Синтез был проведен по известному методу в литературе [7]:
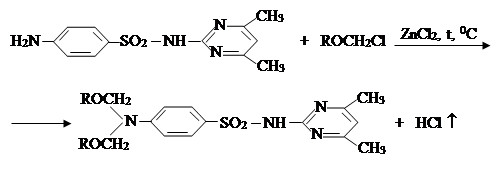 |
где R= –C8H17 (I); –C10H21 (II); –C12H25 (III), –CH2–CH=CCl–CH3 (IV).
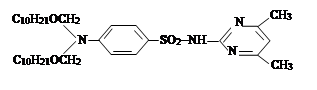
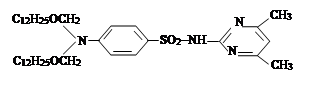
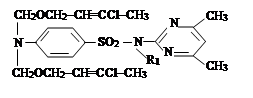
III. На третьем этапе была проведена реакция синтезированных на втором этапе новых органических соединений с хлоразоном и были синтезированы новые органические соединения V–VIII. Синтез был проведен по известному методу в литературе [7]:
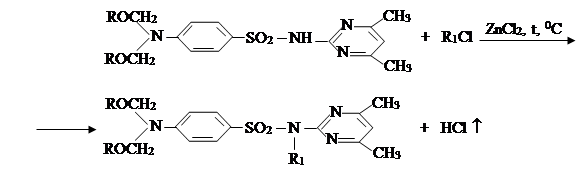
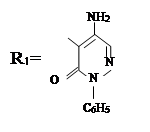
где, ; R= –C8H17 (V); –C10H21 (VI); –C12H25 (VII);
–CH2–CH=CCl–CH3 (VIII).
Определение структуры новых синтезированных органических соединений I–VIII было проведено снятием их в ИК и масс спектре. Информация об этом приведена в разделе экспериментальной части.
Процентный выход, физико-химические константы и элементный анализ новых производных приведены в таблице 1.
Во время исследовательских работ по определению ингибиторной активности новых соединений I–VIII было установлено, что каждое из них по своей ингибиторной эффективности превосходит как взятый в качестве сырья для синтеза сульфадимезина, так и многие известные в литературе ингибиторные вещества. Исследовательские работы по определению ингибиторной эффективности новых производных сульфадимезина (соединения I–VIII) были проведены на основе известного в литературе [8] «гравиметрического» метода потери массы металла.
Установление эффективности синтезированных новых производных сульфадимезина (I–VIII) в качестве ингибитора коррозии стали проведено в четырехгорлых колбах в динамических условиях при постоянном перемешивании (600 об/мин.) коррозионной двухфазной смеси при 40–450С. Образцы из стали 3 с общей поверхностью 2 см2 перед испытанием шлифуются, обезжириваются соответствующим образом. Расход ингибитора рассчитывается на 1 л коррозионной среды. Время испытания 3 ч. Результаты исследования приведены в табл. 2.
Как видно из табл. 2, даже при концентрации 2.5; 5; 10 мг/л полученные нами новые соединения I–VIII (особенно соединения V–VIII) по своим ингибиторным свойствам превышают взятое нами для сравнения известное в литературе [9] условно обозначенное нами А, ингибиторное вещество, получившее авторское свидетельство, даже при его концентрации 200 мг/л.
Вероятнее всего, что новые производных сульфадимезина соед. I–VIII адсорбируются на поверхности стали и проявляя свою ингибиторную активность, положительно действуют на сталь, делая ее поверхность пассивной для коррозии. За счет наличия в составе новых соединений двойных связей, много функциональных групп, атомов азота и за счет повышения плотности электронов в их составе поверхность стали становится пассивной к коррозии. Все это способствует образованию комплекса между молекулой ингибитора и металлом и приводит к повышению степени защиты.
На основании исследовательской работы можно заявить, что синте-зированные новые производные сульфадимезина (соединения I–VIII, а осо-бенно соединения V–VIII) могут использоваться как высокоэффективные ингибиторы защиты от коррозии стального технологического оборудова-ния в нефтегазодобывающей, перерабатывающей промышленности, а так же и в нефтехимической промышленности.
Как видно из состава и структуры новых производных сульфади-мезина соединений I–VIII, эти соединения могут найти свое применения как медицинский препараты, присадки, биологически активные вещества, инсектисиды. Поэтому очень актуален синтез таких соединений в нефте-химической промышленности, а так же в промышленности органической химии.
Экспериментальная часть
Синтез N1,N1-диоктоксиметил-сульфадимезина (I). В реакционную колбу помещают 2 г ZnCl2, 27,8 г (0,1 г-моль) сульфадимезина прибавляют 100 мл этилового спирта, и при температуре 700С перемешивают до полного растворения сульфадимезина. Затем из капельной воронки периодически добавляется 35,68г (0,2 г-моль) α-хлор-октоксиметилового эфира и в течение 8 часов перемешивается при температуре 760С. При комнатной температуре реакционную смесь нейтрализуют, добавляя 100 мл 10 % раствора NaOH и промывают 200 мл дистиллированной воды. Органический слой извлекается диэтиловым эфиром, затем растворитель отгоняют водоструйным вакуумом и органический слой сушат над СаСl2.
Синтезированный N1,N1-диоктоксиметил-сульфадимезина (I) отгоняет-ся на вакуумной установке.
Аналогично синтезу соединения I был проведен синтез N1,N1-дидeсо-ксиметил-сульфадимезина (II), N1,N1-диундесоксиметил-сульфадимезина (III) и N1,N1-ди(2-хлор-5-оксогексен-2)-сульфадимезина (IV).
Составы и структуры синтезированных новых соединений I-VIII были установлены на основании данных элементного анализа, ИК и масс спектров.
В ИК спектре этих соединений интенсивно проявляются полосы характеризующие простую эфирную группу С-О-С 1050, 1080 см-1; С-N связь 1280, 1310, 1350 см-1; NH связь 3360, 3375 - 3395 см-1; СН3 группу 1380, 1460, 2990, 3030 см-1; содержащуюся в ядре бензола С=С связь 1440–1465, 1500–1510, 1590–1610 см-1; С6Н5 группу 700–780 см-1.
В ИК спектре соед. IV наряду с перечисленными выше характерис-тиками структуры интенсивно проявляются полосы, относящиеся к 2-хлор-5-оксогексен-2 группе С=С связь 1640 см-1; С-Сl связь 650 см-1.
В масс спектрах соединений I-IV было определено, что их молекулярным массам соответствуют молекулярные ионы 526 m/е, 618 m/е, 674 m/е и 515 m/е.
Синтез N1,N1-диоктоксиметил-N2'-азон-сульфадимезина (V). В ре-акционную колбу для синтеза помещают 2 г ZnCl2, 22,25 г (0,1 г-моль) хло-разона, и прибавляют 150 мл метилового спирта. Смесь при температуре 600С перемешивается в течение одного часа до полного растворения хло-разона. Затем из капельной воронки постепенно подают 52,6г (0,1 г-моль) N1,N1-диоктоксиметил-сульфадимезин и в течение 8 часов реакционная смесь перемешивается при температуре 600С. Затем при комнатной температуре реакционную смесь нейтрализуют, добавляя 100 мл 10% раст-вора NaOH и промывают 200 мл дистиллированной воды. Органический слой извлекается диэтиловым эфиром. Отгоняют эфир, реакционный продукт сушат над СаСl2. На вакуумной установке выделяют N1,N1-диоктоксиметил-N2'-азон-сульфадимезин(V).
Синтез соединений N1,N1-дидесоктоксиметил-N2'-азон-сульфадиме-зина(VI), N1,N1-диундесоктоксиметил-N2'-азон-сульфадимезина (VII) и N1,N1-ди(2-хлоp-5-оксогексен-2)-N2'-азон-сульфадимезина (VIII) был про-веден аналогично синтезу соединения V.
Составы и структуры синтезированных новых соединений сульфа-димезина V–VIII были установлены на основании данных элементного анализа, масс и ИК-спектров.
В ИК-спектре этих соединений интенсивно проявляются полосы характеризующие простую эфирную группу С–О–С 1050, 1080 см-1; СН3-группу 1380, 1460, 2990 см-1; СН2-группу 2950 см-1; связь С-N 1310-1350 см-1; в группе азона N–N связь 1580 см-1, NH2-группу 550, 1570, 3300 см-1; содержащуюся в ядре бензола С=С связь 1440 , 1465, 1500 – 1510, 1590 – 1610 см-1; С6Н5 группу 700 – 780 см-1.
В ИК спектре соед. VIII наряду с перечисленными выше харак-теристиками структуры интенсивно проявляются полосы, относящиеся к 2-хлор-5-оксогексен-2 группе связь С=С 1640 см-1; С–Сl связь 650 см-1.
В масс спектрах соединений V–VIII было определено, что их моле-кулярным массам соответствуют молекулярные ионы 747 m/е, 803 m/е, 859 m/е и 700 m/е.
Таблица 1
Процентный выход, физико–химические константы и элементный анализ синтезированных новых
производных сульфадимезина (cоед. I–VIII)
|
Химическая формула соединения и условный номер |
Выход, % |
Ткип, 0С (мм рт.ст) |
|
|
MRD |
Брутто формула, мол. вес
|
Элементный анализ, % Вычислено/ Найдено |
|||||
|
найдено вычислено |
||||||||||||
|
C |
H |
N |
S |
Cl |
|
|||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
|
I |
95.45 |
286-187 (3) |
1.0527 |
1.5285 |
164.52 164.34 |
C30H50N4O4S 562 |
64,06 63,89 |
8,89 8,74 |
9,96 9,79 |
5,69 5,47
|
– |
|
|
II |
95.39 |
191-192 (3) |
1.0586 |
1.5397 |
183.09 182.93 |
C34H58 N4O4S 618 |
66,02 65,84 |
9,39 9,18 |
9,06 8,87 |
5,18 4,95 |
– |
|
|
III |
95.43 |
196-197 (3) |
1.0654 |
1.5508 |
201.67 201.52 |
C38H66 N4O4S 674 |
67,66 67,48 |
9,79 9,57 |
8,31 8,13 |
4,75 4,58 |
– |
|
|
IV |
94.37 |
221-222 (3) |
1.2649 |
1.5827 |
136.02 135.84 |
C22H28N4O4SCl2 515
|
51,26 51,04 |
5,44 5,27 |
10,87 10,65 |
6,21 6,03
|
13,79 13,56 |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
|
V |
95.38 |
235-236 (3) |
1.1218 |
1.5655 |
217.05 216.89 |
C40H57N7O5S 747 |
64,26 64,07 |
7,63 7,45 |
13,12 12,91 |
4,28 4,09
|
– |
|
|
VI |
95.44 |
241-242 (3) |
1.1289 |
1.5768 |
235.63 235.48 |
C44H65N7O5S 803 |
65,75 65,58 |
8,09 7,91 |
12,2 12,04 |
3,98 3,75 |
– |
|
|
VII |
95.42 |
246-247 (3) |
1.1372 |
1.5881 |
254.25 254.07 |
C48H73N7O5S 859 |
67.05 66,87 |
8,50 831 |
11.41 11.18 |
3.73 3.51
|
– |
|
|
VIII |
94.51 |
254-255 (3) |
1.3043 |
1.6201 |
188.54 188.39 |
C32H35N7O5S Cl2 700 |
54,86 54,67 |
4,57 4,39 |
14,0 13,78 |
4,57 4,29 |
10.14 9.91
|
|
 |
где, .
Таблица 2
Показатели результатов исследования ингибиторной эффективности
новых производных сульфадимезина cоед. I – VIII
|
Условный номер соединения |
Концентрация ингибитора, мг/л |
3% NaCl+нефт (10:1) H2S 500 мг/л |
0.3 N HCl +бензин (1:7) H2S 1000 мг/л
|
||
|
Скорость коррозии, г/см2 час |
Эффек-тивность ингиби-тора, % |
Скорость коррозии, г/см2 час |
Эффективность ингибитора, % |
||
|
1 |
2 |
3 |
4 |
5 |
5 |
|
Без ингибитора |
– |
2.56 |
– |
3.65 |
– |
|
I |
2.5 5 10 |
0.081 0.023 0.011 |
96.84 99.10 99.76 |
0.098 0.012 0.0005 |
97.32 99.65 99.98 |
|
II |
2.5 5 10 |
0.063 0.012 0.005 |
97.54 98.0 99.8 |
0.0075 0.0009 0.0002 |
99.79 99.97 99.99 |
|
III |
2.5 5 10 |
0.044 0.007 0.001 |
98.28 99.73 100 |
0.0051 0.0005 0.0001 |
99.86 99.98 100 |
|
IV |
2.5 5 10 |
0.028 0.005 0.001 |
98.91 99.8 100 |
0.0023 0.0002 – |
99.94 99.99 100 |
|
V |
2.5 5 10 |
0.007 0.002 – |
99.97 99.99 100 |
0.0005 0.0002 – |
99.98 99.99 100 |
|
VI |
2.5 5 10 |
0.0005 0.0001 – |
99.98 100 |
0.0002 – |
99.99 100 |
|
VII |
2.5 5 10 |
0.0002 – |
99.99 100 |
0.0001 – |
100 |
|
VIII |
2.5 5 10 |
0.0001
|
100 |
– |
100 |
|
А [9]
|
200 |
0.038 |
98.5 |
0.073 |
98 |
СПИСОК ЛИТЕРАТУРЫ
1. Байрамов Г.И. Синтез серо-, а так же азот- и серосодержащих новых органи-ческих соединений на основе 1-метил-1-хлор-2-октоксиметилциклогексана. // Химические проблемы. НАН Азербайджана. 2008. № 1. с.96.
2. Байрамов Г.И. Синтез и исследование азотсодержащих новых органических соединений на основе 1,3-дихлорбутена-2. НАН Азербайджана. // Азерб. хим. журн. 2008. № 2. с.102.
3. рачев Х., Стефанова С. Справочник по коррозии. М.: Мир, 1982. 62 с.
4. Поконова Ю.В. химия и технология галоген эфиров – Л.: ЛГУ. 1982. 243 с.
5. Поконова Ю.В Галлоиды эфиров. М.: Химия. 1966. 57 с.
6. Байрамов Г.И. Дисс. …канд.хим.наук. Баку: ИНХП АН Азерб. ССР, 1988. с.80, 82.
7. Байрамов Г.И. Синтез новых производных дифенилкарбазона на основе α-хлор-метил-алкил и алкенил эфиров и хлоразона и их исследование. Молодой ученый ежемесячный журнал. Чита. 2009. № 5. с.13, 15.
8. Жук Н.П. Курс коррозии и защита металлов. М.: Металлургия, 1968. 361 с.
9. А.с. СССР. №1031141, 1983 г., А С 07 С129/12 С 23 F 11/14. Шихмамедбекова А.З, мамедьярова И.Ф, Байрамов Г.И. и др. N, N'–дифенил–-N'-октоксиметил-гуанидин в качестве ингибитора коррозии стали в двухфазной системе.