Введение
Истории порфиринов чуть более века [1]. Большой интерес к исследованию порфиринсодержащих объектов обусловлен их обширным распространением в природе и тем, что порфиринсодержащие вещества играют огромную роль в биохимических процессах. Исследования в области порфиринов и аналогичных молекул за последнее десятилетие развиваются стремительно.
Ежегодно синтезируются сотни и тысячи все более сложных производных порфина, появляются многочисленные публикации с результатами исследований геометрической и электронной структуры, колебательной, электронной и резонансной спектроскопии, применения новых физических методов к изучению особенностей структуры молекул порфиринов, их физической и координационной химии и так далее.
Гемоглобин – один из представителей природных порфиринов, красный железосодержащий пигмент крови. В организме выполняет функцию переноса кислорода из органов дыхания к тканям; играет также важную роль в переносе углекислого газа от тканей к органам дыхания. Гемоглобин обладает уникальным набором физико-химических свойств, к важнейшим из которых следует отнести хромофорную активность, структурно-конформацинонное превращение, способность к комплексообразованию. Эти особенности определяют его биохимические функции и практически полезные характеристики. Гемоглобин является одним из хромопротеинов, у млекопитающих представляет собой белковый комплекс, состоящий из четырех субъединиц (рис. 1).
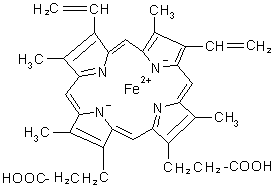
Каждая субъединица состоит из белка глобина и связанного с ним окрашенного небелкового компонента (простетической группы) – гема. Гем представляет собой комплекс протопорфирина с двухвалентным железом (рис. 2) [2].
Все формы гемоглобинов содержат одну и ту же протогемовую простеическую группу, а вот состав белковой части молекулы будет различным: аминокислоты и их последовательность в белковой части гемоглобина, определяемые генетическими факторами, у различных видов животных отличны, что приводит к изменению максимумов поглощения света, растворимости, изоэлектрической точки, сродства к кислороду и устойчивости изолированных пигментов к кислотам, щелочам и нагреванию [3, 4].
Даже у человека имеются три основных типа нормального гемоглобина: эмбриональный, фетальный и гемоглобин взрослого человека, не говоря об аномальных видах гемоглобина, которых известно более двухсот, что должно отражаться на коллоидных свойствах водных дисперсий гемоглобина [5].
Гемоглобин относится к полиамфолитам [6]. На поверхности гемоглобина в водных растворах адсорбируются одновременно ионы Н+ и ОН-. В общем виде можно записать две поверхностные реакции:
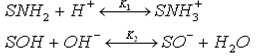
где S – символ поверхности.
 |
Соответственно в зависимости от того, адсорбция каких ионов преобладает, поверхность приобретает либо положительный, либо отрицательный заряд [7]. Благодаря этому возможно поддержание постоянного значения рН крови (75% буферной емкости крови обеспечивает буферная емкость гемоглобина). У человека значение рН крови – 7.36, отклонение от этого значения на несколько десятых может привести к летальному исходу [8].
Рис. 1. Гемм

Рис. 2. Структура гемоглобина человека
Положение изоэлектрической точки определяет условия устойчивости водных дисперсий гемоглобина, характер его взаимодействия с простыми электролитами, аминокислотами и белками. Изоэлектрическая точка влияет на пространственную структуру гемоглобина и его способность переносить кислород, поэтому очень важно изучить влияние состава водного раствора на значение изоэлектрической точки, электрокинетические свойства и устойчивость водных дисперсий гемоглобина.
Коллоидные свойства определяют поведение и свойства дисперсных систем, содержащих гемоглобин. Исследования этих свойств интересны не только своей новизной, но и тем, что позволяют выявить особенности поведения биологически активного вещества, показать границы применимости коллоидных закономерностей, выведенных, прежде всего для неорганических соединений.
Цель данной работы – исследование зависимости электрокинетического потенциала водных дисперсий гемоглобина в растворе аминокислот от времени контакта фаз и pH среды.
Материалы и методы исследований
В настоящей работе в качестве объектов исследования использовался бычий гемоглобин (hemoglobin from bovine blood), выделенный и очищенный в НИИ «Антибиотиков и ферментов медицинского назначения», г. Санкт-Петербург.
В работе для электрокинетических измерений использовалась 0,1 % дисперсия гемоглобина, приготовленная следующим образом: навеска гемоглобина растиралась в ступке в небольшом количестве исследуемого раствора до образования густой пасты, затем добавлялся весь объем раствора, далее полученную смесь переносили в ячейку для диспергирования и обрабатывали ультразвуком в течение 5 минут (использовался ультразвуковой генератор марки УЗГ15-0,1/22).
Все химические реактивы, используемые в работе, были класса ХЧ. Для приготовления растворов использовалась бидистиллированная вода.
В качестве БАВ была выбрана простейшая аминокислота: L-аспарагин, далее просто аспарагин, марки ч.д.а.
Концентрированные растворы готовились по точной навеске, а разбавленные – методом последовательного разбавления.
Концентрации растворов проверяли по электропроводности и аналитически. Регистрация рН осуществляется на рН-метре – 150М с точностью измерения ±0,05 ед. рН.
Электрокинетический потенциал (ζ-потенциал) частиц гемоглобина определялся методом микроэлектрофореза [9] и рассчитывался по уравнению Гельмгольца-Смолуховского. Данное уравнение использовалось без поправок, так как выполнялись условия k∙a >> 1, где k– обратная толщина ДЭС, а – радиус частиц. Измерения проводились с погрешностью не превышающей 10%.
Результаты и их обсуждение
В работе проведено исследование кинетики установления адсорбционного равновесия в системе дисперсии гемоглобина в водных растворах аспарагина. Проведено измерение электрокинетического потенциала, pH и электропроводности водных дисперсий гемоглобина в зависимости от времени контакта фаз. Данные представлены на рис. 3.
Из рис. 3. видно, что адсорбционное равновесие устанавливается менее чем через 8 часов. Все дальнейшие исследования проводились через сутки для удобства эксперимента.

Рис. 3.Зависимость электрокинетического потенциала гемоглобина в растворах HCl при рН = 3,0 от времени контакта фаз
Рассмотрим влияние аспарагина на электрокинетические свойства водных дисперсий гемоглобина. На рис. 4. представлена зависимость ζ – (-lgС). Из рисунка видно, что значение электрокинетического потенциала гемоглобина в растворах аспарагина возрастает с ростом концентрации аминокислоты. Это обусловлено адсорбцией катионных форм аспарагина.
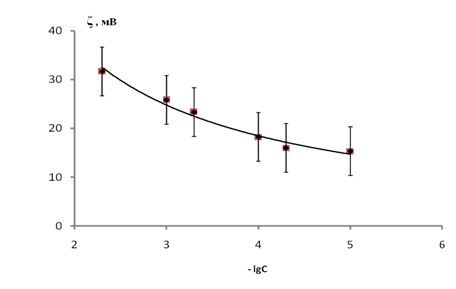
Рис. 4. Зависимость ζ – (-LgC) гемоглобина в водных растворах аспарагиновой
кислоты (t – сутки).
В таблице приведены значения pH растворов аспарагина при его различных концентрациях.
Таблица
Значение рН водных растворов HCl и аспарагина
|
С, моль/л |
1·10-2 |
1·10-3 |
5∙10-4 |
1·10-4 |
|
pН (HCl) |
2 |
3 |
3,3 |
4 |
|
рН (аспарагина) |
5,7 |
5,8 |
5,9 |
5,95 |
Из данных таблицы 1 видно, что при всех концентрациях аспарагина значение pH раствора близко к 6. При этом значении pH содержание катионной формы составляет 0,0104 %, а анионной 0,158 %, цвиттер-иона – 99,83 %. Высокое содержание цвиттер-иона на значение электрокинетического потенциала гемоглобина не влияет. Несмотря на низкое содержание катионной формы, ее адсорбция на гемоглобине преобладает над адсорбцией анионной формы, что отражается на знаке заряда гемоглобина. В растворах аспарагина электрокинетический потенциал положительный и возрастает с ростом концентрации аспарагина.
Обсудим влияние аспарагина на положение изоэлектрической точки гемоглобина. Для этого было проведено измерение электрокинетического потенциала гемоглобина в HCl и в смешанных растворах HCl + аспарагин с постоянной концентрацией 5*10-4 моль\л. На рис. 5. показана зависимость ζ – рН гемоглобина.
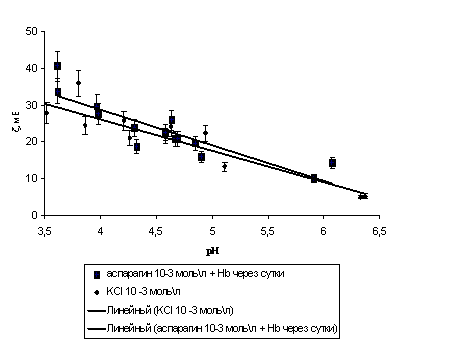
Рис. 5.Зависимость электрокинетического потенциала водной дисперсии
гемоглобина в аспарагине и в KCl от pH
Как следует из рисунка значение pHИЭТ гемоглобина в присутствии аспарагина смещается в щелочную область по сравнению с соляной кислотой, что подтверждает специфическую сорбцию катионной формы аспарагина. С ростом концентрации H+ ионов в растворе кривые сближаются вследствие увеличения роли адсорбции потенциал определяющих ионов водорода.
Выводы
1. Кислотно-основное равновесие для водных дисперсий гемоглобина устанавливается в течение 8 часов.
2. Аспарагин смещает pHИЭТ гемоглобина в щелочную область.
3. Адсорбция катионной формы аминокислоты на гемоглобине преобладает над адсорбцией анионной формы.
Литература:
1. Березин М.Б. Термохимия сольватации хлорофилла и родственных соединений. М.: Красанд. – 2008. – 256с.
2. Nelson, David L. & Cox Michael M. Lehninger. Principles of Biochemistry. 2005.– P.157–174.
3. Carl Branden, John Tooze Introduction to Protein Structure Second Edition. United States: Garland Science. – 1999. – P.40–44.
4. Бриттон Г. Биохимия природных пигментов: Пер. с англ. М.: Мир. 1986. 442с.
5. Филиппович Ю.Б. Основы биохимии: Учеб. для хим. и биол. спец. лед. ун-тов и ин-тов. 4-е изд., перераб. и доп. М.: изд-во "Агар".–1999. – 512с.
6. Дамаскин Б.Б., Петрий О.А., Цирлина Г.А. Электрохимия. 2-ое изд., испр. и перераб. М.: Химия, Колосс. – 2006. – 624с.
7. Фридрихсберг Д.А. Курс коллоидной химии. СПб: Химия.– 1995. – 394c.
8. Покров В.П., Коротько Г.Ф. Физиология человека. М.: «Медицина». – 2001. – 656с.
9. Чухно А.С., Дмитриева И.Б., Мартынов Д.В. Влияние солей одно-, двух- и трехзарядных катионов металлов на сорбцию Н+ и ОН- ионов на декстране. /Бутлеровские сообщения. – 2011. – Т.27, №14. – С.47-54.







