Ключевые слова: «гидридный цикл», сплавы титана, коррозионное растворение, поверхностные энергетические характеристики, донорно-акцепторное взаимодействие.
Благодаря уникальному сочетанию свойств: высокой прочности, малой плотности, высокой коррозионной стойкости и хорошей биосовместимости, сплавы на основе титана нашли широкое применение в качестве конструкционного материала для химического машиностроения, авиастроения, в производстве биоимплантантов для живых организмов, используемых в медицине.
В последнее время в институте химической физики им. А. Б. Налбандяна НАН РА разработан принципиально новый эффективный метод получения сплавов тугоплавких металлов (в том числе и титана), названный “гидридным циклом” [1]. Сущность разработанного метода синтеза сплавов состоит в компактировании смеси гидридов с последующим дегидрированием- спеканием. В настоящее время по этой технологии синтезированы более 100 таких сплавов и интерметаллидов. Однако, ограниченный объем экспериментальных данных по физико-химическим свойствам этих сплавов ограничивает область их применения, тогда как свойства металлов и металлических материалов во многом зависят не только от качественного и количественного состава, но и от способа их получения.
Так, в работе [2] нами было установлено, что химическая устойчивость металлоподобных силицидов, синтезированных методом СВС (самораспостраняющийся высокотемпературный синтез), в ряде агрессивных растворах, в целом на 20–30 % ниже одноименных силицидов, синтезированных из простых веществ печным методом. Способ получения оказывает существенное влияние также на коррозионные свойства металлического титана, полученного различными технологическими способами [3].
Однако гетерогенный процесс коррозионного растворения металлических материалов, как известно, начинается с его поверхности, энергетическое состояние которого во-многом предопределяет интенсивность этого процесса. Поэтому, в данной работе коррозионные характеристики гидридного титана и некоторых его сплавов (Ti0,8 Zr0,2,Ti08Hf02, Ti0,8Zr0,1Hf0,1), синтезированных вышеуказанным методом, нами сопоставлены с поверхностными энергетическими характеристиками этих сплавов. Коррозионные измерения в 40 % серной кислоте проводили гравиметрически и по объему выделившегося водорода при 5–8 час. полном погружении образцов в раствор, при температуре 250С. Результаты этих измерений приведены на рис. 1.
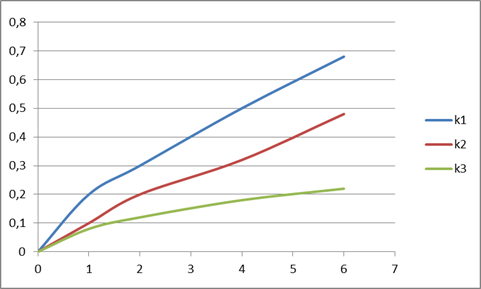
Рис. 1. Кинетика коррозионного растворения титана и его сплавов в 40 % серной кислоте, при температуре 250С: 1 — гидридный титан, 2 — сплав Ti0,8 Zr0,2, 3 — сплав Ti08Hf02
Видно, что введение в металл даже небольших добавок Zr, и, особенно Hf, существенно повышают коррозионную стойкость титана в указанном растворе. При этом, по своей химической устойчивости изучаемые металлические материалы располагаются в ряду:
Ti < Ti08Zr02 < Ti08Hf01Zr01 < Ti08Hf02
Результаты коррозионных измерений подтверждаются также электрохимическими измерениями (рис. 2).
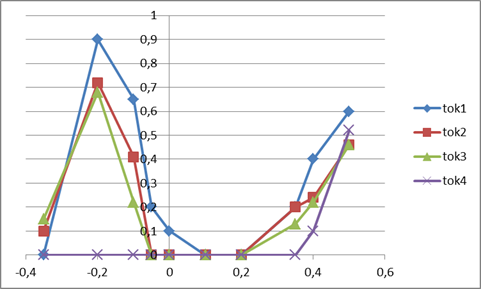
Рис. 2. Анодные поляризационные кривые титана и его сплавов в 40 %-ой серной кислоте при комнатной температуре: 1 — Титан; 2 — Ti08Zr02; 3 — Ti08Hf01Zr01; 4 — Ti08Hf02
Поверхностные энергетические характеристики исследуемых материалов нами определены на основании измерения краевых углов смачивания этих материалов с тестовыми жидкостями, с известными энергетическими характеристиками. Согласно современным представлениям, свободную поверхностную энергию (СПЭ) любого тела можно представить в виде трех составляющих: неполярной Лившица-Ван-дер-Ваальсовой (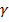 LW) и двух полярных- кислотной (
LW) и двух полярных- кислотной (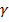 +) и основной (
+) и основной (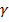 -), обусловленных электроноакцепторными и электронодонорными взаимодействиями твердого тела с жидкостью соответственно. Соотношения между этими компонентами в определяющей степени влияют на поверхностные явления: смачивание, корозию, адсорбцию и адгезию. Взаимосвязь между отдельными компонентами СПЭ выражаются соотношениями:
-), обусловленных электроноакцепторными и электронодонорными взаимодействиями твердого тела с жидкостью соответственно. Соотношения между этими компонентами в определяющей степени влияют на поверхностные явления: смачивание, корозию, адсорбцию и адгезию. Взаимосвязь между отдельными компонентами СПЭ выражаются соотношениями:
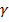 =
= 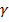 LW
LW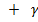 AB (1)
AB (1)
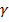 AB = 2√
AB = 2√ 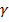 +
+ 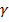 - (2)
- (2)
где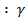 AB донорноакцепторный компонент поверхностной энергии твердых тел.
AB донорноакцепторный компонент поверхностной энергии твердых тел.
Свободная поверхностная энергия образцов и ее составляющие определяли решением системы уравнений предложенным Ван Оссом, Чадхри и Гудом [4], по найденным краевым углам смачивания каждой тестовой жидкостью исследуемых материалов
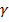 ж.1 = (1 +cos.
ж.1 = (1 +cos.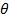 1)= 2(√
1)= 2(√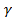 т.LW.
т.LW. 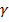 ж.1LW+ √
ж.1LW+ √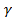 т.+
т.+ 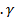 ж.1- + √
ж.1- + √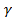 т.-
т.- 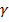 ж.1+)
ж.1+)
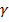 ж.2 = (1 +cos.
ж.2 = (1 +cos.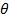 2)= 2(√
2)= 2(√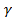 т.LW.
т.LW. 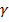 ж.2LW+ √
ж.2LW+ √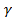 т.+
т.+ 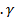 ж.2- + √
ж.2- + √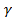 т.-
т.- 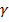 ж.2+) (3)
ж.2+) (3)
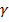 ж3 = (1 +cos.
ж3 = (1 +cos.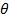 3)= 2(√
3)= 2(√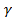 т.LW.
т.LW. 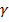 ж.3LW+ √
ж.3LW+ √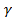 т.+
т.+ 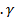 ж.3- + √
ж.3- + √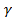 т.-
т.- 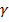 ж.3+)
ж.3+)
Где: 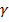 т.LW,
т.LW, 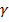 ж.LW — Лившиц-Ван-дер-Ваальсовы компоненты поверхностной энергии соответствующих границ раздела. Нижние индексы “т.” и “ж.” указывают на принадлежность параметров к твердому телу и тестовой жидкости соответственно.
ж.LW — Лившиц-Ван-дер-Ваальсовы компоненты поверхностной энергии соответствующих границ раздела. Нижние индексы “т.” и “ж.” указывают на принадлежность параметров к твердому телу и тестовой жидкости соответственно.
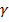 т.+
т.+ 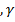 ж.+
ж.+ 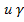 т.-
т.- 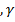 ж.- — компоненты свободной поверхностной энергии, обусловленные электроноакцепторными и электронодонорными взаимодействиями твердого тела с жидкостью.
ж.- — компоненты свободной поверхностной энергии, обусловленные электроноакцепторными и электронодонорными взаимодействиями твердого тела с жидкостью.
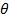 — краевой угол смачивания поверхности твердого тела с тестовой жидкостью. Для определения
— краевой угол смачивания поверхности твердого тела с тестовой жидкостью. Для определения 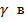 рамках данного подхода необходимы экспериментальные значения краевых углов трех тестовых жидкостей: неполярной жидкости, кислоты Льюиса и основания Льюиса для решения системы из трех уравнений вида (3). В рамках этого метода использовали тестовые жидкости, энергетические характеристики которых приведены в таблица 1.
рамках данного подхода необходимы экспериментальные значения краевых углов трех тестовых жидкостей: неполярной жидкости, кислоты Льюиса и основания Льюиса для решения системы из трех уравнений вида (3). В рамках этого метода использовали тестовые жидкости, энергетические характеристики которых приведены в таблица 1.
Таблица 1
Энергетические характеристики тестовых жидкостей
|
Энергетические характеристики, мДж/м2 |
|||||
|
Тестовые жидкости |
|
|
|
|
|
|
Вода |
72,8 |
21,8 |
51,0 |
25,5 |
25,5 |
|
Глицерин |
64,0 |
34,0 |
30,0 |
3,92 |
57,4 |
|
Формамид |
58 |
39,0 |
19,0 |
2,28 |
39,6 |
|
Дииодметан |
50,8 |
50,8 |
0 |
0 |
0 |
Краевые углы смачивания сплавов с соответствующими тестовыми жидкостями определялись гониометрически, нанесением тестовых жидкостей на поверхность соответствующих образцов.
Анализ расчетно-экспериментальных данных приведены в таблице2.
Таблица 2
Свободная поверхностная энергия и ее компоненты для титана и его сплавов
|
|
|
|
|
|
|
|
|
Ti |
39,12 |
30,2 |
0,96 |
10,76 |
49,88 |
0,21 |
|
Ti0,8Zr0,2 |
30,84 |
26,6 |
2,25 |
15,4 |
46,24 |
0,33 |
|
Ti0,8Zr0,1Hf0,1 |
8,82 |
20,2 |
6,65 |
23,1 |
31,92 |
0,72 |
|
Ti0,8Hf0,2 |
5,37 |
11,7 |
7,99 |
19,3 |
24,67 |
0,78 |
Судя по тому, что добавки как Zr, так и Hf снижают свободную поверхностную энергию титана, можно сделать вывод, что химическая активность этих металлов непосредственно связана с энергетическим состоянием их поверхности. При этом, добавки как Hf так и Zr, в основном влияют на кислотные и основные составляющие СПЭ, что свидетельствует о взаимосвязи между коррозионной и донорно-акцепторной активностью этих сплавов.
Литература:
1. Долуханян С. К., Алексанян А. Г. и др. Новый метод получения сплавов на основе переходных металлов. III Международная конференция по химии и химической технологии. Ереван, 2013, сентябрь 16–20. С. 49–51.
2. Казарян А. Г., Мамян М. П., Хачатрян. э. А. Коррозионностойкие композиционные материалы на основе термореактивных смол и металлоподобных силицидов, синтезированных методом самораспостраняющегося высокотемпературного синтеза// Известия НАН Армении и Гос. Инж. Университета Армении. - Ереван.-Серия тех. наук.-2010, т. 63, январь-март с. 49–54.
3. Хачатрян Э. А., Казарян А. Г. Влияние способа получения металлического титана на его коррозионное поведение в 40 % растворе серной кислоты // Химический журнал Армении. Ереван. 2009, т. 62. № 3–4, с. 291–297.
4. Богданова Ю. Г. Адгезия и ее роль в обеспечении прочности полимерных композитов. Уч. пособие для студентов по специальности “Композиционные наноматериалы”, Москва, 2010.