Изучены качественные и количественные особенности жирнокислотного состава некоторых представителей грамположительных и грамотрицательных бактерий, которые подвергались воздействию замораживания-высушивания. При помощи метода газовой хроматографии выявил наличие у них насыщенных, ненасыщенных жирных кислот и оксикислот с длиной цепи от 12 до 19 углеродных атомов.
Установлено, что на концентрацию жирных кислот микроорганизмов наиболее значительное влияние оказывали температурные факторы, включая условия культивирования и последующее хранение лиофилизированных образцов.
Ключевые слова: микроорганизмы, жирные кислоты, хроматография.
Введение
Большинство методов оценки стабильности лиофилизированных микроорганизмов базируются на определении концентрации живых клеток, расчетах коэффициента выживаемости клеток и динамики гибели клеток с прогнозом предельных сроков их хранения. Относительно небольшим остается удельный вес работ, посвященных изучению постоянства оболочечного комплекса обезвоженных клеток, что важно для правильного выбора качественного и количественного состава защитных сред и понимания молекулярных механизмов инактивации, обратимого восстановления жизненных функций.
Клеточные липиды — одни из многочисленных молекулярных признаков микроорганизмов, которые применяются при изучении их разнообразия. Анализ биоматериала по содержанию жирных кислот дает информацию о родовом и видовом составе присутствующих в нем микроорганизмах. Применительно к лиофилизированным объектам такие исследования нам неизвестны.
Целью работы было изучение условий подготовки бактериальных клеток к высушиванию, температуры, собственно замораживания-высушивания и последующего хранения на качественные и количественные показатели их жирнокислотного (ЖК) состава с использованием методов газовой хроматографии — масс спектрометрии.
Материалы и методы
Микроорганизмы. Исследовали грамположительные (Гр+) и грамотрицательные (Гр-) бактерии из коллекционных штаммов «ГКПМ-Оболенск» ГНЦ ПМБ, представленных видами Bacillus lentus, B.firmus, B.subtilis, B.cereus, B.thuringiensis, Paenibacillus polymyxa, B.anthraces (вакцинный штамм), B.coagulans, Enterococcus faecium, E.faecalis, Listeria monocytogenes, L.inocula, Yersinia pestis (вакцинный штамм) и Escherichia coli.
Питательные среды и условия культивирования. Штаммы бацилл, энтерококков, листерий, эшерихий выращивали на ГРМ-агаре с некоторыми вариациями по составу при 30° С в течение суток. Для сбора микроорганизмов с агаризованной среды в чашку Петри вносили по 5 мл стерильного физраствора и с помощью шпателя Дригальского переводили выросшую биомассу во взвесь, которую затем собирали в стеклянные флаконы с помощью пипетки. Защитные среды сознательно не использовали, так как содержащиеся в них протекторы искажали бы картину исследований ЖК-состава микроорганизмов.
Условия замораживания-высушивания. Флаконы с микроорганизмами замораживали до температуры -50°С в течение 3 часов и затем высушивали в лиофилизаторе Virtis BT-4k (США) в течение 18–22 ч. После высыхания проб флаконы закрывали резиновыми пробками и обкатывали алюминиевыми колпачками. Одни из них закладывали на хранение, другие исследовали сразу.
Хроматографическое определения жирных кислот.
Пробоподготовка образцов включала переэтерификацию липидов — их перевода из глицеридов, фосфолипидов, свободных ЖК и т. д. в единообразную форму метиловых эфиров высших жирных кислот. Полученные эфиры разделяли на газохроматографической колонке и количественно определяли методом внутреннего стандарта [1–3]. Для этого в сосудики отбирали точную навеску высушенной биомассы (от 5,0 до 30,0 мг), к ней прибавляли по 100 мкл внутреннего стандарта — раствора гептадекановой кислоты в сухом метаноле (200–300 мкг/мл). После туда же вносили по 200 мкл 0,5 М раствора едкого натра в сухом метаноле и 50 мкл бензола, плотно завинчивали крышку, помещали в ячейку настольного термостата «Мультиблок», нагретого до 70° С, и выдерживали 20 мин для сапонификации глицеридов и фосфолипидов. Для полного метилирования свободных жирных кислот в смесь в конце добавляли по 1,0 мл 15 % метанольного раствора трехфтористого бора с экспозицией при температуре 80°С в течение 1 часа. Сосудики с реагентами охлаждали, вносили в них по 1,0 мл н-гексана и 1,0 мл дистиллированной воды, интенсивно встряхивали содержимое и оставляли до полного расслоения гексановой и водно-спиртовой фаз. Для хроматографического анализа использовали органическую фазу, содержащую метиловые эфиры бактериальных жирных кислот и внутренний стандарт.
Хроматографирование проводили в кварцевой капиллярной колонке СУПЕЛКОВАКС-100, 12 м х 0,2 мм х 0,2 мкм аналитического газового хроматографа ВАРИАН 3900; газ носитель — гелий (1,2 мл/мин). Режим ввода и анализа проб: объем — 2 мкл; температурная программа — от 100°С (задержка 1 мин) до 240°С (задержка 10 мин); температуры испарителя и детектора — 260°С и 250°С; тип детектора — пламенно-ионизационный, регистрация сигнала — компьютерная программа «Мультихром-1,5х».
Идентификация пиков и определение жирных кислот. В указанных выше условиях регистрировали хроматограммы экспериментального образца и стандартной смеси бактериальных жирных кислот «СУПЕЛКО»; в хроматограмме экспериментального образца идентифицировали хроматографические пики конкретных жирных кислот по их временам удерживания. В тех редких случаях, когда хроматограмма содержит отсутствующие в калибровочной смеси «СУПЕЛКО» пики (например, относящиеся к полиненасыщенным кислотами С20-С22), использовали искусственные калибровочные смеси, составленные из индивидуальных компонентов. В остальных случаях применяли метод внутреннего стандарта (в каждую пробу вводится 20–30 мкг гептадекановой кислоты). Для кислот С10-С14 калибровочный коэффициент — 0,85; для кислот С16-С18 — близок к 1,00; для кислот С20 — к 1,20; для кислот С22 — к 1,45.
Для определения групповых калибровочных коэффициентов хроматографировали смесь, содержащую известные концентрации кислот 14:0, 17:0 (стандарт), 18:0, 20:0, 22:0. Калибровочный коэффициент индивидуальной кислоты Х по 17:0 находили по формуле:
Кx = СхSст /Cст Sх, где:
Сx-концентрация определяемой кислоты Х,
Sст — площадь пика стандарта 17:0,
Ccт — концентрация стандарта 17:0,
Sх — площадь пика определяемой кислоты Х.
Определение относительного (процентного) содержания каждой конкретной жирной кислоты в исследуемой биомассе выполняли по формуле:
Сх = 100KxSxmcт/Sст mобр, где:
Kx — калибровочный коэффициент кислоты Х по внутреннему стандарту (17:0),
Sx — площадь пика определяемой кислоты X,
mcт — масса введенного в пробу стандарта (17:0-кислоты), мкг
Sст — площадь пика стандарта 17:0,
mобр — масса анализируемого образца биологического материала, мкг.
Кроме того, в целях идентификации биологических объектов часто используют не абсолютные величины концентрации той или иной жирной кислоты в биомассе (или, что то же, ее процентные содержания Сх в образце), а так называемые относительные содержания индивидуальных кислот. Сумма всех жирных кислот образца принимается за 100 %, и для каждой индивидуальной кислоты определяется ее доля в этой сумме.
Данный параметр гораздо менее информативен, однако определяется с несколько большей точностью, нежели абсолютные концентрации индивидуальных кислот в исходном образце. Его определение проводят по формуле:
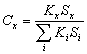 ,
,  где:
где:
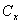 — массовая доля кислоты Х в сумме всех жирных кислот образца,
— массовая доля кислоты Х в сумме всех жирных кислот образца,
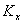 — калибровочный коэффициент кислоты Х по 17:0,
— калибровочный коэффициент кислоты Х по 17:0,
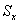 — площадь пика кислоты Х,
— площадь пика кислоты Х,
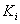 — калибровочный коэффициент i-й кислоты по 17:0,
— калибровочный коэффициент i-й кислоты по 17:0,
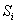 — площадь пика i-й кислоты.
— площадь пика i-й кислоты.
В тех случаях, когда в хроматограмме регистрируются только тривиальные жирные кислоты С16-С18, все калибровочные коэффициенты можно считать равными единице, и в этом случае массовая доля жирной кислоты в смеси жирных кислот равна отношению площади пика этой кислоты к сумме площадей всех пиков жирных кислот хроматограммы. Минимально определяемое количество конкретной жирной кислоты в описанном выше варианте метода составляет около 0,5 мкг.
Для оценки погрешности определения проводили анализ нескольких параллельно приготовленных образцов каждого из исследуемых биологических материалов, после чего с помощью программы «Microsoft Excel» находили величину среднего значения и среднего квадратичного отклонения.
Результаты исследований
Результаты проведенных исследований по изучение условий подготовки бактериальных клеток к высушиванию, температуры, собственно замораживания-высушивания и последующего хранения на качественные и количественные показатели их жирнокислотного (ЖК) состава с использованием методов газовой хроматографии представлены в табл. 1–5.
Таблица 1
Зависимость ЖК состава от рода и вида микроорганизмов
|
Упрощенные обозначения жирных кислот* |
Микроорганизмы и концентрации в них жирных кислот, мг/г |
|||||||
|
B.circulans |
B.lentus |
B.thuringiensis |
E.coli |
E.faecium |
L.inocula |
L.monocetogenes. |
Y.pestis |
|
|
14:0 |
0,12 |
0,81 |
0,21 |
0,13 |
1,90 |
0,016 |
0,03 |
0,02 |
|
12:0 — ОНЗ |
- |
44,5 |
- |
- |
0,02 |
0,08 |
0,02 |
- |
|
12:0 — ОН2 |
- |
0,18 |
- |
0,05 |
0,06 |
- |
0,03 |
|
|
16:0 |
0,32 |
4,8 |
1,33 |
0,55 |
3,9 |
- |
0,03 |
0,28 |
|
16:1 |
- |
0,82 |
0,048 |
0,15 |
2,9 |
0,04 |
- |
0,03 |
|
14:0 — ОНЗ |
2,1 |
- |
- |
- |
- |
0,03 |
- |
|
|
14:0 — ОН2 |
8,1 |
- |
- |
0,08 |
- |
- |
- |
|
|
18:0 |
0,8 |
0,31 |
0,016 |
0,06 |
0,1 |
0,02 |
0,03 |
0,06 |
|
18:1ол |
- |
0,25 |
0,044 |
0,06 |
0,18 |
0,01 |
0,03 |
0,06 |
|
18:1ж |
- |
- |
- |
0,19 |
3,6 |
- |
- |
- |
|
18:2 |
- |
0,19 |
- |
0,03 |
0,03 |
0,01 |
0,03 |
- |
|
18:3г |
- |
0,14 |
- |
- |
- |
- |
- |
- |
|
18:3а |
- |
- |
- |
- |
2,0 |
- |
- |
- |
|
Общая жирность |
1,24 |
6,2 |
1,64 |
0,12 |
1,5 |
0,176 |
0,23 |
0,45 |
|
(*) 12:0 –лауриновая и ее производные, 14:0 — миристиновая и ее производные, 15:0 — пентадекановая, 16:0 — изопальмитиновая, 16:1 — пальмитолеиновая, 18:0 — стеариновая, 18:1ол — олеиновая, 18:2 — линолевая, 18:3а — α-линоленовая, 18:3г — γ-линоленовая |
||||||||
Как следует из данных табл. 1, у грамположительных бактерий, общее количество ЖК оказалось выше, чем у грамотрицательных бактерий (E.coli и Y.pestis). Исключение составили лишь представители рода листерий.
Даже среди штаммов одного вида существуют некоторые отличия по индивидуальным жирным кислотам, что видно из данных табл. 2. Вместе с тем, несомненно, что у штаммов E.faecium имеется специфический и ни на что не похожий состав: необычно присутствие тридекановой ЖК (13:0), стабильно наличие циклопропановых кислот, соотношение четных и нечетных кислот, но отсутствуют линолевая и линоленовая кислоты. Все это позволяет достаточно надежно отличать этот вид бактерий от других — например, в пробах биологических жидкостей. Из анализа данных табл. 2 также следует, что суммарное содержание липидов больше суммы жирных кислот, поскольку включает неидентифицированные минорные их компоненты.
Таблица 2
Сравнение штаммов E.faecium по составу жирных кислот
|
Жирная кислота* |
Штаммы E.faecium и концентрация жирных кислот, вес. % |
|||
|
33.22 |
4Ф |
5Ф |
6Ф |
|
|
12:0 |
0,0082 |
- |
- |
- |
|
13:0 |
0,0484 |
0,0241 |
0,0322 |
0,0304 |
|
14:0 |
0,0204 |
0,0125 |
0,0129 |
0,0027 |
|
15:0 |
0,0027 |
0,0013 |
0,0016 |
- |
|
16:1 |
0,0217 |
0,0423 |
0,0346 |
0,0047 |
|
16:0 |
0,0917 |
0,0219 |
0,0315 |
0,0094 |
|
Δ 17:0 |
0,0349 |
- |
- |
- |
|
18:1 |
0,0325 |
0,0633 |
0,0475 |
0,0068 |
|
18:0 |
0,0027 |
0,0012 |
0,0235 |
0,0173 |
|
18:2 |
- |
- |
- |
- |
|
18:3 |
- |
- |
- |
- |
|
Δ 19:0 |
0,0126 |
0,0030 |
0,0064 |
0,0002 |
|
Сумма, вес. % |
0,32 |
0,19 |
0,24 |
0,12 |
|
16:1/16:0 |
0,237 |
1,931 |
1,098 |
0,500 |
|
18:1/18:0 |
12,0 |
52,8 |
2,021 |
0,393 |
|
13:0/16:0 |
0,53 |
1,10 |
1,02 |
0,393 |
|
(*) 12:0 –лауриновая, 13:0 — тридекановая, 14:0 — миристиновая, 15:0 — пентадекановая, 16:0 –пальмитиновая, 16:1 — пальмитолеиновая, 17:0 — маргариновая, 18:0 — стеариновая, 18:1 — олеиновая, 18:2 — линолевая, 18:3 — линоленовая, 19:0 — нанодекановая |
||||
При исследовании влияния температуры культивирования бактерий на количественный состав жирных кислот было установлено, что если у вакцинного штамма чумного микроба психрофильные условия способствуют некоторому увеличению общей жирности оболочечного комплекса клеток по сравнению с мезофильными, то у грамположительных представителей, B.thuringiensis и L.inocula — наоборот (табл. 3).
Таблица 3
Зависимость ЖК состава микроорганизмов от температуры выращивания
|
Микроорганизм и условия роста |
Общая жирность, вес. % |
Содержание индивидуальных жирных кислот*, % |
|||||
|
14:0 |
16:0 |
16:1 |
18:0 |
18:1 |
18:2 |
||
|
Y.pestis, 4° C |
0,20 |
0,01 |
0,17 |
0,02 |
0,002 |
0,002 |
- |
|
Y.pestis, 37° C |
0,12 |
0,006 |
0,094 |
0,016 |
0,002 |
- |
- |
|
B.thuringiensis, 4° C |
0,47 |
0,060 |
0,39 |
0,013 |
0,002 |
0,010 |
0,001 |
|
B.thuringiensis, 37° C |
0,52 |
0,067 |
0,42 |
0,014 |
0,004 |
0,013 |
- |
|
L.inocula, 4° C |
0,048 |
0,004 |
0,020 |
0,017 |
0,003 |
0,002 |
0,002 |
|
L.inocula, 37° C |
0,055 |
0,005 |
0,023 |
0,020 |
0,003 |
0,002 |
0,002 |
|
(*) 14:0 — миристиновая, 16:0 — изопальмитиновая, 16:1 — пальмитолеиновая, 18:0 — стеариновая, 18:1 — олеиновая, 18:2 — линолевая |
|||||||
На ЖК-состав заметное влияние оказывал и состав питательной среды для культивирования бактерий. Это видно на примере сравнения двух образцов одного штамма B.lentus: один из них выращивали с добавлением дрожжевого экстракта (ДЭ), другой — кукурузного экстракта (КЭ). Так, из данных табл. 4 следует, что если в присутствии дрожжевого экстракта процентное содержание лауриновой, миристиновой, пальмитиновой и пальмитолеиновой кислот было в 2–3 раза выше, то олеиновой и линолевой — в 7–10 раз ниже, чем в среде с кукурузным экстрактом.
Таблица 4
Влияние источника витаминов в среде роста на жирнокислотный состав поверхностного комплекса клеток штамма B. lentusПС-1
|
Источник витаминов в среде |
Содержание индивидуальных жирных кислот*, % |
Общая жирность, % |
|||||||||
|
12:0 |
14:0 |
14:03 |
14:02 |
16:0 |
16:1 |
18:0 |
18:10 |
18:2 |
18:3г |
||
|
ДЭ** |
44,5 |
0,81 |
2,1 |
8,1 |
4,8 |
0,82 |
0,32 |
0,25 |
0,19 |
0,14 |
6,2 |
|
КЭ*** |
10,6 |
0,35 |
0,5 |
1,3 |
3,9 |
0,25 |
0,49 |
1,8 |
1,8 |
0,04 |
2,1 |
|
(*) 12:0 –лауриновая, 14:0 — миристиновая и ее производные, 16:0 –пальмитиновая, 16:1 — пальмитолеиновая, 18:0 — стеариновая, 18:1о — олеиновая, 18:2 — линолевая, 18:3г — γ-линоленовая. (**) дрожжевой экстракт, (***) кукурузный экстракт. |
|||||||||||
Из результатов сравнительных исследований двух лиофилизированных образцов клеток штамма E.coli М17 следует, что тепловое воздействие на клетки в результате хранения при температуре 25–30 °С в течение года приводит к снижению как суммарного, так и индивидуального количества жирных кислот в среднем на 32 % (табл. 4). При этом величина взятого на анализ образца (в пределах 5–10 мг) существенного влияния на конечный результат не оказывает.
Таблица 5
Сравнение жирнокислотного состава двух лиофилизированных образцов E.coli
|
Наименование и количество обнаруженных кислот в пробах E.coli М17, мг % |
||||
|
Жирная кислота |
исходной (контроль) |
хранившейся (опыт) |
||
|
Нав. 8,7 мг |
Нав. 5,6 мг |
Нав. 8,3 мг |
Нав. 6, 1 мг |
|
|
12:0 (лауриновая) |
51 |
52 |
32 |
33 |
|
14:0 (миристиновая) |
98 |
99 |
62 |
65 |
|
15:0 (пентадекановая) |
16 |
18 |
13 |
14 |
|
16:0 (пальмитиновая) |
425 |
450 |
301 |
293 |
|
16:1 (пальмитолеиновая) |
140 |
135 |
77 |
81 |
|
18:0 (стеариновая) |
6,7 |
8,0 |
5,0 |
5,4 |
|
18:1 (олеиновая) |
161 |
170 |
94 |
87 |
|
18:2 (линолевая) |
2,3 |
3,0 |
2,2 |
3,1 |
|
18:3 (α-линоленовая) |
36 |
42 |
30 |
37 |
|
Сумма ЖК |
1085 |
1172 |
736 |
735 |
Заключение и выводы
Анализ жирнокислотного состава бактерий выявил наличие насыщенных, ненасыщенных жирных кислот и оксикислот с длиной цепи от 12 до 19 углеродных атомов (табл. 1). Из полученных данных следует, что разнообразие и концентрации индивидуальных кислот могут заметно различаться не только в зависимости от родовой и штаммовой принадлежности бактерий, но и от состава питательных добавок, используемых при их культивировании (табл. 1–4).
Полученные данные о влиянии факторов культивирования, среды обитания и вида микроорганизмов на жирнокислотный состав их оболочечного комплекса согласуются, в целом, с данными литературных источников [1, 4]. Поскольку интерпретация зависимости жирнокислотного состава от условий получения клеток довольно сложная и полученные данные являются предметом дальнейших исследований, в настоящей работе мы ее не приводим, а ограничимся более очевидными выводами.
Выводы
1. У грамположительных бактерий, общее количество ЖК оказалось выше, чем у грамотрицательных бактерий.
2. Штаммы E.faecium характеризуются необычным для ряда микроорганизмов присутствием тридекановой кислоты, величинами соотношения четных-нечетных кислот и отсутствем линолевой и линоленовой кислот (табл. 3).
3. Температура культивирования и состав питательных веществ отражаются на количественном составе липидного комплекса бактерий (табл. 3, 4).
4. Длительное хранение лиофилизированных клеток бактерий при температуре 25–30 °С приводит к снижению как суммарного, так и индивидуального количества жирных кислот (табл. 5).
Литература:
1. Крымцева Т. А. Минорные жирные кислоты биологических жидкостей урогенитальных органов и их значимость в диагностике воспалительных процессов / Т. А. Крымцева, Г. А. Осипов, Н. Б. Бойко, Я. А. Соколов, A. M. Демина, Т. В. Радюшина, Д. Г. Осипов // Журн. Микробиол. Эпидемиол. Иммун. — 2003. — № 2. — С. 92–101.
2. Blondz, I. Development of fatty acid analysis by chromatography and related techniques// Analitica Chimica Acta. — 2002. –Vol. 465. — Р. 1–37.
3. Knapp, D. R. Handbook of analytical derivatization reactions. — N.Y.: John Wiley and Sons, Inc, 1979. –154 р.
4. Коптева Ж. П. / Моносахаридный и жирнокислотный состав экзополимерного комплекса бактерий-деструкторов защитного покрытия газопровода Ж. П. Коптева, В. В. Занина, М. А. Борецкая, Ю. М. Юмына, А. Е. Коптева, И. А. Козлова // Мікробіол. журн. — 2012.-Т. 74. — № 2. — С. 22–28.







