Перспективным методом извлечения тяжелых металлов из техногенных вод промышленных предприятий является ионная флотация. При разработке теоретических основ и практической реализации данного метода важным представляется применение квантово-химического подхода к выбору реагентов-собирателей для селективного флотационного выделения тяжелых металлов, для моделирования процесса взаимодействия между извлекаемой формой металла и собирателем, образующихся систем «извлекаемая форма металла-реагент-собиратель», изучение форм тяжелых металлов, извлекаемых во время флотационного процесса.
В работах [8, 13, 14] по извлечению катионов металлов из техногенных и сточных вод указывается на то, что эффективными формами их выделения являются либо ионная, либо гидроксидная. При этом авторы не учитывают, что в минерализованных растворах катионы металлов гидратированы и находятся в виде аквакатионов и/или гидроксоаквакатионов, заведомо упрощая теорию процесса извлечения ценных компонентов в соответствии с решаемыми задачами.
В данной работе проведено квантово-химическое исследование эффективных, извлекаемых из техногенных вод в процессе ионной флотации реагентом-собирателем, форм таких металлов, как медь, цинк, железо, марганец на основании расчёта квантово-химических параметров их реакционной способности. Комплекс этих параметров для различных систем, образующихся в процессе ионной флотации, подробно рассмотрен в работах [7, 9–12, 15]. К ним относят абсолютную жесткость ƞ, абсолютную мягкость S, химический потенциалχ, глобальную электрофильность IЕ и локальную электрофильность IЕ+.
Для вычисления абсолютной жесткости и мягкости, химического потенциала реагентов использовали формулы R. Pearswon и R. Parr [3–5]:
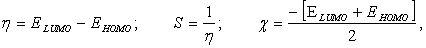
где ЕНОМО и ELUМО — значения энергии граничных орбиталей атомов тяжелых металлов: HOMO — высшая заполненная молекулярная орбиталь, LUMO — низшая свободная молекулярная орбиталь.
При расчётах квантово-химических параметров реакционной способности извлекаемых форм изучаемых металлов было учтено, что их катионы во флотационных системах находятся в виде аквакатионов и аквагидроксокомплексов, т. е. они, согласно концепции R. Pearson и R. Parr [3, 5], в реакциях комплексообразования с реагентами-собирателями являются кислотами Льюиса, содержащими электрофильные центры с электроноакцепторными свойствами. Количественно электрофильность (и реакционную способность) различных извлекаемых форм, согласно R. Parr [4], можно оценить, используя индекс глобальной электрофильности IЕ, который рассчитывается, как 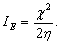 В сложных по составу извлекаемых формах изучаемых металлов более значимым критерием, характеризующим способность металла к электрофильной атаке при взаимодействии с реагентом-нуклеофилом является индекс локальной электрофильностиIЕ+, его рассчитывали значения с учетом функции Фукуи [1]
В сложных по составу извлекаемых формах изучаемых металлов более значимым критерием, характеризующим способность металла к электрофильной атаке при взаимодействии с реагентом-нуклеофилом является индекс локальной электрофильностиIЕ+, его рассчитывали значения с учетом функции Фукуи [1] 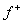 :
: 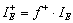 .
.
Расчеты квантово-химических параметров проводились полуэмпирическим методом РМ3 в приближении RHF/6–311G(d) [2]. Полученные результаты представлены в табл. 1.
Таблица 1
Рассчитанные квантово-химические параметры реакционной способности
для различных форм тяжелых металлов, извлекаемых из водных растворов
|
Извлекаемые формы металлов |
ЕНОМО |
ELUМО |
η, эВ |
χ,эВ |
Ѕ, эВ-1 |
IЕ, эВ |
IЕ+, эВ |
|
Zn2+ |
* |
-18,532 |
- |
- |
- |
- |
- |
|
Cu2+ |
-48,159 |
-28,194 |
19,965 |
38,177 |
0,050 |
36,501 |
- |
|
Fe2+ |
-41,692 |
-27,589 |
14,103 |
34, 641 |
0,071 |
42,544 |
- |
|
Fe3+ |
-57,190 |
-43,029 |
14,161 |
50,110 |
0,071 |
88,659 |
- |
|
Mn2+ |
-41,898 |
-28,726 |
13,172 |
35,312 |
0,076 |
47,33 |
- |
|
Zn(OH)2 |
-11,589 |
-0,162 |
11,427 |
5,876 |
0,089 |
1,511 |
0,783 |
|
Cu(OH)2 |
-11,510 |
-0,275 |
11,230 |
5,893 |
0,089 |
1,546 |
0,658 |
|
Fe(OH)2 |
-11,361 |
-0,623 |
10,738 |
5,992 |
0,093 |
1,672 |
0,582 |
|
Fe(OH)3 |
-10,744 |
-0,891 |
9,853 |
5,818 |
0,102 |
1,718 |
0,339 |
|
Mn(OH)2 |
-10,562 |
-1,299 |
9,263 |
5,931 |
0,108 |
1,900 |
0,193 |
|
[Zn(H2O)6]2+ |
-21,484 |
-9,648 |
11,836 |
15,566 |
0,085 |
10,236 |
3,050 |
|
[Zn(H2O)4]2+ |
-23,268 |
-10,891 |
12,377 |
17,080 |
0,081 |
11,785 |
5,480 |
|
[Zn(H2O)2]2+ |
-25,081 |
-13,626 |
11,455 |
19,354 |
0,087 |
16,350 |
12,083 |
|
[Cu(H2O)6]2+ |
-18,761 |
-9,171 |
9,590 |
13,966 |
0,104 |
10,169 |
0,539 |
|
[Cu(H2O)4]2+ |
-20,242 |
-10,602 |
9,640 |
15,422 |
0,104 |
12,336 |
1,209 |
|
[Cu(H2O)2]2+ |
-27,324 |
-14,283 |
13,041 |
20,804 |
0,076 |
16,594 |
3,713 |
Примечание: «-» обозначает, что расчёты не проводились; *- параметризация полуэмпирических методов не позволяет определять энергии ЕНОМО диамагнитных ионов с закрытой электронной оболочкой
Проанализировав полученные результаты, можно отметить, что катионы металлов, за исключением Zn2+ (диамагнитный ион), характеризуются высокими значениями абсолютной жёсткости и химического потенциала (эВ): от 19,965 и 38,177 (Cu2+) до 13,172 и 35,312 (Mn2+), соответственно. Наибольший химический потенциал наблюдается у ионов Fe3+ (50,110 эВ). Такие высокие значения η и χ катионов металлов говорят об их значительной химической активности и о склонности к электрофильным свойствам. Химический потенциал всех исследуемых гидроксоаквакомплексов металлов примерно одинаков и составляет -6 эВ, что говорит об одинаковой абсолютной электроотрицательности молекул, находящихся в гидроксидной форме извлечения.
Абсолютная жёсткость гидроксидов марганца (II), железа (II, III), меди (II) и цинка меняется в пределах 9,263–11,43 эВ. Абсолютная жёсткость молекулы Cu(OH)2 (11,23 эВ) на 1,64 эВ больше, чем у аквакатионов [Cu(H2O)6]2+, в виде которых ионы меди (II) преимущественно находятся в кислых растворах, что позволяет говорить о большей жёсткости меди (II) в структуре Cu(OH)2 и, следовательно, о большей эффективности взаимодействия гидроксида меди (II) с органическими реагентами согласно принципу Пирсона [3, 5]. Подтверждением вышесказанного может служить сравнение рассчитанных индексов IЕ+ меди (II) в извлекаемых формах: реакционная способность Cu(OH)2 выше, чем у [Cu(H2O)6]2+, так как 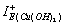 больше
больше 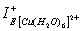 на 0,12 эВ, следовательно, доминирующей формой извлечения ионов Cu2+ будет гидроксидная.
на 0,12 эВ, следовательно, доминирующей формой извлечения ионов Cu2+ будет гидроксидная.
Для ионов Zn2+, ввиду их диамагнитных свойств, возможные извлекаемые формы цинка Zn(OH)2 и [Zn(H2O)6]2+ характеризуются близкими значениями абсолютной жёсткости: 11,427 эВ и 11,836 эВ. Однако химический потенциал ионов цинка в аквакатионной форме значительно выше (15,566 эВ), чем в гидроксидной форме (5,876 эВ), что позволяет прогнозировать и большую реакционную способность [Zn(H2O)6]2+ во флотационной системе в сравнении с Zn(OH)2. Это подтверждается и значениями индексов локальной электрофильности цинка в указанных формах: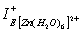 >
>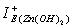 на 2,3 эВ. Так как χ [Zn(H2O)6]2+> χ [Cu(H2O)6]2+на 1,6 эВ, можно предположить, что активность цинка в аквакатионной форме выше, чем у меди в такой же форме.
на 2,3 эВ. Так как χ [Zn(H2O)6]2+> χ [Cu(H2O)6]2+на 1,6 эВ, можно предположить, что активность цинка в аквакатионной форме выше, чем у меди в такой же форме.
Значение индекса локальной электрофильности Mn2+ (0,193 эВ) — самое низкое в представленном ряду, что может свидетельствовать о его меньшей активности при взаимодействии с нуклеофильными центрами реагентов-собирателей. Вероятно, его извлечение методом ионной флотации будет неэффективным из-за слабой реакционной способности марганца (II) по отношению к нуклеофильным центрам реагентов.
Общая или глобальная электрофильность гидроксидов металлов первого переходного ряда снижается от Mn(OH)2 кZn(OH)2, что указывает на уменьшение в данном ряду положительной электростатической составляющей энергии межмолекулярных взаимодействий: гидроксид Ме: Mn(OH)2>Fe(OH)3>Fe(OH)2>Cu(OH)2>Zn(OH)2
IЕ, эВ: 1,900 1,718 1,672 1,546 1,511
Согласно W. Yang и W. Mortier [6], возникновение конкуренции между гидроксидами переходных металлов при их взаимодействии с молекулами реагентов-нуклеофилов возможно при разнице значений электрофильности гидроксидов не менее 0,4 эВ. Выполнение этого условия позволит проводить селективное извлечение металлов из растворов. Так как в приведенном выше ряду разница значений электрофильности даже между крайними членами ряда — Mn(OH)2 и Zn(OH)2 — меньше 0,4 эВ, возможно только коллективное извлечение гидроксидных форм изучаемых субстратов, их последовательное избирательное взаимодействие с органическим реагентом невозможно.
При сравнении полученных результатов квантово-химических исследований субстратов Mn(OH)2, MnO(OH) и MnO(OH)2 отмечаются следующие зависимости: а) абсолютная жесткость субстратов увеличивается в ряду Mn(OH)2>MnO(OH) >MnO(OH)2, что позволяет выделить молекулы MnO(OH) и MnO(OH)2 как наиболее стабильные и конформационно устойчивые структуры во флотационной системе.
Выводы:
- Абсолютная жёсткость молекулы Cu(OH)2 (11,23 эВ) больше, чем у иона [Cu(H2O)6]2+ (9,59 эВ), на 1,64 эВ, и индекс локальной электрофильностиCu(OH)2 выше, чем у [Cu(H2O)6]2+ на 0,12 эВ, что позволяет говорить о бóльшей реакционной способности гидроксида меди (II) по отношению к нуклеофильным центрам хемосорбции реагентов.
- Для ионов Zn2+, ввиду их диамагнитных свойств, извлекаемые формы Zn(OH)2 и [Zn(H2O)6]2+ характеризуются близкими значениями абсолютной жёсткости (11,427 эВ и 11,836 эВ, соответственно). Однако при взаимодействии с нуклеофильными центрами реагентов преимущество имеет гидратированная структура цинка, т. к. для нее 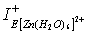 больше
больше 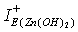 на 2,3 эВ.
на 2,3 эВ.
- Среди изученных катионов металлов самое низкое значение индекса локальной электрофильности у катионов Mn2+ (0,193 эВ), что свидетельствует о его низкой электрофильной активности при взаимодействии с нуклеофильными центрами реагентов-собирателей.
Литература:
1. Ayers P. W., Parr R. G. Variation Principles for Describing Chemical Reactions: The Fukui Function and Chemical Hardness Revisited // J. Am. Chem. Soc. 2000. V. 122. P. 2010.
2. Chattaraj P. K., Maiti В., Sarkar U. A Unified Treatment of Chemical Reactivity and Selectivity // J. Phys. Chem. 2003. V. 107. P. 4973–4975.
3. Parr R. G., Pearson R. G. Absolute hardness: companion parameter to absolute electronegativity // J. Am. Chem. Soc. 1983. V. 105. P. 7512–7516.
4. Parr R. G., Szentpaly L., Liu S. Electrophilicity Index // J. Am. Chem. Soc. 1999. V. 121. Р. 1922–1930.
5. Pearson R. G. Chemical hardness and density functional theory // J. Chem. Ski. 2005. V. 117. № 5. P. 369–377.
6. Yang W., Mortier W. J. The use of global and local molecular parameters for the analysis of the gas-phase basicity of amines // J. Am. Chem. Soc. 1986. V. 108. Р. 5708–5712.
7. Влияние квантово-химических параметров органических соединений на их сорбционные свойства / Варламова И. А., Гиревая Х. Я., Калугина Н. Л., Медяник Н. Л. Депонированная рукопись № 110-В2009. 26.02.2009.
8. Гольман A. M. Ионная флотация. М.: Недра, 1982. 144 с.
9. Изучение свойств органических молекул квантово-химическими методами / Медяник Н. Л., Калугина Н. Л., Варламова И. А., Гиревая Х. Я., Бодьян Л. А. Депонированная рукопись № 224-В2013 01.08.2013
10. Медяник Н. Л., Варламова И. А., Калугина Н. Л. Квантово-химический метод подбора органических реагентов-комплексообразователей для селективного извлечения катионов цинка и меди (II) из растворов // В сборнике: Химия. Технология. Качество. Состояние, проблемы и перспективы развития. Сборник материалов международной заочной научно-технической конференции. Под ред. Медяник Н. Л.. 2012. С. 3–12.
11. Методология создания ресурсовоспроизводящих технологий переработки техногенного гидроминерального сырья / Медяник Н. Л., Калугина Н. Л., Варламова И. А., Строкань А. М. // Вестник Магнитогорского государственного технического университета им. Г. И. Носова. 2011.№ 1. С. 5–9.
12. Прогнозирование флотационной активности реагентов для извлечения цинка и меди (II) по квантово-химическим дескрипторам / Медяник Н. Л., Варламова И. А., Калугина Н. Л., Строкань А. М. // Известия высших учебных заведений. Горный журнал. 2011. № 3. С. 83–89.
13. Радушев А. В., Чеканова Л. Г., Гусев В. Ю. Гидразиды и 1,2-диацилгидразиды. Получение, свойства и применение в процессах концентрирования металлов. Екатеринбург: Уральский центр академического обслуживания, 2010. 140 с.
14. Скрылев Л. Д., Cазонова В. Ф., Скрылева Т. Л. Влияние растворимости сублата на эффективность флотационного выделения ионов тяжелых металлов, собранных с помощью жирнокислотных собирателей // Химия и технология воды. 1992. Т. 14. № 5. С. 386–389.
15. Физико-химические закономерности извлечения тяжелых металлов из техногенных гидроминеральных месторождений / Варламова И. А., Гиревая Х. Я., Калугина Н. Л., Куликова Т. М., Медяник Н. Л. Магнитогорск, 2010.







