Не секрет, что полноценное и адекватное решение многих проблем клинической медицины в значительной степени определяется степенью осведомлённости о микроскопическом строении соответствующего органа, а помогают в решении подобных задач специальные морфологические методы исследования, суть которых заключается в изготовлении каким-либо способом тонких срезов биологических тканей с дальнейшим их окрашиванием и изучением при помощи светового микроскопа [2, 4, 6, 7].
В экспресс-диагностике биопсийного и операционного материала, при изучении ферментов и в отдельных иммуногистохимических исследованиях достаточно распространённым является способ замораживания тканей с последующим изготовлением срезов толщиной 10–30 мкм. Но, к сожалению, полученные таким образом гистологические препараты зачастую непригодны для изучения при больших увеличениях светового микроскопа из-за неминуемой деформации тканевых структур при замораживани-оттаивании и значительной толщины гистологических срезов [2, 6].
Сегодня достаточно распространёнными остаются заливка тканей в парафин, целлоидин и желатин, позволяющие получать более “показательные” гистологические препараты с использованием большого разнообразия способов окраски, проводить иммуногистохимические исследования. Однако недостатком таких методик является посредственное качество сохранения тканевых структур и относительно небольшая площадь гистологических срезов [4, 7].
В то же время наилучшая сохранность тканевых структур достигается при заливке тканей в эпоксидные смолы с последующим изготовлением полутонких срезов [3], которые целесообразно использовать для изучения тканевых элементов при максимально возможных разрешениях световой микроскопии и для пространственной реконструкции гистологических объектов. Но полутонкие срезы имеют крайне малую площадь, редко превышающую 5х4мм.
В представленном контексте отдельного внимания заслуживает способ заключения биологических тканей в эпоксидную смолу для макро-микроскопических исследований с изготовлением гистотопографических шлифов. Как отмечают исследователи, такой способ подготовки препаратов для тонкого микроскопического изучения биологических объектов с большой обзорной поверхностью позволяет проводить комплексное, многоуровневое исследование, изучая в единстве разнородные по плотности тканевые комплексы, состоящие из мягких и твёрдых структур (хрящевые, костные), без предварительной их декальцинации [5]. По этой методике уже проведены оригинальные исследования строения различных органов и тканей в норме и при патологии [1, 8].
Недостатками такого способа являются, в ряде случаев, трудности получения достаточно тонкого шлифа с абсолютно плоской поверхностью, что осложняет изучение гистологических структур при максимальных разрешениях световой микроскопии, ограничение использования широкого спектра гистологических окрасок, применение которых возможно на полутонких срезах.
Целью нашей работы стало усовершенствование способа изучения гистологических структур на гистотопографических шлифах, полученных по вышеупомянутой методике заключения биологических тканей в эпоксидную смолу для макро-микроскопических исследований.
Согласно нашим рекомендациям, после предварительного исследования на макро-микроскопическом уровне и при небольших увеличениях светового микроскопа гистотопографических шлифов, при помощи бинокулярной лупы на них выбирается один или несколько участков размером около 3х4 мм для дальнейшего, более детального изучения при больших увеличениях светового микроскопа. Под контролем бинокулярной лупы, лезвием безопасной бритвы эти фрагменты вырезаются со шлифа с последующим их наклеиванием ЕПОНом-812 на заранее изготовленные эпоксидные блоки, подобные используемым в электронной микроскопии [11].
После застывания эпоксидной смолы с наклеенных фрагментов при помощи ультрамикротома, с использованием стеклянных ножей, получаются полутонкие срезы толщиной 2–3 мкм, достаточно легко окрашивающиеся различными способами, разработанными для полутонких срезов [6].
Описанная методика была использована нами при изучении строения отдельных участков языка и тройничного узла человека во внутриутробном периоде развития.
В частности, после установления на продольных гистотопографических шлифах языков топографии зобно-глоточного протока (ЗГП), представленного системой разнонаправленных трубчатых разветвлений в области корня языка [10] (Рис. 1), на полутонких срезах соответствующего фрагмента гистотопографического шлифа проводилось изучение строения слизистой оболочки (СО) ЗГП.
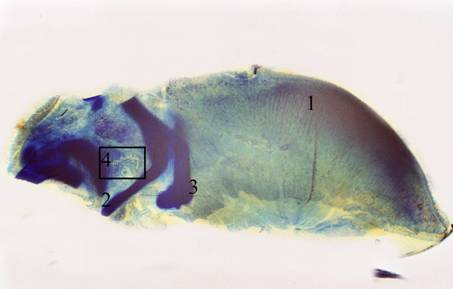
Рис. 1. Продольный шлиф языка на 18–20 неделях внутриутробного развития (саггитальная плоскость). Окраска метиленовым синим. Макросъёмка: объектив f=50мм, Pancolar, растяжение меха 75 мм. 1 — тело языка; 2 — зачаток подъязычной кости; 3 — зачаток щитовидного хряща; 4 — фрагменты зобно-глоточного протока, в последующем изучавшиеся на полутонких срезах
Оказалось, что клеточный состав её эпителия отличается в разветвлениях различных размеров. Так, в больших из них СО покрыта многорядным полиморфнофункциональным эпиетелием, несколько напоминающим таковой дыхательных путей. Среди его клеточных элементов постоянно встречались довольно крупные, вытянутые эпителиоциты с ресничками на апикальной поверхности; эпителиоциты, подобные по форме и размеру предыдущим, но лишенные ресничек; базальные клетки.
В более мелких разветвлениях ЗГП клеточный состав эпителия СО был подобен таковому в мелких междольковых выводных протоках слюнных желез. Отчётливо прослеживалось двухслойное расположение клеток: внутренний слой представлен эпителиоцитами призматической формы, а наружный составляют клеточные элементы, подобные миоэпителиоцитам (Рис. 2).
На гистотопографических шлифах височной кости изучено строение тройничной полости, её взаимооотношение с окружающими анатомическими структурами (Рис. 3) [9], а полутонкие срезы, прицельно изготовленные с тканей тройничного узла, позволили достаточно детально изучить строение его капсулы, локализацию кровеносных микрососудов, охарактеризовать клеточные элементы.
Установлено, что на 16–23 неделях фетогенеза, капсула тройничного узла человека образована сращением периневрия ствола тройничного нерва с листками твёрдой оболочки головного мозга.
В составе капсулы определяется два слоя (внутренний и наружный), отличающиеся плотностью компоновки клеточных и фибриллярных структур. Нейроциты тройничного узла в изучаемый период имеют существенные отличия по размерам и тинкториальным свойствам, что позволяет, на основании перечисленных признаков, разделить последние на несколько групп (Рис. 4).
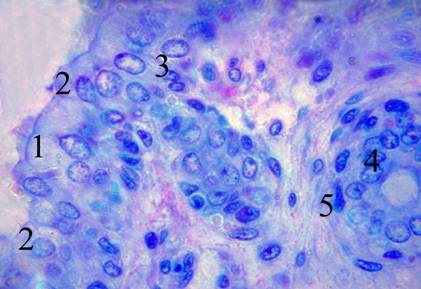
Рис. 2. Строение зобно-глоточного протока на 18–20 неделях внутриутробного развития. Полутонкий срез. Окраска полихромным методом. Об. 100х, ок. 10х. 1 — реснитчатые клетки; 2 — безреснитчатые клетки; 3 — базальные клетки; 4 — эпителиоциты внутреннего слоя мелкого ответвления зобно-глоточного протока; 5 — миоэпителиальные клетки
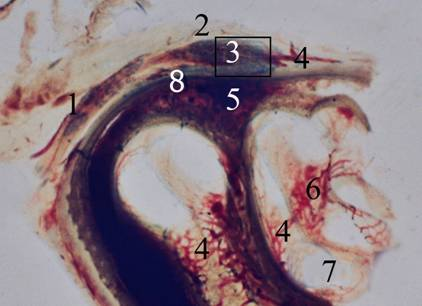
Рис. 3. Шлиф пирамидки височной кости на 20–23 неделях внутриутробного развития (парасаггитальная плоскость). Окраска метиленовым синим. Макросъёмка: объектив f=50мм, Pancolar, растяжение меха 110 мм. 1 — ствол тройничного нерва; 2 — верхняя пластинка твёрдой оболочки головного мозга; 3 — тройничный узел, в последующем изучавшийся на полутонких срезах; 4 — кровеносные сосуды венозного типа; 5 — костное вещество пирамидки височной кости; 6 — стержень улитки; 7 — спиральный канал улитки
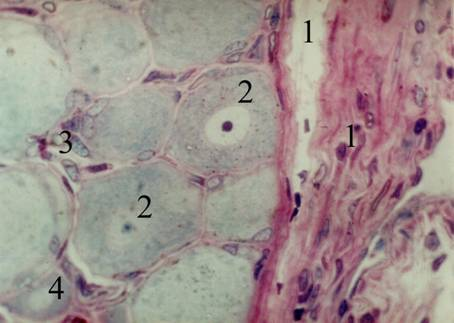
Рис. 4. Строение тройничного узла человека на 20–23 неделях внутриутробного развития. Полутонкий срез. Окраска полихромным методом. Об. 100х, ок. 10х. 1 — капсула узла; 2 — крупные нейроциты; 3 — мантийные клетки; 4 — мелкий нейроцит
Таким образом,положительный эффект представленного способа изготовления полутонких срезов заключается в возможности предварительного изучения гистологических структур на макро-микроскопическом уровне с последующим исследованием выбранных структур при максимальных увеличениях светового микроскопа с применением широкого спектра гистологических красителей.
Литература:
1. Гринь В. Г. Будова ілеоцекального відділу кишечнику людини з інтактним апендиксом та після апендектомії: автореф. дис. на здобуття вченого ступеня канд. мед. наук: спец. 14.03.01 «нормальна анатомія» / В. Г. Гринь — Харків, 2013. — 18с.
2. Коржевский Д. Е. Теоретические основы и практическое применение методов иммуногистохимии / Д. Е. Коржевский, О. В. Кирик, М. Н. Карпенко — Санкт-Петербург, 2012. — 112 с.
3. Костиленко Ю. П. Методы работы с полутонкими эпоксидными срезами в гистологической практике / Ю. П. Костиленко, Е. В. Ковалёв — Архив анатомии, гистологии, эмбриологии. — 1978. — Т.75, В.12. — С. 68–72
4. Меркулов А. Б. Курс патогистологической техники / А. Б. Меркулов — Л.: Медицина, 1969. — 237 с.
5. Метод изготовления гистологических препаратов, равноценных полутонким срезам с большойобзорной поверхности, для многоцелевых морфологических исследований / Ю. П. Костиленко, И. В. Бойко, И. И. Старченко [и др.] // Морфология. — 2007. — № 5. — С. 94–96
6. Райхлин Н. Т. Ультраструктура опухолей человека / Н. Т. Райхлин, Г.Давид, К.Лапиш — Москва, 1981. — 552 стр.
7. Ромейс Б. Микроскопическая техника / Б.Ромейс; [пер. с нем. В. Я. Александрова, З. И. Крюкова]. — М.: И–Л., 1953. — 716 с.
8. Старченко І.І. Морфологічна характеристика динаміки топологічних перетворень зародкових структур зубних зачатків у внутрішньоутробному розвиту людини: автореф. дис. на здобуття вченого ступеня док. мед. наук: спец. 14.03.01 «нормальна анатомія» / І.І.Старченко — Харків, 2010. — 32 с.
9. Старченко И. И. Особенности топографии тройничного узла человека во внутриутробном периоде развития / И. И. Старченко, Ю. Н. Витко — Вісник проблем біології і медицини. — 2013. — Вип. 1. Т. І — С. 208–210
10. Ткаченко П.І. Про походження та морфологічні відмінності щито-язичної і зобно-глоткової проток як анатомічних утворень, що можуть стати джерелом розвитку кіст шиї / П.І.Ткаченко, І.І.Старченко, С. О. Білоконь — Вісник проблем біології і медицини. — 2014. — Вип. 2. Т. 2 — С. 179–182
11. Уикли Б. Электронная микроскопия для начинающих / Б. Уикли; [пер. с анл. И. Викторовой]. — М.: Мир, 1974. — 324 с.







