Величина ионной проводимости является важной характеристикой для материалов катодов электрохимических батарей, суперконденсаторов и твердотельных газовых сенсоров [1]. В настоящее время исследователи все чаще прибегают к компьютерному моделированию для предсказания свойств, исследования важных феноменов в данных материалах [2]. При рассмотрении ионной проводимости в структурах со сложной топологией путей миграции катионов возникает проблема с рассмотрением большого числа различных механизмов и направлений ионной проводимости. Авторами предложен перспективный подход, основанный на совместном использовании метода кристаллохимического анализа (программный пакет TOPOS) и теории функционала плотности (DFT), позволяющие избежать рассмотрения всего числа данных вариантов механизмов ионной проводимости, уменьшить количество рассматриваемых случаев, сэкономить время и компьютерные ресурсы [3,4]. Использование данного подхода продемонстрировано на примере LiFePO4 и LiCoO2 — в результате построены топологии путей миграции катионов, предсказанные ранее в литературе методами DFT и молекулярной динамики [5,6].
Ключевые слова: кристаллохимический анализ, твердые электролиты, электрохимические батареи, суперконденсаторы, твердотельные газовые сенсоры.
Разработка электрохимической батареи для каждого конкретного применения является нетривиальной задачей [7]. Несмотря на то, что LiCoO2 является несомненно лучшим по величине удельной запасаемой энергии, для применений в системах транспортных средств, все большее значение приобретает значение удельной мощности, безопасности и срок службы. Поэтому возникает интерес к получению и изучению свойств твердых электролитов [8,9]. Перспективными объектами исследования являются свойства материалов в наносостоянии [10–12]. Среди методов получения материалов наиболее распространенными являются золь-гель и гидротермальный методы [13–15].
Ясное понимание механизмов диффузии катионов в материалах катодов электрохимических батарей необходимо для увеличения удельной мощности данных материалов и понимания соотношений структура-свойство [16]. Использование метода DFT и молекулярной динамики широко используется для данных целей. Однако, в структурах со сложной топологией путей миграции возникают сложности с рассмотрением большого числа механизмов и направления осуществления ионной проводимости, в связи с чем возрастает длительность и ресурсоемкость компьютерных расчетов. В данной работе нами предложен комбинированный подход, сочетающий использование метода кристаллохимического анализа (программный пакет TOPOS) и метода DFT. При использовании данного метода возникают некоторые сомнения — LiCoO2, в структуре которого Li+ обладает высокой ионной подвижностью, не способен быть ионным проводником согласно данному методу. Наличие ионной проводимости программный пакет TOPOS не показал ни при анализе его нами, ни другими авторами [17]. Пустоты оказываются 0-координированными. Такая же ситуация наблюдается для LiFePO4, для которого известно, что он обладает наименьшей энергией активации 0,55 эВ вдоль направления [010] [5]. Только изменение радиуса сферического домена Rsd пустот с 1,38 Å на 1,20 Å позволяет построить верные пути миграции для Li (рис. 1) [18]. Полученный нами с использованием кристаллохимического анализа вид путей миграции Li вдоль направления [010] преобладает над направлениями [001] и [101]. Данный вид согласуется с результатами расчетов методом молекулярной динамики авторов [5], однако при этом подход с использованием программного пакета TOPOS является существенно более производительным, поскольку основывается на использовании более экономичных алгоритмов, анализирующих топологию. Аналогично для LiCoO2 помимо уменьшения радиуса сферического домена Rsd пустот до 1,20 Å требуется также уменьшение радиуса каналов Rad с 1,85 Å до 1,70 Å. Вид путей миграции Li+ для данного материала также является преобладающим и согласуется с результатами, полученными авторами с использованием метода DFT (рис. 2) [6]. Из рис. 2 видно, что механизм ионной проводимости осуществляется не строго в плоскости катионов Li, а перемещаясь через центр тетраэдра, образованного атомами кислорода. В данном случае нам также удалось получить вид наиболее энергетически выгодной топологии каналов миграции Li+ без использования ресурсоемких компьютерных расчетов.
Ранее не проводилось исследование значения параметров радиуса сферического домена пустот Rsd и радиуса каналов Rad с использованием метода DFT. Значения радиуса сферического домена пустот Rsd и радиуса каналов Rad предположительно имеют следующий смысл: первый характеризует доступность пустот для Li+, второй — доступность каналов, соединящих данные пустоты с позицией Li+ [18]. Более наглядно это можно объяснить на рис. 3, где высота потенциального барьера A характеризуется величиной Rad, B — величиной Rsd. Данные характеристики предполагается исследовать в дальнейшем методом теории функционала электронной плотности.
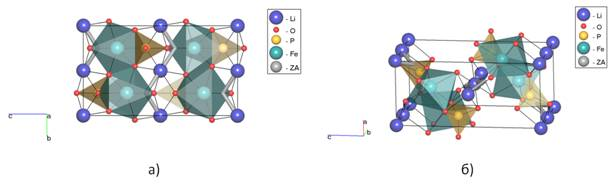
Рис. 1. Изображение путей миграции Li+ в LiFePO4, полученное методом кристаллохимического анализа с использованием программного пакета TOPOS, где ZA — центры пустот
Материал катода электрохимических батарей должен удовлетворять требованиям к удельной плотности энергии, безопасности, стоимости и скорости заряда-разряда [19]. Для выполнения последнего требования энергия активации ионной проводимости не должна превышать 650 мэВ [13]. Метод DFT с использованием программного пакета SIESTA позволяет ученым делать выбор между точностью и производительностью расчетов с помощью размера выбираемого базиса (DZP, soft-confined и др.) [20–21]. Кроме того, имеются публикации, в которых демонстрируется, что высоту энергетического барьера для определения энергии активации ионной проводимости достаточно определить в точке посредине между позициями, участвующими в процессе ионной проводимости [22]. В этом случае ион, зафиксированный в данной точке, имел возможность свободно перемещаться в направлении перпендикулярно пути миграции. Такое рассмотрение с использованием расчета энергии активации ионной проводимости только лишь в одной точке, в сочетании с выбором базиса и использованием программы TOPOS способно довести счет рассматриваемых соединений до тысячи — намного больше, чем возможно синтезировать в лаборатории и реализовать так называемый high-throughput подход [13]. К тому же после определения перспективных соединений исследователи будут способны сосредоточиться на получении ограниченного их числа. В приведенных публикациях авторы вынуждены рассматривать множество механизмов и топологий пути миграции катионов и в каждом случае выполнять ресурсоемкий расчет методом DFT, использование же данного подхода позволяет сразу начать с рассмотрения преобладающего случая, что значительно экономит ресурсы.
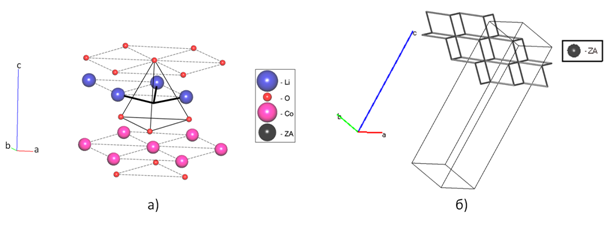
Рис. 2. Изображение путей миграции Li+ в LiCoO2, полученное методом кристаллохимического анализа с использованием программного пакета TOPOS, где ZA — центры пустот
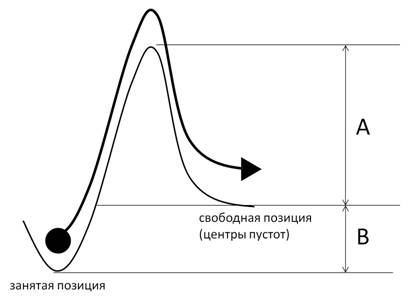
Рис. 3. Предполагаемое нами условное изображение миграции Li+ в различных соединениях, где высота потенциального барьера A предположительно характеризуется величиной Rad, B — величиной Rsd
На примере LiFePO4 и LiCoO2 продемонстрирована способность кристаллохимического подхода (программный пакет TOPOS) определять наиболее энергетически выгодные пути миграции катионов. На основе данного наблюдения предложен комбинированный подход, позволяющий существенно экономить компьютерные ресурсы при расчете количественных характеристик твердых электролитов из первых принципов.
Продемонстрированные подходы и методы могут быть использованы для прогнозирования свойств новых твердых электролитов, так и повышения удельных характеристик существующих.
Литература:
1. Guyomard D., in New Trends in Electrochemical Technology: Energy Storage Systems in Electronics, ed. Osaka T. and Datta M., Gordon and Breach Publishers, Philadelphia, 2000, ch. 9.
2. http://www.greencarcongress.com/2014/06/20140609-mit.html
3. Blatov V. A. Multipurpose crystallochemical analysis with the program package TOPOS // IUCr CompComm Newsletter, 2006, pp. 4–38.
4. Anurova N. A., Blatov V. A., Ilyushin G. D., Blatova O. A., Ivanov-Schitz A. K., Dem’yanets L. N. Migration maps of Li+ cations in oxygen-containing compounds // Solid State Ionics, 2008, Vol. 179, Iss. 39, pp. 2248–2254.
5. Islam M. S., Driscoll D. J., Fisher C. A. J. and Slater P. R. Atomic-Scale Investigation of Defects, Dopants, and Lithium Transport in the LiFePO4 Olivine-Type Battery Material // Chemistry of Materials, Vol. 17, Iss. 20, pp. 5085–5092.
6. Van der Ven A., Ceder G. Lithium diffusion mechanisms in layered intercalation compounds // Journal of Power Sources, 2001, Vol. 97–98, pp. 529–531.
7. http://batteryuniversity.com/learn/article/types_of_lithium_ion
8. Тихонов П. А., Попов В. П., Арсентьев М. Ю., Подзорова Л. И., Ильичева А. С., Чернышева И. В., Андреева Н. С. Керамика и тонкие слои на основе трех-компонентной системы ZrO2-CeO2-Al2O3 как перспективные твердые электролиты // Огнеупоры и техническая керамика, 2009, № 6, С. 7–11.
9. Тихонов П. А., Калинина М. В., Арсентьев М. Ю., Пугачев К. Э. Протонопроводящая керамика и тонкие пленки на основе цирконатов La и Sm // Физика и химия стекла, 2012, т. 38, № 4, С. 553–564.
10. Тихонов П. А., Арсентьев М. Ю., Калинина М. В. Наноразмерные пленки на основе диоксидов циркония и церия // Физика и химия стекла, 2010, т. 36, № 2, С. 289–296.
11. Абрашова Е. В., Барановский М. В. Получение и анализ спектральных характеристик нанокомпозитов на основе широкозонных проводящих металлоксидов системы ZnO-SnO2-SiO2 // Известия СПбТЭТУ «ЛЭТИ», 2013, т. 5, с. 16–21.
12. Abrashova E. V., Gracheva I. E., Moshnikov V. A. Functional nanomaterials based on metal oxides with hierarchical structure // Journal of Physics: Conference Series, 2013, Vol. 461, conference 1, P. 012019.
13. Chen H., Hautier G., Jain A., Moore C., Kang B., Doe R., Wu L., Zhu Y., Tang Y., and Ceder G. Carbonophosphates: A New Family of Cathode Materials for Li-Ion Batteries Identified Computationally // Chem. Mater., 2012, Vol. 24, Iss. 11, pp. 2009–2016.
14. Грачева И. Е., Мошников В. А., Абрашова Е. В. Обобщение результатов анализа величины фрактальной размерности золь-гель пористых иерархических структур // Материаловедение, 2013, № 6, с. 13–22.
15. Abrashova E. V., Gracheva I.E, Moshnikov V. A. Metal oxide SnO2–ZnO–SiO2 films prepared by sol-gel // Smart Nanocomposites, 2014, Vol. 4, Iss. 2, pp. 1–7.
16. Шилова О. А., Антипов В. Н., Тихонов П. А., Кручинина И. Ю., Арсентьев М. Ю., Панова Т. И., Морозова Л. В., Московская В. В., Калинина М. В., Цветкова И. Н. Керамические нанокомпозиты на основе оксидов переходных металлов для ионисторов // Физика и химия стекла, 2013, т. 39, № 5, С. 803–815.
17. Anurova N. A., Blatov V. A., Ilyushin G. D., Blatova O. A., Ivanov-Schitz A. K., Dem’yanets L. N. Migration maps of Li+ cations in oxygen-containing compounds // Solid State Ionics, 2008, Vol. 179, Iss. 39, pp. 2248–2254.
18. Blatov V. A. Voronoi-Dirichlet polyhedra in crystal chemistry: theory and applications // Cryst. Rev., 2004, Vol. 10, Iss. 4, pp. 249–318.
19. Whittingham M. S. Lithium Batteries and Cathode Materials // Chem. Rev., 2004, Vol. 104, Iss. 10, pp. 4271–4302.
20. Soler J. M., Artacho E., Gale J. D., Garcia A., Junquera J., Ordejon P., Sanchez-Portal D. The SIESTA method for ab initio order-N materials simulation // J. Phys. Condens. Matter, 2002, vol. 14, no. 11, pp. 2745–2779.
21. Junquera J., Paz O., Sanchez-Portal D., Artacho E. Numerical atomic orbitals for linear-scaling calculations // Phys. Rev. B, 2001, vol. 64, iss. 23, pp. 235111(9 pages).
22. Andersson D. A., Simak S. I., Skorodumova N. V., Abrikosov I. A., Johansson B. Optimization of ionic conductivity in doped ceria // Proceedings of the National Academy of Sciences of the United States of America, 2006, vol. 103, no.10, pp. 3518–3521.







