Создана модель смешанной адено-герпетической инфекции клеток MDBK и охарактеризированы особенности репродукции вирусов. Показано, что ко-инфицирование клеток приводило к взаимному подавлению репродукции вирусов. На модели вирусной ко-инфекции клеток изучено действие антигерпетического препарата ганцикловир и аномального нуклеозида G8.
Ключевые слова: смешанная инфекия, аденовирус, герпесвирус, ко-инфекция, суперинфекция, антивирусные вещества.
Разработка и использование фармацевтических препаратов для лечения инфекционных заболеваний — важная химико-медико-биологическая проблема, которая требует комплексного подхода для ее решения, с учетом существования широкого спектра смешанных инфекций, включая вирус — вирусные смешанные инфекции. Широкая распространенность вирусов, их тропизм к одним и тем же тканям, создает возможность инфицирования организма несколькими вирусами, с развитием смешанной инфекции. Результатом этого может быть как отсутствие взаимодействия, так и взаимное ингибирование или стимулирование репликации вирусов, изменение пермисивности, тропизма, латентности, патологии. Заболевания смешанной этиологии — одна из актуальных проблем современной клинической медицины, особое место среди них занимает адено- и герпесвирусная инфекции, ассоциированные с вирусами респираторной группы [1, 2]. Известно, что многие вирусы кодируют мощные промоторы и трансактивируют белки, чтобы использовать клеточную транскрипционную систему для максимальной экспрессии вирусных генов. Продукты ранних генов таких вирусов, как вирус герпеса 1 и 6 типа, цитомегаловирус, аденовирус активно трансактивируют промотор LTR HIV. Повышенная экспрессия и активация клеточных факторов транскрипции при вирусных инфекциях также действует на промоторы ко-инфицированных вирусов. Клинические проявления смешанных инфекций могут быть разнообразны в зависимости от вида возбудителей, их биологических свойств, взаимоотношений друг с другом и с клетками-хозяевами [3]. При некоторых ко-инфекциях не происходит изменение характера патологического процесса, однако, часто наблюдается его усиление, поэтому важной задачей является поиск и разработка антивирусных соединений, которые проявляли бы высокую эффективность в отношении обоих вирусов, ингибируя их репродукцию и передачу. Активность известных и новых антивирусных препаратов практически не исследуется при смешанной вирус-вирусной инфекции. Поэтому, целью работы было создание клеточной модели смешанной адено-герпетической инфекции чувствительных клеток, характеристика полученной клеточной модели вирусной инфекции и исследование особенностей действия антивирусных соединений в условиях ко-инфицирования клеток.
Материалы и методы. Объекты исследований. Использовано культуру перевиваемых клеток MDBK (почки теленка), полученную из Института микробиологии Болгарской Академии наук. Клетки культивировали в соответствии со стандартной методикой [4].
В качестве модельных вирусов были взяты аденовирус человека 5-го серотипа (HAdV-5) и вирус простого герпеса 1 типа (HSV-1/US) полученные из коллекции Будапештского медицинского университета (Венгрия) и Института антивирусной химиотерапии Центра клинической и теоретической медицины (Германия). Вирусы культивировали по описанным ранее методикам [5].
Препараты. Ганцикловир — 9-(1,3-дигидрокси-2пропоксиметил) гуанин (Roche, Швейцария) — синтетический нуклеозидный аналог гуанина, который подавляет репликацию вирусов герпеса как in vitro, так и in vivo [6].
Аномальный нуклеозид G8 –2-(3-хлоро-тетрагидрофуран-2-ил)-4-тозил-5-(трифлуорометил)-2Н-1,2,3-триазол — гетероциклическое соединение подобно тимидину (Институт органической химии, Украина), подавляет репликацию аденовируса и герпесвируса in vitro [7, 8].
Моделирование смешанной адено-герпетической инфекции клеток MDBK. Инфицирование клеток проводили одновременно двумя вирусами (ко-инфекция) или последовательно с разницей в 24 часа, с предварительным заражением аденовирусом (суперинфекция). Клетки MDBK с плотностью 2*106 клеток/мл, отмывали от сыворотки, вносили аденовирус из расчета: 3, 6 или 24 ВОЕ/кл (включение образующая единица на клетку) и 0,01; 0,02 или 0,08 БОЕ/кл (бляшко образующая единица на клетку) вируса простого герпеса. Адсорбция вируса происходила в течение 1ч при 20° C, затем клетки 2-ды отмывали от не адсорбированного вируса раствором Хэнкса (БиоТестМед, Украина), добавляли поддерживающую среду, состоящую из RPMI 1640 (Sigma, США), DMEM (БиоТестМед, Украина), 5 % сыворотки эмбриона теленка (Sigma, США), антибиотиков. Клетки инкубировали в термостате при 37° С в атмосфере 5 % СО2. Отбор материалов для анализа проводили через 24–72 часов после инфицирования клеток.
Клеточный иммуноферментный анализ. Из планшета с культурой клеток инфицированной вирусом через 24–48 ч инкубации удаляли культуральную жидкость и проводили фиксацию поочередно 96 % этанолом 10 мин, 70 % этанолом 60 мин, 6N HCl 30 мин. Далее монослой клеток трижды отмывали фосфатно-солевым буфером (ФБС, рН 7,2) с добавлением 0,005 % Tween 20. В каждую лунку планшета вносили по 100 мкл 3 % бычьего сывороточного альбумина (БСА) и инкубировали 30 мин при 37С°, что необходимо для заполнения не адсорбированных мест на планшете. Постановку самой реакции ИФА осуществляли по общепринятой методике. Результаты анализировали спектрофотометрически на ридере Multiskan FC (Thermo Fisher Scientific, США) при длине волны 492 нм.
Иммунофлюоресцентный анализ. Препараты обрабатывали за прямым (сывороткой мыши против HSV-1, меченой FITC, Россия) и не прямым (сывороткой кролика против гексона аденовируса и антисывороткой к глобулинам кролика, меченой FITC, Thermo scientific, США) методом [9, 10]. Образцы исследовали в люминесцентном микроскопе МЛ-2 (ЛОМО, Россия).
Электронно-микроскопические исследования. Процедуры, связанные с фиксацией клеток, их обезвоживанием, замещением и заливкой в смолы, проводили по методике Bozzola [11]. Ультратонкие срезы, полученные на ультрамикротоме LKB 8800, контрастировали уранилацетатом и цитратом свинца и исследовали на микроскопе JEM-1400 (Jeol, Япония).
Количество инфицированных клеток, титр вируса. Интенсивность репродукции вирусов в клетках выявляли цитоморфологическим методом с использованием красителя 0,01 % акридинового оранжевого (Sigma, США), определяя процент инфицированных клеток (содержащих вирусспецифические внутриядерные включения) на 500 подсчитанных клеток [12].
Исследование антивирусной активности веществ.После адсорбции и отмывки клеток, ко-инфицированных HAdV-5 (24 ВОЕ/кл) и HSV-1/US (0,08 БОЕ/кл), вносили в составе поддерживающей среды не токсические концентрации антивирусных соединений. Пробы отбирали через 72 часа и анализировали методом ПЦР. Выделение ДНК вирусов из проб проводили с помощью коммерческого набора «innuPREP Virus DNA Kit» (Analityk Jena AC, Германия) согласно инструкции фирмы-производителя. HSV-1 детектировали RT-PCR с использованием набора «АмплиСенс®HSV- скрин/монитор-FL» (ФГУН ЦНИИЭ, Россия) согласно рекомендациям изготовителя с детекцией в реальном времени (амплификатор qTOWER Германия). Выявления ДНК аденовирусов в опытных образцах проводили методом полимеразной цепной реакции с электрофоретической детекцией продуктов амплификации в агарозном геле «АмплиСенс®Adeovirus-EPh» (ФГУН ЦНИИЭ, Россия) (амплификатор Mastercycler personal Eppendorf, США). Продукты амплификации и GeneRuler™ DNA Ladder Mix («Fermentas», Литва) были проанализированы в 1.7 % (w/v) агарозном геле, который содержал 0.01 % (v/v) этидиум бромида. Результаты визуализировались в трансиллюминаторе и обрабатывались в программе Gel Imager («DNA-technology», Россия).
Статистическую обработку данных выполнено согласно стандартным подходам к вычислению статистических ошибок (стандартное отклонение) [13], используя компьютерную программу MicrosoftExcel 2010.
Результаты и обсуждение. Особенности репродукции вирусов-асоциантов в условиях смешанной инфекции. Для определения вирусных нуклеиновых кислот в инфицированных клетках, в связи с высокой чувствительностью, специфичностью, четкостью и контрастностью получаемого изображения, нами применялся метод люминесцентной микроскопии с использованием флюорохрома акридинового оранжевого [14]. Контрольные (не инфицированные) клетки имели ядра овальной формы с мелкими, равномерно распределёнными в нуклеоплазме базофильными (зелеными) гранулами. Ядро клетки содержало до 5 округлых интенсивно окрашенных оранжевых ядрышек различного размера; цитоплазма эозинофильная (оранжевая) и мелкозернистая. В монослое часто встречались клетки на разных стадиях митоза (рис.1А). Инфицированные клетки, в которых репродуцируются вирусы HAdV-5 и HSV-1/US, выявляли по образованию в ядрах специфических ДНК-содержащих (ярко-зеленых) включений обоих вирусов. Аденовирусные включения имели вид зернистого, гранулярного или центроядерного ярко-зеленого свечения, окруженного темной, гомогенной зоной по периферии ядра (рис.1Б), тогда как для герпетических включений характерно было равномерное, диффузное, дымчато-зеленое свечение ядра с яркой оранжево-зеленой ядерной мембраной (рис.1В). С развитием включений часто наблюдали увеличение ядер с резким изменением их формы. Включения содержат ДНК вирусов, специфические вирусные антигены, скопления капсомеров вирусов (формирующие паракристалы) и кристалоподобные скопления полных и не полных нуклеокапсидов. Появление вновь синтезированного вируса коррелировало с образованием, так называемых, поздних включений и по мере повышения титра вирусов количество клеток, содержащих эти включения, увеличивалось. Метод позволяет определить количество инфицированных клеток как показатель репродукции вирусов [15].
Влияние смешанной инфекции на репродукцию вирусов-ассоциантов оценивали по изменению количества инфицированных клеток. Цитоморфологический анализ ко-инфицированных клеток показал наличие двух типов вирусных включений. Было также выявлено, что одновременное инфицирование клеток двумя вирусами (ко-инфицирование) уже через 24 ч после заражения приводит к ингибированию репродукции обоих вирусов (табл.1). Уровень ингибирования зависел от множественности инфицирования клеток вирусами. При инфицировании клеток HAdV-5 в дозе 6 ВОЕ/кл наблюдали 73 % снижение количества включений индуцированных HSV-1/US и 35 % — аденовирусом (независимо от множественности инфицирования вирусом герпеса).
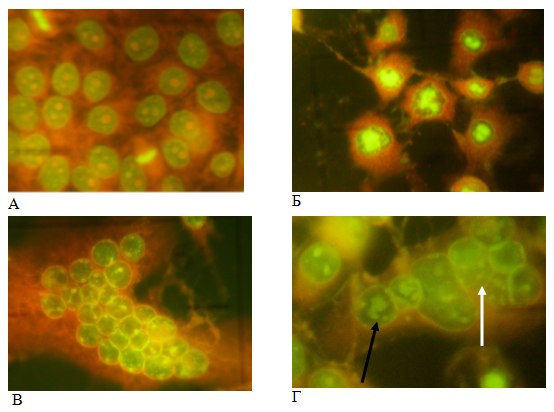
Рис. 1. Цитоморфологический анализ: А — не инфицированные клетки MDBK, интенсивное зеленое свечение делящихся клеток; Б — инфицированные HAdV-5 клетки с вирусоспецифическими центроядерными включениями; В — инфицированные HSV-1/US клетки, синцитий с ядрами содержащими герпетические включения, Г — герпетические (белая стрелка) и аденовирусные включения (черная стрелка) в синцитии при ко-инфицировании клеток. Акридиновый оранжевый, увеличение 280х
Наблюдали уменьшение количества инфицированных HSV-1/US и HAdV-5 клеток на 72 и 25 %, соответственно, при использовании множественностей 3 ВОЕ/кл HAdV-5 и 0,02 БОЕ/кл HSV-1/US. Уменьшение множественности инфицирования клеток вирусом герпеса до 0,01 БОЕ/кл (для аденовируса — прежняя) приводило к снижению в 3 раза интенсивности репродукции HSV-1/US, тогда как репродукция HAdV-5 усиливалась на 8 %.
В случае суперинфицирования клеток MDBK вирусом HSV-1/US через 24 часа после заражения их HAdV-5, показано снижение на 65–83 % количества клеток с аденовирусными включениями (табл.1). Выявлено как ингибирование, так и стимулирование репродукции HSV-1/US, зависящее от множественности инфицирования клеток аденовирусом. При инфицировании клеток с множественностью 6ВОЕ/кл HAdV-5 наблюдали 18 % угнетение образования герпетических включений, тогда как при использовании множественности 3 ВОЕ/кл отмечали рост количества инфицированных герпесом клеток на 31–42 %.
Таблица 1
Формирование специфических вирусных внутриядерных включений в зависимости от типа смешанной инфекции и множественности инфицирования клеток MDBK
|
Вариант инфицирования клеток |
Множественность инфицирования * |
Количество инфицированных клеток (%) |
|||
|
ко-инфицирование |
суперинфицирование |
||||
|
HAdV-5 |
HSV-1/US |
HAdV-5 |
HSV-1/US |
||
|
HAdV-5 |
6 |
26 |
- |
75 |
- |
|
HAdV-5 |
3 |
12 |
- |
33 |
- |
|
HSV-1/US |
0,02 |
- |
89 |
- |
89 |
|
HSV-1/US |
0,01 |
- |
55 |
- |
55 |
|
HAdV-5 + HSV - |
6 0,02 |
17 |
49 |
13 |
73 |
|
HAdV-5 + HSV- |
3 0,02 |
9 |
28 |
10 |
78 |
|
HAdV-5 + HSV- |
6 0,01 |
17 |
54 |
26 |
45 |
|
HAdV-5 + HSV- |
3 0,01 |
13 |
18 |
11 |
72 |
Примечание: *- для HAdV5 — ВУО/кл, HSV1/US — БУО/кл. P <0,05
Исследованы особенности адено-герпетической ко-инфекции клеток MDBK с использованием метода электронной микроскопии. Изучалась ультраструктура неинфицированных (нативных) и инфицированных вирусами клеток и особенности вирусного морфогенеза. Показано, что при репродукции адено- и герпесвирусов резко нарушалась морфология клеток MDBK (рис.2). Если нативные клетки MDBK имели округлую или овальную форму, большое ядро, в вакуолях выявлялись рыхлые округлые тельца умеренной электронной плотности, ядерный хроматин был размещен по всему объему ядра, в центре которого наблюдали одно или несколько крупных ядрышек, то в инфицированных адено- или герпесвирусом клеток (рис.2,Б1,В1) было выявлено увеличение ядер, перегруппировки хроматина к периферии (маргинация); формирование вирусспецифических включений гранулярного и фибриллярного типа, образование кристаллоподобных внутриядерных скоплений полных и неполных вирусных нуклеокапсидов. Наблюдалась гипертрофия ядерной мембраны в сочетании с расширением перинуклеарного пространства и исчезновением ядрышек. Цитоплазма клеток характеризовалась более выраженной вакуолизацией, по сравнению с неинфицированными клетками. Также появлялись многочисленные округлые митохондрии и трубчато-ретикулярные образования, эндоплазматический ретикулум был расширен, а клеточная оболочка гипертрофирована и имела необычную форму. Все эти морфологические изменения приводили к полной деструкции клеток на 72–96 час после заражения. Описанное распределение электронно-плотного материала в ядрах инфицированных клеток соответствовало месту нахождения ДНК-содержащих вирусоспецифических внутриядерных включений, выявляемых при окраске инфицированных клеток красителем акридиновым оранжевым. Основная масса вирионов аденовируса находилась по периферии ядра (рис.2, В2–3) ближе к поверхности ядерной мембраны. Также выявлено, что вирусная частица имела электронно-плотную оболочку с заключенным в ней электронно-плотным центральным телом, между которыми имелась светлая зона. Вирус герпеса в ядрах образовывал частицы нуклеоида (рис.2, Б1), который представляет собой округлое электронно-плотное тело диаметром 60–90 нм (так званые «голые» капсиды). Инфекционными вирионы становились после стадии образования внешней оболочки, состоящей из мембран клетки, приобретая ее при выходе из клетки (рис.2, Б2).
Клетки, ко-инфицированные вирусами HAdV-5 и HSV-1/US, характеризировались более низким уровнем развития морфологических изменений и наличием небольшого количества вирусных капсидов. Электронно-микроскопическое изучение ультраструктурных срезов выявило значительное количество дефектных вирусных частиц, имеющих меньшую электронную плотность нуклеокапсида (рис.2, Д2), что свидетельствует об угнетении репродукции вирусов. В то же время, в ядрах ко-инфицированных клеток выявлены оба вируса (рис.2, Д3).
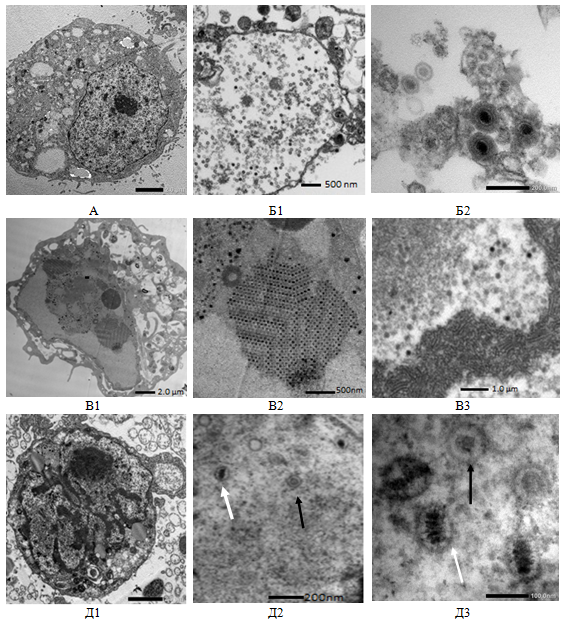
Рис. 2. Ультратонкие срезы клеток MDBK: А — не инфицированы клетки; Б- инфицированные HSV-1/US; В — инфицированные HAdV-5; Д — ко-инфицированные HAdV-5 (черная стрелка) и HSV-1/US (белая стрелка)
Наличие смешанной инфекции популяции клеток MDBK также подтверждено методом иммунофлуоресцентного анализа (рис. 3). Исследована локализация и динамика накопления капсидных белков вирусов. После фиксации ко-инфицированных клеток MDBK препараты делили на две группы, каждую из которых обрабатывали одной из двух антисывороток (к HAdV-5 или HSV-1/US), коньюгированной с FITC.
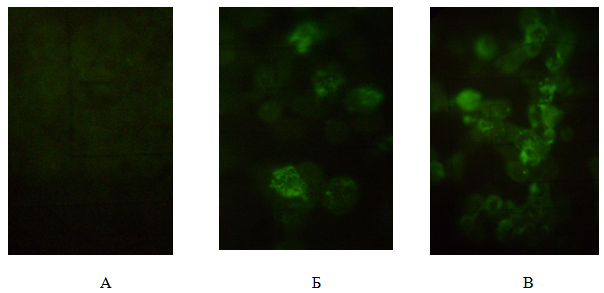
Рис.3. Иммунофлюоресцентный анализ клеток: А — не инфицированные клетки MDBK (отрицательный контроль); Б — популяция клеток ко-инфицированных HAdV-5 и HSV-1/US и обработанных сывороткой кролика против гексона аденовируса и антисывороткой к глобулинам кролика меченой FITC; В — обработанных сывороткой мыши против HSV-1 меченой FITC. Люминесцентная микроскопия, увеличение 280х
Через 17–18 ч инфицирования клеток в отдельных ядрах наблюдали диффузное не структурированное свечение гексонового антигена, в виде ярко-зеленой зернистости. Антиген накапливался в ядрах в большом количестве через 46–48 часов и распределялся в виде дискретно лежащих гранул, сплошного зернистого свечения, розетки или кольца вблизи ядерной мембраны (рис.3, Б). В инфицированных клетках гексоновый антиген располагался соответственно матриксу включений, обнаруживаемых при окраске инфицированных клеток акридиновым оранжевым. На поздних стадиях репродукции аденовируса ядерные мембраны разрушались, вокруг такого рода поражённых клеток скопления позднего белка обнаруживались в виде крупных пылинок.
Структурные белки вируса герпеса в популяции клеток MDBK обнаруживались через 3 часа после ко-инфицирования в виде диффузного свечения перинуклеарной зоны цитоплазмы. Через 6 ч наблюдали яркое диффузное свечение всей цитоплазмы, а вирусные белки обнаруживали в ядрах клеток. В последующие сроки интенсивность ядерной флуоресценции значительно увеличивалась (рис. 3, В).
Об экспрессии вирусного генома в ко-инфицированных эпителиальных клетках MDBK также судили по накоплению позднего капсидного антигена аденовируса — гексона и капсидных белков вируса герпеса, которые определяли с помощью клеточного ИФА. Специфическая антиаденовирусная сыворотка и моноклональные антитела к гексону HAdV получены по стандартной методике Келлера [15], для выявления HSV-1/US использовали поликлональные мышиные антитела к вирусу простого герпеса 1 типа (Dako, Дания).
Как показано на рисунке 4, уже через 24 ч после ко-инфицирования (как и при цитоморфологическом анализе) выявлено ингибирование экспрессии геномов обоих вирусов. Количество антигена гексона аденовируса снизилось на 49 %, а капсидных белков вируса герпеса — на 13 %. Ингибирование синтеза белка более чем на 50 % также описано в работах Spector и Pizer, когда клеточную линию эмбрионов крыс, трансформированную аденовирусом 5 серотипа суперинфицировали вирусом герпеса (HSV-1). Авторы связывают это с изменениями метаболизма РНК HAdV, приводящими к ингибированию накопления специфических аденовирусных poly (A) мРНК в цитоплазме [16]. Через 48 ч вирусной ко-инфекции выявлено 56 % ингибирование экспрессии капсидных белков HSV-1/US и 30 % стимулирование экспрессии гексона аденовируса.
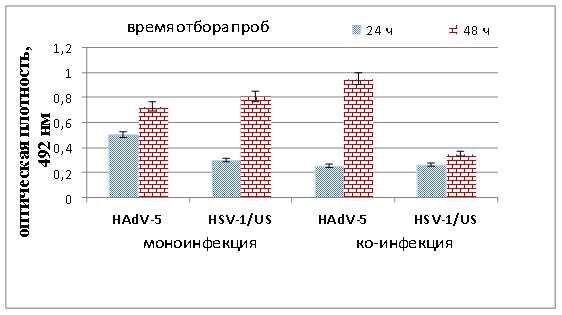
Рис. 4. Уровни накопления антигена гексона HAdV-5 и белков вируса герпеса в условиях моно- и смешанной инфекции клеток MDBK
Существуют литературные данные о том, что вирусы семейств адено-, пикорна-, ортомиксо-, парамиксовирусов могут приводить к интерференции репликации вируса простого герпеса, заканчивающейся абортивной инфекцией. Этот процесс эффективно происходит в клетках, трансформированных обезьяньим паповавирусом, аденовирусом, вирусом Эпштейна-Барр, вирусом простого герпеса 2 типа и респираторно-сенцитиальним вирусом. Абортивная инфекция может возникать вследствие угнетения экспрессии вирусных генов, что приводит к сокращению продукции некоторых вирусных ферментов и вирусной ДНК. Ограничение продукции инфекционного потомства вируса может быть вызвано и блокировкой последовательных событий репликации вируса. Такой сбой вирусной системы управления происходит в результате неэффективного синтеза компонентов вириона [17]. При нормальном ходе аденовирусной инфекции активируются различные ранние вирусные транскрипционные единицы в результате действия продукта вирусного гена E1A, в случае его мутации, экспрессия любого раннего гена подавляется. Эффективную экспрессию этих генов можно получить в результате ко-инфицирования клеток HSV-1 или вирусом псевдобешенства. Продукт сверхраннего гена вируса псевдобешенства и продукт ICP4 гена HSV-1 могут активировать ранние транскрипционные единицы аденовируса, причем намного эффективнее, чем сам Е1А [18]. Суперинфекционное исключение (интерференция) широко известный тип взаимодействия между вирусами, который происходит после первичной вирусной инфекции и вызывает резистентность к следующим вирусным инфекциям. Механизмы исключения разнообразны и еще не полностью изучены, но зависят от прямого взаимодействия продуктов первичной инфекции с ко-инфицирующим вирусом [16].
Исследование антивирусной активности веществ на модели созданной смешанной инфекции. Вопросы поведения вирусов-ассоциантов в ответ на использование антивирусных веществ при лечении смешанных вирусных инфекций в настоящее время практически не изучены. Полученную модель ко-инфицированных клеток MDBK использовали для исследования чувствительности вирусов HSV-1/US и HAdV-5 к противовирусным веществам — антигерпетическому препарату гацикловир и новому аномальному нуклеозиду G8 с помощью ПЦР анализа [19, 20]. Предварительный анализ антивирусного действия препарата гацикловир на модели герпетической инфекции показал, что в концентрациях 10 и 50 мкг/мл препарат обладал выраженной антигерпетической активностью, поскольку уменьшал количество копий ДНК HSV-1/US на 60 % и 66 %, соответственно (рис.4). При аденовирусной инфекции не выявлено значительного влияния ганцикловира на репликацию ДНК HAdV-5 (ингибирование 4 %).
В условиях ко-инфицирования клеток вирусами препарат ганцикловир на 61 % ингибировал репродукцию вируса герпеса. В концентрации 50 мкг/мл препарат проявлял слабую антиаденовирусную активность (7 % ингибирования), а в концентрации 10 мкг/мл ингибировал репликацию ДНК на 25 %. Таким образом, показано, что при ко-инфицировании клеток MDBK адено- и герпесвирусом препарат ганцикловир в концентрации 10 мкг/мл проявлял на 20 % более эффективное антиаденовирусное действие, чем при моно аденовирусной инфекции клеток. Относительно вируса герпеса действие препарата не изменялось.
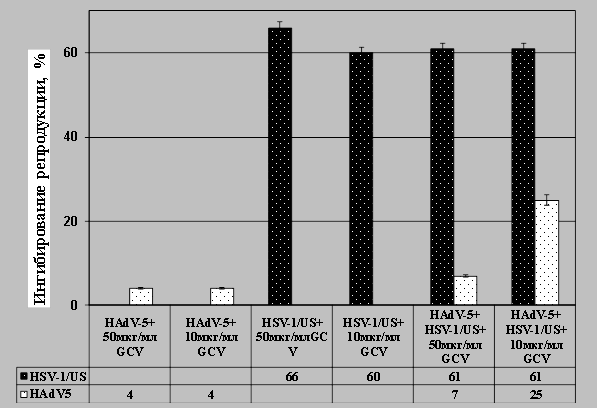
Рис. 4. Исследование антивирусной активности препарата ганцикловир (GCV) на модели смешанной адено-герпетической ко-инфекции клеток MDBK
Результаты изучения антивирусной активность нового аномального нуклеозида G8 на модели смешанной ко-инфекции клеток представлены в таблице 2. Показано, что в концентрации 50 мкг/мл вещество полностью подавляло репликацию ДНК вируса герпеса и на 51 % аденовируса в случае моно инфекции клеток MDBK.
В условиях смешанной инфекции выявлено снижение эффективности действия вещества относительно HSV-1 и HAdV-5 на 43 % и 162 %, соответственно, т. е., выявлено 111 % стимулирование репликации аденовирусной ДНК. Полученные результаты действия антивирусных соединений на вирусы-ассоцианты чрезвычайно важны для понимания процесса развития устойчивости вирусов к антивирусным препаратам.
Таблица 2
Антивирусная активность вещества G8 на модели ко-инфекции клеток MDBK аденовирусом и вирусом простого герпеса
|
Вариант обработки клеток |
% ингибирования (-) /стимулирования (+) репродукции вирусов |
|
|
HSV1/US |
HAdV-5 |
|
|
HAdV-5 + G8 |
-51±4 |
|
|
HSV1/US+ G8 |
-100±0 |
|
|
HAdV-5 + HSV1/US |
+21±2 |
-2±1 |
|
HAdV-5 + HSV1/US+ G8 |
-57±2 |
+111±4 |
Таким образом, создана модель двойной адено-герпетической инфекции эпителиальных клеток MDBK и охарактеризованы особенности репродукции вирусов в условиях смешанной инфекции. Исследована эффективность препарата ганцикловир и нового аномального нуклеозида G8 при ко-инфицировании клеток. Данные исследования важны для понимания взаимодействий между вирусами в условиях пермисивности клеточной модели для обоих вирусов и роли данных процессов в развитии резистентности вирусов к антивирусным препаратам.
Предложенный подход изучения антивирусных препаратов на модели смешанной вирусной инфекции клеток перспективен при создании новых и изучении уже существующих химиотерапевтических препаратов. Выявленное нами аномальное действие препаратов, в случае ко-инфицирования клеток двумя вирусами, указывает на необходимость таких методических приемов при изучении перспективных антивирусных веществ, так как может препятствовать в дальнейшем развитию вирусной резистентности к препаратам.
Литература:
1. Roizman B. and Sears A. Herpes Simplex Viruses and Their Replication // Fields' Virology. — 2001. — Р. 2231–2295.
2. Echavarria M. Adenovirus. Principles and practice of clinical virology/ Wiley and Sons. — San Diego. -2009. № 6.- P. 463–488.
3. Da Palma T., Doonan B. P., Trager N. M., Kasman L. M. A systematic approach to virus-virus interactions// Virus Research.-2010.- Vol. 1.- P.1–9.
4. European Collection of Animal Cell Cultures Catalog. Porton Down, Salisbury (UK) PHLS Centre of Applied Microbiology and Research. — 1990. — № 4. — 386 р.
5. Berencsi Gy., Dyachenko N. S., Tarassishin L. A. et al. Changes of adenovirus hexon associated with different passage history of НАdV-1//Acta microbial. Hung. — 1986. -N3. — P.233–243.
6. Ершов Ф. И. Антивирусные препараты. Справочник.M.- 2006.-№ 2.- 306 с.
7. Серый С. А., Тимошенко В. М., Власенко Ю. Г., Баранова Г. В., Загородняя С. Д., Нестерова Н. В. Неклассические реакции Пуммерера тиопирановых производных как метод получения трифторметилзамещенных тиоланов, проявляющих антивирусную активность// Химия гетероциклических соединений.-2014.- № 1. — С.1–15.
8. Белявская Л.А, Повница О. Ю., Шермолович Ю. Г., Гудзь А. П., Нестерова Н. В. Исследование антиаденовирусной активности новых фторсодержащих гетероциклических соединений// Микробиология и биотехнология.- 2014. -№ 1.- С.19–26.
9. Bordin P., Merlin U., Pugina P. Reliability of the herpes simplex virus immunofluorescent test in corneal disease / Eur. J. Ophthal. — 1992.- № 2.-175р.
10. Gardner P. S., McGuckin R. and McQuillin J. Adenovirus demonstrated by immunofluorescence/ Br. Med. J. — 1972.- № 3. — 175 р.
11. Bozzola J. J. Conventional Specimen Preparation Techniques for Transmission Electron Microscopy of Cultured Cells. Electron microscopy: methods and protocols / Edited by John Kuo.– 2007.- № 2– P.1–18.
12. Носач Л. Н., Дяченко Н. С. Цитопатология аденовирусной инфекции/ Киев: Наук.думка.-1982.-124с.
13. Лапач С. Н., Чубенко А. В., Бабич П. Н. Статистические методы в медико-биологических исследованиях с использованием Excel.- К.: МОРИОН.- 2001. — 408c.
14. Дяченко Н. С., Нас И., Беренчи Д. и др. Аденовирус, клетка, организм / Киев: Наук. Думка.-1988. — 232 с.
15. Антитела 1. Методы /Под ред. Д. Кэтти. — М.: Мир.-1991. -287с.
16. Spector D. and Pizer L. Herpesvirus infection modifies adenovirus RNA metabolism in adenovirus type 5-transformed cells // J. Virol.- 1978.- № 27.- Р.1–12.
17. Cheng J., Moore T., Sakamoto K. RNA interference and human disease// Mol. Genet.Metab.- 2003.-№ 80.- Р.121–128.
18. Lawrence T. Feldman, Michael J. Imperiale and Joseph R. Nevins. Activation of Early Adenovirus Transcription by the Herpesvirus Immediate Early Gene: Evidence for a Common Cellular Control Factor //Proceedings of the National Academy of Sciences of the United States of America. Part 1: Biological Sciences. -1982.- Vol. 79, № 16.-Р. 952–4956.
19. Behbahani M., Shanehsazzade M., Shokoohinia Y. and Soltan M. Evaluation of Anti-Herpetic Activity of Methanol Seed Extractand Fractions of Securigera securidaca In vitro// J. Antivir.Antiretrovir.-2013.- № 5.- Р.72–76.
20. Uchio E., Inoue H. and Kadonosono K. Antiadenoviral effects of N-chlorotaurine in vitro confirmed by quantitative polymerase chain reaction methods// Clin. Ophthalmol. -2010.- № 4.-Р. 1325–1329.







