Хроническая обструктивная болезнь легких (ХОБЛ) относится к ограниченному числу болезней, определенных ВОЗ как приоритетные. Это обусловлено растущим социально-экономическим бременем ХОБЛ, лидирующей позицией в структуре смертности (по данным ВОЗ в мире к 2020 году заболеванию отводится 4-я, а в развитых странах уже сегодня — 3 позиция), что диктует необходимость раннего выявления, комплексного лечения и длительного диспансерного наблюдения больных ХОБЛ [3,4].
Меры первичной и вторичной профилактики, реабилитации ХОБЛ включены в программу государственных мероприятий по профилактике хронических неинфекционных заболеваний [1,7]. При этом крайне важным является включение в программы ведения пациентов ХОБЛ индивидуальных комплексов реабилитационных мероприятий, важность проведения которых отражены в Глобальной стратегии диагностики, лечения и профилактики хронической обструктивной болезни легких (пересмотр 2011г.) [4]. Эффективность легочной реабилитации изучалась в немногочисленных рандомизированных контролируемых исследованиях, показавших возможность увеличения выживаемости, уменьшение количества и длительности обострений, требующих госпитализации, потенцирование эффекта бронхолитической терапии [5, 6, 7, 8, 10, 11].
Однако в доступной литературе не встретилось исследований, посвященных вкладу курортных факторов в уменьшение хронического воспаления у больных ХОБЛ.
Цель исследования: оценка эффективности индивидуальных реабилитационных программ диспансерного наблюдения больных ХОБЛ средней степени тяжести с использованием курортных факторов.
Материал и методы исследования
Обследовано 112 больных среднетяжелой ХОБЛ (89 мужчин и 23 женщины) стабильного течения. Диагноз выставлен на основании критериев Глобальной инициативы по хронической обструктивной болезни легких (Пересмотр 2011 г.). Пациенты были разделены на 2 группы в соответствии с рекомендациями «ГОЛД 2011» по комплексной оценке ХОБЛ: пациенты с низким риском (1 или менее обострений в год) и высоким риском развития обострений (2 и более обострений в год).
Критериями исключения были:
1) наличие клинических и лабораторных признаков обострения ХОБЛ;
2) наличие сопутствующих заболеваний в стадии декомпенсации;
3) наличие заболеваний, препятствующих двигательной активности при проведении терренкура;
4) наличие сопутствующей бронхиальной астмы.
Возраст обследуемых от 40 до 63 лет. Пациенты подписывали информированное добровольное согласие. Проведены клинические, биохимические, иммунологические, спирометрические исследования. Анализировались следующие показатели: форсированная жизненная емкость легких (ФЖЕЛ), объем форсированного выдоха за первую секунду (ОФВ1) и индекс Тиффно. Интенсивность симптомов оценивалась по шкале САТ (COPD Assessment Test). Проводилось изучение клеточного и цитокинового состава индуцированной мокроты.
При проведении процедуры индуцирования мокроты мы руководствовались рекомендациями, изложенными в докладе 1-ой рабочей группы, созданной по инициативе Европейского респираторного общества [Пагиаро]. Все больные получали базисную терапию пролонгированным М-холинолитиком (тиотропий бромид) 18 мкг 1 раз в сутки, курортную терапию, включавшую санаторно-курортный режим, диетотерапию, терренкур по индивидуальной программе, лечебную физкультуру, курсовой прием питьевой минеральной воды.
Статистическая обработка данных проводилась с помощью пакета программ STATGRAPHICS 5.1 Plus for Windows.
Группы больных:
1 группа больных ХОБЛ средней степени тяжести, имеющих в анамнезе 1 и менее обострений в год (59 человек) была разделена на 2 подгруппы: 1А — 26 пациентов, получавших общекурортное лечение и базисную медикаментозную терапию; 1В группа — 23 человека дополнительно принимали суховоздушные радоновые ванны концентрацией 40нКи/л № 10 по стандартной методике.
2 группа (53 человека) имели в анамнезе 2 и более обострений в год также были разделены на 2 подгруппы: 2А — 24 человека, получавших общекурортное лечение и базисную медикаментозную терапию; 2В группа — 29 человек, дополнительно получивших суховоздушные радоновые ванны концентрацией 40нКи/л № 10 по стандартной методике.
ДИЗАЙН ИССЛЕДОВАНИЯ:
1–3-й день (Q1) — отбор и рандомизация больных, спирометрические исследования, тест получения индуцированной мокроты, иммунологические исследования, назначение лечение по двум лечебным комплексам.
88–90-й день лечения (Q2) — тест получения индуцированной мокроты, иммунологические исследования.
358–365-й день лечения (Q3) — проведение спирометрических исследований, тест получения индуцированной мокроты, иммунологические исследования, клинический контроль.
Результаты и их обсуждение
Первичными конечными точками исследования были количество обострений ХОБЛ, оценка тяжести симптомов ХОБЛ с использованием САТ-теста, активность воспаления по данным теста с индуцированной мокротой.
В течение года в обеих группах отмечалось достоверное увеличение степени контроля симптомов ХОБЛ по оценке САТ — теста, что отражено на рис. 1. При этом в группе 2 контроль симптомов до применения реабилитационных программ достоверно отличался от контроля в 1 группе (р <0,005). Это свидетельствует о негативном влиянии частых обострений на течение заболевания даже даже при сопоставимых функциональных показателях (ХОБЛ средней тяжести). По истечении 12 месяцев наблюдения наиболее значимые результаты были получены именно в группе пациентов с частыми обострениями (показатели САТ-теста уменьшились более, чем в 2 раза, особенно при применении радонотерапии).
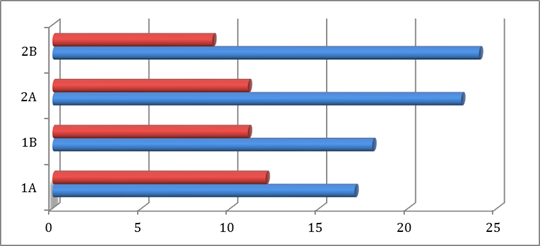
Рис. 1. Оценка показателей САТ-теста за период диспансерного наблюдения с использованием индивидуальных реабилитационных программ в исследуемых группах (нижняя группа столбцов — показатели до начала лечения, верхняя группа столбцов — на конец исследования)
Предикторами высокого риска являются 2 или более обострения за прошедший год или ОФВ1<50 % от должного значения («ГОЛД 2011»). Поэтому возможность повлиять на длительность безрецидивного периода в течение ХОБЛ является стратегической задачей диспансерного наблюдения. Под влиянием индивидуальных реабилитационных программ, включающих радонотерапию (таблица 1), в группе 2В количество обострений уменьшилось более, чем в 2 раза, в 1В группе различия были достоверными, но не столь значимыми. При этом в группах 1Аи 2А количество обострений также достоверно уменьшилось, что свидетельствует о необходимости включения курортных методов в программы диспансерного ведения больных ХОБЛ.
Таблица 1
Количество обострений ХОБЛ за период диспансерного наблюдения, (М±m)
|
Количество обострений |
1А группа |
1В группа |
2А группа |
2В группа |
|
Начало наблюдения |
0,73±1,11 |
0,74±0,81 |
2,23±0,32 |
2,34±0,41 |
|
Конец наблюдения |
0,56±0,43* |
0,46±0,59*,** |
1,74±1,07* |
1,10±0,05*,** |
* — достоверность различия до начала и на конец диспансерного наблюдения внутри группы (р <0,05);
** — достоверность различия на конец диспансерного наблюдения между подгруппами А и В (р <0,05).
По результатам исследования цитокинового состава индуцированной мокроты получено положительное влияние радонотерапии на активность бронхогенного воспаления в обеих группах, однако более выражены были эти изменения во второй группе, что отражено в таблице 1.
Установлено, что снижение провоспалительных цитокинов IL4 и TNFα во первой группе больных ХОБЛ до и после лечения составило (с 161,9±49,3 до 78,9±7,9 Пг\мл и с 133,9±6,9 до 45,9±3,9 Пг\мл),
Таблица 2
Влияние медикаментозной терапии, курортных факторов и суховоздушных радоновый ванн на цитокиновый состав индуцированной мокроты у больных ХОБЛ
|
Показатель |
1А группа |
1В группа |
2А группа |
2В группа |
||||||||
|
Q1 |
Q2 |
Q3 |
Q1 |
Q2 |
Q3 |
Q1 |
Q2 |
Q3 |
Q1 |
Q2 |
Q3 |
|
|
IL- 2 Пг\мл |
24,6±9,0 |
27,1±7,9 |
19,3±6,9* |
34,8±8,9 |
20,3±7,9*, ** |
18,1±7,2*, ** |
45,6±4,3 |
43,3±3,6 |
31,1±5,7* |
46,8±7,9 |
12,1±4,9*, **, |
13,1±3,6*,** |
|
IL- 4 Пг\мл |
163,3±57,9 |
156,8±7,9 |
144,6±9,7* |
161,9±49,3 |
78,9±7,9*,** |
77,1±6,1*, ** |
173,9±6,2 |
157,3±5,3* |
96,1±4,2* |
172,7±6,1 |
45,9±3,9*,** |
44,1±3,9*,** |
|
IL-8 Пг\мл |
154,4±56,9 |
151,2±49,3 |
132, 1 ±7,9* |
158,6±4,9 |
145,9±9,9* |
113,3±8,1*, ** |
167,3±12,3 |
148,9 ± 5,9 |
129,1 ±7,9* |
168,9±4,9 |
62,1±5,2*, ** |
59,1±6,9*, ** |
|
TNF-α Пг\мл |
134,4±7,9 |
129,2±2,4 |
113,7±4,9* |
137,2±6,9 |
123,9±8,9* |
112,1±1,3*, ** |
153,9± 6,9 |
137,1±9,9 |
62,1±7,9* |
156,1±7,4 |
49,1±3,9*, ** |
49,7±7,1*,** |
* — достоверность различия до начала и в процессе диспансерного наблюдения внутри группы (р <0,05);
** — достоверность различия в процессе диспансерного наблюдения между подгруппами А и В через 3 и через 12 месяцев (р <0,05).
В ходе исследования было установлено, что в группах пациентов, не получавших суховоздушные радоновые ванны (1А, 2А), через 3 месяца не было получено достоверного снижения уровня провоспалительных цитокинов, в то время как через 12 месяцев это снижение стало достоверным (в группе 1А IL- 2 с 24,6 до 19,3; IL- 4 с 163,3 до 144,6; IL-8 с 154,4 до 132,1; TNF-α с 134,4 до 113,7 Пг\мл, а группе 2А IL- 2 с 45,6 до 31,1; IL- 4 с 173,9 до 96,1; IL-8 с 156,3 до 129,1; TNF-α с 140,9 до 62,1 Пг\мл). Уменьшение воспаления в бронхиальном дереве связано в данном случае с со значительным уменьшением количества обострений в обеих группах через год наблюдения.
В группах 1В и 2В достоверное снижение интенсивности бронхиального воспаления под влиянием суховоздушных радоновых ванн произошло уже через 3 месяца, при этом через 12 месяцев эти позитивные изменения сохранялись. Через 3 месяца в группе 1В значение показателей IL- 2 снизилось с 34,8 до 20,3; IL- 4 с 161,9 до 78,9, а через 12 месяцев IL- 4 составил 77,1, IL- 8 с 158,6 до 113,3 Пг\мл, TNF-α к концу периода наблюдения составил 112,1 при исходном уровне 137,2 Пг\мл.
Самые значительные изменения произошли в группе 2В, уже через 3 месяца значение показателей снизилось следующим образом: IL- 2 с 46,8 до 13,1; IL- 4 с 172,7 до 44,1, IL- 8 со 168,9 до 59,1, TNF-α с 156,1 до 49,7 Пг\мл.
Таким образом, показано, что развивающееся в ткани легких хроническое воспаление, сопровождающееся выработкой провоспалительных цитокинов, вызывает деструкцию эластина. Фрагменты эластина могут поддерживать воспаление, действуя как мощные хемотаксические агенты для макрофагов и нейтрофилов. У больных с частыми обострениями ХОБЛ содержание провоспалительных цитокинов в индуцированной мокроте превышает аналогичные показатели у больных ХОБЛ с 1–2 обострениями в год в анамнезе, что необходимо учитывать в составлении индивидуальных программ диспансерного наблюдения. Противовоспалительное влияние суховоздушных радоновых ванн в сочетании с индивидуально дозированными физическими нагрузками (терренкур) положительно влияет на активность бронхогенного воспаления, улучшая клинические, иммунологические показатели и частоту обострений ХОБЛ.
Применение комплексной реабилитации больных ХОБЛ с использованием радонотерапии позволяет не только затормозить прогрессирование бронхиальной обструкции у больных среднетяжелой ХОБЛ, но и открывает перспективы в лечении данной группы больных, позволяет уменьшить риск развития обострений заболевания в будущем
Выводы:
1. Использование в качестве элемента реабилитационной программы диспансерного наблюдения больных среднетяжелой ХОБЛ курортных факторов приводит к достоверной положительной динамике клинических симптомов заболевания, выраженности системного воспаления (IL- 2,4,8, ФНО-α), снижению частоты обострений, потребовавших обращений к врачу.
2. Применение комплексной реабилитации больных ХОБЛ с использованием радонотерапии позволяет в более ранние сроки не только затормозить прогрессирование бронхиальной обструкции у больных среднетяжелой ХОБЛ, но и открывает перспективы в лечении данной группы больных, позволяет уменьшить риск развития обострений заболевания в будущем.
Литература:
1. Бойцов С. А., Вылегжанин С. В., Гилева Ф. А., Гулин А. Н., Ипатов П. В., Калинина А. М., Линчак Р.М, Пономарева Е. Г.
2. Совершенствование профилактики хронических неинфекционных заболеваний в учреждениях здравоохранения//Профилактическая медицина. — 2013. Т.16, № 2. С. 3–12.
3. Будневский А. В. Оптимизация амбулаторно-поликлинической помощи больным хронической обструктивной болезнью легких//Системный анализ и управление в биомедицинских системах. 2012. Т. 11. № 2. С. 464–468.
4. Глобальная стратегия диагностики, лечения и профилактики хронической обструктивной болезни легких / Пер. с англ. под ред. А. Г. Чучалина. — М.: Издательский дом «Атмосфера», 2007. — 96 с.
5. Глобальная инициатива по хронической обструктивной болезни легких. Пересмотр 2011 г.//Российское респираторное общество. — 2012. –С. 16–18
6. Прозорова Г. Г., Туданова О. А., Бурлачук В. Т.//
7. Распространенность ХОБЛ среди работников металлургического производства. Атмосфера. Пульмонология и аллергология. — 2004. — № 3. С. 51–52.
8. Прозорова Г. Г., Бурлачук В. Т. Оптимизация диагностики ХОБЛ на промышленном предприятии. Системный анализ и управление в биомедицинских системах. 2005. Т. 4. № 1. С. 36–37.
9. Профилактика Хронических неинфекционных заболеваний. Рекомендации/ С. А. Бойцов, А. Г. Чучалин, Г. П. Арутюнов и др. — М.: 2013.- 89 с.
10. Трибунцева Л. В., Будневский А. В. Системный анализ эффективности терапии хронической обструктивной болезни легких в общей врачебной практике (семейной медицине) // Вестник новых медицинских технологий. Электронное издание. 2013. № 1. С. 179.
11. Calverley P. M., Walker P. Chronic obstructive pulmonary disease // Lancet. − 2003. — Vol. 362. — P. 1053–1061.
12. Nici L, Donner C, Wouters E et al. American Thoracic Society. European Respiratory Society statement on pulmonary rehabilitation. Am J Respir. Crit. Care Med 2006; 173: 1390–413.
13. Zielinski J. What do patients with obstructive chronic pulmonary disease die from? Pneumonal. Alergol. Pol. 2011$; 142: 233–239.







