В работе исследовались адсорбционные свойства мицелия Poliporus ciliatus. В качестве методов исследования были выбраны потенциометрическое титрование и микроэлектрофорез. Определены изоэлектрическая точка и точка нулевого заряда частиц мицелия.
Ключевые слова: Poliporus ciliatus, потенциометрическое титроание, изоэлектрическая точка, точка нулевого заряда.
Процесс адсорбции можно определить как увеличение (положительная адсорбция) или уменьшение (десорбция, или отрицательная адсорбция) концентраций растворенных веществ в поверхностном слое по сравнению с их концентрацией в объеме фаз [1].
Для электролитов различают специфическую и ионообменную адсорбцию. Ионообменная адсорбция реализуется за счет простого электростатического взаимодействия, в ней участвуют противоионы, количество адсорбированных ионов зависит от состава и концентрации различных ионов в растворе, их заряда. Любая другая адсорбция является специфической. Причем механизмы специфической адсорбции, виды взаимодействий адсорбата с поверхностью могут быть различны. Например, поверхностно-активные веществ адсорбируется вследствие гидрофобного эффекта, располагаясь на границе раздела фаз так, чтобы уменьшить их разность полярностей, а следовательно и межфазное натяжение. На поверхности могут происходить различные химические взаимодействия с образованием ковалентных, донорно-акцепторных, ионных и водородных связей.
Удельная адсорбция Г ‒ избыток растворенного вещества в поверхностном слое по сравнению с объемом раствора, отнесенный либо к единице поверхности вещества ‒ моль/м2, либо к единице массы вещества ‒ моль/кг. Количество адсорбированного вещества определяют по убыли концентрации растворенного вещества в объеме водной фазы.
В результате адсорбции электролитов на границе раздела фаз происходит пространственное разделение зарядов и образование двойного электрического слоя (ДЭС). Исследования процессов адсорбции и изучение свойств ДЭС взаимосвязаны.
Для нерастворимых систем (в нашем случае мицелия) заряд поверхности (σо) определяется количеством адсорбированных Н+- и ОН- -ионов, которые для мицелия являются потенциалопределяющими ионами. Величина рН растворов, при которой σ = σо = 0, называется рН точки нулевого заряда и обозначается рНтнз. В рНтнз адсорбция Н+- и ОН--ионов одинакова (Гн+=Гон-). Обычно значение рНтнз определяют по результатам потенциометрического титрования.
Другой важнейшей характеристикой частиц дисперсии является изоэлектрическая точка (рНИЭТ). Значение рНИЭТ для конкретной многокомпонентной системы определяется соотношением основных и кислотных групп в молекуле; это соотношение для каждой системы не одинаково. рНИЭТ соответствует такому значению рН при котором электрокинетический потенциал (ζ) равен 0.
Поскольку в настоящие время базидиомицеты стали объектом пристального внимания исследователей. Большой интерес представляет изучение коллоидных свойств мицелия. Мицелий грибов в основном состоит из полисахаридов и белков, коллоидные свойства которых были исследованы в более ранних работах [2–6]. Природные ВМВ характеризуются постоянным значением молекулярной массы, они являются полидисперсными системами.
В последние годы широко исследуются физико-химические и коллоидные свойства систем содержащих сложные биологически активные соединения, а также устойчивость их дисперсий [7–10]. Исследование адсорбционных свойств мицелия позволит использовать его в качестве носителя лекарственных препаратов, включая новые лекарственные формы, разрабатываемые в настоящее время в академии [11–12].
Целью данной работы является изучение адсорбционных свойств мицелия базидиомицета Poliporus ciliatus, а также сопоставление рНтнз и рНИЭТ мицелия.
В качестве объектов исследования выступали:
а) Культура гриба базидиомицета Polyporus ciliatus (0626).
б) Сухой мицелий базидиомицета Polyporus ciliatus (0626), полученный методом глубинного культивирования в жидкой питательной среде.
Штамм базидиомицета Polyporus ciliatus (0626) был получен из лаборатории микологии БИН РАН.
Мицелий выращивался методом глубинного культивирования в жидких питательных средах [13].
рНтнз находили методом непрерывного потенциометрического титрования [14–15]. В ячейку для потенциометрического титрования помещали 25 мл исследуемой дисперсии, 30 минут пропускали воздух, освобожденный от СО2 и титровали раствором КOH (0,0129 моль/л) или НС1 (0,010 моль/л). Титрант вводили порциями по 0,1 мл с помощью микробюретки с интервалом в 1 минуту. Растворы КOH готовили на дистиллированной воде, предварительно освобожденной от СО2 воздуха кипячением в течение 30 минут. После каждой добавленной порции титранта измеряли значения рН раствора. Регистрация рН осуществляется на рН-метре — милливольтметре рН-673 с точностью измерения рН ±0,05 единиц рН.
По результатам потенциометрического титрования были построены зависимости рН исследуемого раствора от объема добавленного титранта (V, мл) для растворов без адсорбента и с адсорбентом. Расчет величины адсорбции проводился по следующему алгоритму. В кислой области преобладает адсорбция ионов водорода, а в щелочной области ионов ОН-. Значение рН точки пересечения кривых титрования с адсорбентом и без него соответствует условию равенства адсорбированных Н+ и ОН- -ионов — это соответствует рНТНЗ. Слева от рНТНЗ преобладает адсорбция ионов Н+ в результате чего поверхность заряжается положительно, а справа преобладает адсорбция ОН- — поверхность мицелия заряжается отрицательно. Таким образом, методом потенциометрического титрования определяется разница между адсорбцией ионов Н+ и ОН-. Кривые титрования с адсорбентом и без сравнивают и рассчитывают разницу между количеством адсорбированных ионов Н+ -(ОН-) отнесенное к единице массы или поверхности адсорбента:
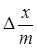 (ОН- — H+) =
(ОН- — H+) = 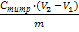 (1)
(1)
где (H+-ОН-) — разница между количеством адсорбированных ионов Н+ и ОН- отнесенная к единице массы адсорбента, моль/г;
Ститр — концентрация титранта КOH (HCl), моль/л;
V1 — объем раствора титранта, пошедший на титрования раствора без адсорбента, мл;
V2 — объем раствора титранта, пошедший на титрование раствора с адсорбентом, мл;
m — масса адсорбента, г;
Важно отметить, что:
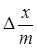 (ОН- — H+)= —
(ОН- — H+)= — 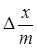 (Н+- ОН-) (2)
(Н+- ОН-) (2)
Расчет — (Н+- ОН-) производят для одинаковых значений рН раствора с адсорбентом и без, в нашей работе при значениях рН от 3,0 до 8,0. Через заданное значение рН проводят линию параллельную оси абсцисс и находят V1 и V2.
Погрешность измерения значений рН составила 0,05 единиц рН.
Ранее метод был отработан на порфиринах [16–17].
Электрокинетический потенциал (ζ-потенциал) частиц мицелия определялся методом микроэлектрофореза [15] Погрешность измерений электрокинетического потенциала не превышала 10 %.
Величина электрокинетического потенциала рассчитывалась по уравнению Гельмгольца-Смолуховского. Уравнение использовалось без поправок, так как выполнялись условия k×a>>1, где k — обратная толщина ДЭС, а — радиус частиц.
Изучение электрокинетических свойств водных дисперсий мицелия проводилось в зависимости от рН водной фазы.
Прежде чем использовать методику для изучения мицелия, она была отработана как на простых оксидах [18–26], так и на сложных биологических системах [27–29].
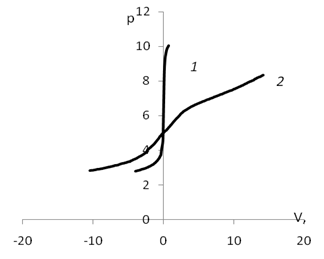
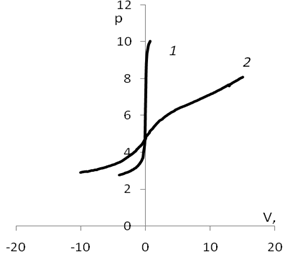
Для определения рНтнз для мицелия был проведен ряд экспериментов потенциометрического титрования с различными неорганическими электролитами, по результатам которых были построены кривые (рис. 1).
Точка пересечения кривых титрования с адсорбентом и без адсорбента соответствует равенству количества адсорбированных протонов и гидроксид ионов. Из кривых потенциометрического титрования рассчитывались количества адсорбированных ионов водорода и гидроксил ионов при разных значениях рН (представленные на рис. 2). Из рисунка видно, что калий незначительно смещает точку нулевого заряда.
а) б)
Рис. 1. График потенциометрического титрования.:а)1 — кривая титрования воды; 2 — кривая титрования дисперсии мицелия; б) 1 — кривая титрования раствора КСl (0,01 моль/л); 2 — кривая титрования дисперсии мицелия Ab. biennisc КСl (0,01 моль/л)
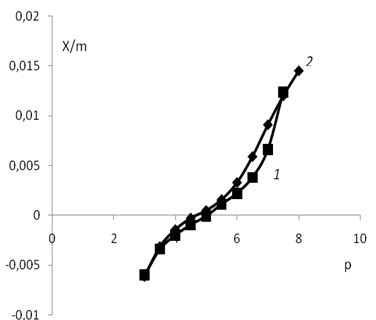
Рис. 2. Зависимость адсорбции ионов мицелия от рН.: 1 — водная дисперсия мицелия; 2 — водная дисперсия мицелия с добавлением KCl (0.01 моль/л)
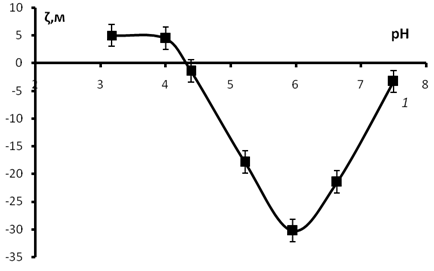
Рис. 3. Зависимость электрокинетического потенциала мицелия в водных растворах от рН.: 1 — через 24 часа после приготовления дисперсии
Далее была определена изоэлектрическая точка мицелия. Для этого рассматривалась зависимость ζ- потенциала мицелия Poliporus ciliatus от рН его водных дисперсий (рис. 3). рН водный фазы создавался добавлением необходимых количеств соляной кислоты и гидроксида калия. Из рис. 3 видно, что рНИЭТ= 4,3. В области рН<рНиэт, поверхность мицелия заряжена положительно вследствие преобладания адсорбции ионов водорода, при рН>рНиэт поверхность заряжена отрицательно из-за адсорбции гидроксид ионов.
В работе определены значения рНтнз и рНиэт для мицелия базидиомицета Poliporus ciliatus. Определены области наибольшей устойчивости водных дисперсий мицелия (рН<4,0 и рН>5,5). Сорбция будет происходить максимально эффективно при рН<4,0 и рН>5,5, а десорбция 5,0<рН<4,0. В области рН<рНтнз мицелий заряжен положительно, а рН>рНиэт отрицательно, что согласуется с результатами электрокинетических измерений. Отметим, что величина отрицательного заряд больше, чем положительного. Изоэлектрическая точка и точка нулевого заряда в отсутствии специфической сорбции совпадают, что и наблюдается в нашем случае.
Литература:
1. Беляев А. П. Физическая и коллоидная химия / Беляев А. П., Кучук В. И. / под.ред. А. П. Беляева. — 2-ое изд., перераб. и доп. — М., 2012.-752с.
2. Чухно А. С., Дмитриева И. Б., Мартынов Д. В.. Влияние солей одно-, двух- и трехзарядных катионов металлов на сорбцию Н+ и ОН- ионов на декстране. // Бутлеровские сообщения. 2011. Т.27. № 14. С. 47–54.
3. Чухно А. С., Дмитриева И. Б., Мартынов Д. В.. Изоэлектрическая точка белков в водных растворах азолов. // Вестник СПбГУ. 2011. Серия 4: Физика. Химия. Вып. 2. С.124–133.
4. Чухно А. С., Дмитриева И. Б., Колодеева С. С., Мартынов Д. В.. Адсорбция ионов Н+ и ОН- на коллагене. // Вестник СПбГУ. 2011. Серия 4: Физика. Химия. Вып. 3. С. 87–95.
5. Чухно А.С., Дмитриева И.Б., Банкина А.Н., Бриллиантова Е.Ю. Изучение взаимодействия белков с биологически активными азотсодержащими гетероциклическими соединениями при различных значениях pH. // Бутлеровские сообщения. 2013. Т.34. № 5. С.91–99.
6. Чухно А. С., Банкина А. Н., Бриллиантова Е. Ю.. Кинетика процесса набухания желатины в водных растворах азолов. // Бутлеровские сообщения.- 2014. — Т.38. № 5. С.84–88.
7. Men'shikova A.Yu., Skurkis Yu.O., Kuchuk V. I., Dmitrieva I. B., Evseeva T. G., Shabsel's B. M. Effect of the surface structure of poly(styrene-co-acrolein) microspheres and its modification by protein on electrosurface properties. // Коллоидный журнал. 2001. Т. 63. № 5. С. 629–636.
8. Широкова И. Ю., Кучук В. И., Беляев А. П., Шевченко Н. Н., Голикова Е. В. Агрегативная устойчивость дисперсных систем. Часть 1. Исследование электроповерхностных свойств и кинетики коагуляции монодисперсных полимерных частиц с карбоксилированной поверхностью. // Бутлеровские сообщения. 2014. Т.37. № 2. С.29–38.
9. Кучук В. И., Широкова И. Ю., Голикова Е. В. Физико-химические свойства водно-спиртовых смесей гомологического ряда низших алифатических спиртов. // Физика и химия стекла. 2012. Т. 38. № 5. С. 625–633.
10. Родионова Е. Ю., Дмитриева И. Б., Чухно А. С. Влияние состава дисперсионной среды на устойчивость и электрокинетические свойства билирубина. // Бутлеровские сообщения. 2014. Т.37. № 1. С.55–61.
11. Беляев А. П., Рубец В. П., Антипов В. В., Бордей Н. С., Зарембо В. И. Фазовый переход пар — кристалл при синтезе пленок парацетамола методом вакуумного испарения и конденсации. // ЖТФ. 2014. Т.84. Вып. 3. С.141–143.
12. Беляев А. П., Рубец В. П., Антипов В. В., Рыбников А. О., Беляева С. А. Кристаллизация парацетамола ромбической формы. // Бутлеровские сообщения. 2014. Т.37. № 3. С.113–119.
13. Кожемякина Н. В., Ананьева Е. П., Гурина С. В., Галынкин В. А. Условия культивирования, состав и биологическая активность мицелия flammulina velutipes (fr.). P. Karst // Прикладная биохимия и микробиология. 2010. Т. 46. № 5. С. 583–586.
14. Беляев А. П., Скворцов А. М., Кучук В. И., Дмитриева И. Б., Бахолдина Л. А., Чухно А. С., Гришин В. В., Купина Н. А., Малахова Е. Е.. Физическая и коллоидная химия. Руководство к практическим занятиям: учебное пособие. / Под ред. проф. А. П. Беляева. — М.: ГЭОТАР-Медиа, 2012. — 320 с.
15. Григоров О. Н. Электрокинетические свойства капиллярных систем. / Григоров О. Н., Козьмина З. П., Маркович А. В., Фридрихсберг Д. А. М. — Л.: Изд-во АН СССР. 1956. 336с.
16. Чухно А. С., Дмитриева И. Б., Силаева Д. С., Сенина А. С., Кошевенко А. С., Назипова А. Р. Сорбция ионов Н+ и ОН- на хлорофилле, влияние рН на устойчивость водных дисперсий хлорофилла. Бутлеровские сообщения. 2013. Т.34. № 5. С.124–130.
17. Крайник И. И., Родионова Е. Ю., Дмитриева И. Б. Исследование электроповерхностных свойств водных дисперсий гемоглобина. // Молодой ученый. 2014. № 14–1. С. 20–24.
18. Чухно А. С., Дмитриева И. Б., Аксинович В. А., Силаева Д. С., Сенина А. С., Кергенцев А. А.. Электроповерхностные свойства оксида кремния(IV) в водных растворах азолов // Бутлеровские сообщения.- 2014. — Т.38. № 5. С.78–83.
19. Dmitriyeva I. B., Tikhomolova K. P., Chukhno A. S., Prokopovich P. P., Starov V. M. Investigation of the electrosurface properties of NiO and Fe2O3 in azole solutions. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 2007. Т. 300. № 3 SPEC. ISS.. P. 315–320.
20. Дмитриева И. Б., Тихомолова К. П., Чухно А. С.. Особенности адсорбции 1,3 — диазола на поверхности оксидов NiО и Fe2О3. // Журн. прикл. химии. 2005. т. 78. Вып. 5. С. 741–746.
21. Дмитриева И. Б., Тихомолова К. П., Чухно А. С.. Адсорбция тетразола на оксидах Ni(II) и Fe(III). // Журн. прикл. химии. 2006. Т. 79. Вып. 1. С. 51–56.
22. А. С. Чухно, И. Б. Дмитриева, К. П. Тихомолова, Н. В. Воронкова. Электроповерхностные свойства оксидов никеля (II) и железа (III) в водных растворах 1,2,4 триазола. Журн. прикл. химии. 2010. т. 83. Вып. 7. С. 1119–1123.
23. Дмитриева И. Б., Чухно А. С., Степина Е. Ю. Влияние тетразола и метилтетразола на электроповерхностные свойства водных суспензий оксида никеля (II). Вестн. С.-Петерб. ун-та. Сер. 4, 2003., вып.4(№ 28), С.57–61.
24. И. Б. Дмитриева, А. С. Чухно. Электроповерхностные свойства оксидов никеля (II) и железа (III) в водных растворах замещенных азолов (производных имидазола и 1,2,4-триазола). Вестн. С.-Петерб. ун-та. 2012. Серия 4: Физика. Химия. Вып. 3. — С. 103–110.
25. Dmitrieva I. B., Chukhno A. S., Rodionova E. Y.,. Novichkov R. V.. Specific Adsorption of Aspartic Acid on Iron (III) and Nickel (II) Oxides.// Eurasian Chemico-Technological Journal. 2012. Т. 14. № 4. С. 299–304.
26. Дмитриева И.Б., Чухно А.С., Новичков Р. В.. Взаимодействие глицина с катионами железа(III) и никеля(II) в водных растворах и на поверхности их оксидов. // Бутлеровские сообщения. 2013. Т.35. № 8. С.133–137.
27. Родионова Е. Ю., Дмитриева И. Б., Чухно А. С. Электрокинетические свойства гемоглобина в водных растворах НСl и KCl. // Бутлеровские сообщения. 2012. Т.30. № 6. С.103–107.
28. Родионова Е. Ю., Дмитриева И. Б., Чухно А. С. Электрокинетические свойства гемоглобина в водных растворах 1-, 2- и 3-зарядных ионов. // Бутлеровские сообщения. 2013. Т.34. № 6. С.135–140.
29. Родионова Е. Ю., Дмитриева И. Б., Чухно А. С. Электрокинетические свойства хлорофилла в водных растворах 1-, 2- и 3-зарядных катионов. // Бутлеровские сообщения. 2013. Т.34. № 6. С.130–134.







