Показана возможность и оптимизированы условия амперометрического титрования Bi(III), Au(III) и Pd(II) растворамиДДТКNa и (ДДТК)2Рbс двумя платиновыми индикаторными электродами в различных по кислотно-основным свойствам средах по току анодного окисления реагента и катодного восстановления ионов титруемых металлов. При проведении эксперимента улучшены метрологические характеристики (воспроизводимость, правильность, расширение диапазона определяемых содержаний, чувствительность, селективность), увеличены области использования метода титрования Bi(III), Au(III) и Pd(II) с целью последующего их применения при контроле составов природных объектов и промышленных материалов.
Ключевые слова: амперометрия, селективность, воспроизводимость, реагент, избирательность,экспрессность.
Введение. Возросшие требования, предъявляемые к аналитическому контролю состава объектов органического происхождения, плохо растворимых в воде на самых различных этапах технологических процессов диктуют повышенные требования к точности, экспрессности, избирательности и расширению диапазона определяемых содержаний разрабатываемых или внедряемых в производство методик анализа. Контролируя содержание металлов на уровне 10–3–10–6 % в моторных и турбинных маслах, бензинах или растворах электролитов химических источников тока, а также в материалах лакокрасочной промышленности, можно с уверенностью диагностировать, прогнозировать износостойкость и коррозийную устойчивость, а также выявить ресурс непрерывной работы и другие технические параметры машин и приборов при условии, что методики определения микросодержаний металлов обеспечивают заданный предел определяемых концентраций с высокой воспроизводимостью и правильностью при самых широких вариациях состава контролируемых веществ и компонентов. К наиболее точным способам индикации конечной точки титрования относятся электрохимические методы, в частности, амперометрические с одним или двумя поляризованными индикаторными электродами.
Теоретический анализ. Известно, что в воде диэтилдитиокарбамат натрия (ДДТКNa) и диэтилдитиокарбамат свинца ((ДДТК)2Pb) образуют со многими катионами весьма прочные и практически нерастворимые в воде комплексные соединения, способные экстрагироваться многими органическими растворителями (бензолом, метилэтилкетоном, тетрахлорметаном, хлороформом и др.). Особенно прочные комплексы образуют Hg(II), Pd(II), Cu(II), Bi(III) и Ag(I). Поэтому возможность и условия проведения амперометрического титрования ионов именно этих элементов и были исследованы в первую очередь.
Предварительные опыты показали, что при титровании вышеназванных катионов в протолитических средах с помощью двух платиновых индикаторных электродов регистрируются четкие кривые титрования  — образной формы, позволяющие надежно и точно находить положение т. э. обычным графическим приёмом. Нахождение конечной точки титрования (КТТ) независимо от природы используемого растворителя отвечают образованию комплексов в молярном соотношении Me:Лиганд–1:1 для ионов одновалентных металлов, 1:2–двухвалентных и 1:3–трехвалентных катионов.
— образной формы, позволяющие надежно и точно находить положение т. э. обычным графическим приёмом. Нахождение конечной точки титрования (КТТ) независимо от природы используемого растворителя отвечают образованию комплексов в молярном соотношении Me:Лиганд–1:1 для ионов одновалентных металлов, 1:2–двухвалентных и 1:3–трехвалентных катионов.
Методика эксперимента. Амперометрическое титрование с двумя платиновыми индикаторными электродами, как следует из вольтамперных характеристик ДДТКNa и (ДДТК)2Рb, необходимо проводить при напряжениях ниже 0,3 В на ацетатном, 0,4 В — нитратном и 0,5 В — перхлоратном фонах, так чтобы одновременно могли протекать процессы окисления титрантов на аноде и восстановления кислорода на катоде. При слишком высоком напряжении и использовании в качестве титранта (ДДТК)2Рb ток может возникнуть и за счет окисления образующихся при реакции ионов свинца на аноде и восстановления кислорода на катоде. В таких условиях кривая титрования имеет 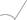 - образную форму с незначительным максимумом на левой ветви.
- образную форму с незначительным максимумом на левой ветви.
С целью оптимизации условий титрования ионов вышеуказанных металлов с двумя индикаторными электродами растворами ДДТКNa и (ДДТК)2Рb было изучено влияние на ход и результаты титрования следующих факторов: величины внешнего напряжения, подаваемого на индикаторные электроды, природы и концентрации фонового электролита, добавок инертного растворителя, различных посторонних катионов, мешающих анионов, ряда комплексующих соединений и других факторов.
Результаты и их обсуждение.
Влияние внешнего напряжения. В соответствии с вольтамперными характеристиками ДДТКNa и (ДДТК)2Рb, всех ионов и молекул, принимающих участие в реакции комплексообразования, а также растворенного кислорода, амперометрическое титрование ионов металлов с двумя платиновыми индикаторными электродами на различных фоновых электролитах следует проводить при напряжении не ниже 0,30 В, так чтобы после т. э. одновременно могли протекать процессы окисления свободного реагента на аноде и восстановления кислорода на катоде. Растворенный в ДМФА и ДМСО кислород начинает восстанавливаться с заметной скоростью только при потенциалах 0,35 В. Напряжение изменяли в диапазоне 0,3–1,1 В ступенями 0,2 В.
Учитывая это обстоятельство, а также указанные значения потенциалов полуволн (Е1/2) ДДТКNa и (ДДТК)2Рb и начало окисления уксусной кислоты, н-пропанола, диметилформамида (ДМФА) или диметилсульфоксида (ДМСО), можно заключить, что амперометрическое титрование катионов, неспособных к восстановлению на платиновом катоде, необходимо проверить при напряжении не менее 0,7 В. При титровании таких катионов как Сu(II), Ag(I), Hg(II) и Au(III), достаточно легко восстанавливающихся уже при нулевом потенциале платинового электрода, напряжение может быть более низким, порядка 0,3–0,5 В [1].
В первом случае индикаторный ток будет возникать после достижения, т. е. за счет окисления свободного ДДТКNа и восстановления кислорода. Кривая титрования при этом должна иметь  - образную форму. Во втором случае будет наблюдаться более высокий ток в самом начале титрования за счет одновременного восстановления титруемых катионов на катоде и окисления самого растворителя на аноде. Этот ток, величина которого лимитируется концентрацией титруемых катионов, будет непрерывно падать по мере приближения к т. э., после прохождения которой, как и в первом случае, возникает непрерывно возрастающий при дальнейшем добавлении титранта ток за счет окисления свободного ДДТКNа и восстановления кислорода.
- образную форму. Во втором случае будет наблюдаться более высокий ток в самом начале титрования за счет одновременного восстановления титруемых катионов на катоде и окисления самого растворителя на аноде. Этот ток, величина которого лимитируется концентрацией титруемых катионов, будет непрерывно падать по мере приближения к т. э., после прохождения которой, как и в первом случае, возникает непрерывно возрастающий при дальнейшем добавлении титранта ток за счет окисления свободного ДДТКNа и восстановления кислорода.
Таким образом, при амперометрическом титровании легко восстанавливающихся катионов на катоде должна получиться V — образная кривая титрования.
Эксперименты показали, что лучшие по форме кривые и правильные результаты титрования ионов металлов получаются при напряжении на индикаторных электродах не ниже 0,5 В.
Было установлено, что при значениях приложенного напряжения меньших 0,4 В при амперометрическом титровании раствором ДДТКNа (0,3 В в случае (ДДТК)2Рb) правая восходящая ветвь кривой получается слишком пологой и быстро отклоняющейся от прямолинейности, приводящая к снижению воспроизводимости формы кривой и, следовательно, к неверности результатов титрования (рис.1).
Как видно из рисунка, оптимальными значениями потенциалов при титровании Pd(II) раствором ДДТКNа являются 0,7–0,9 В, а (ДДТК)2Рb — 0,5–0,7 В, так как именно в этих интервалах наблюдаются более четкие кривые и достаточно правильные и воспроизводимые результаты титрований.
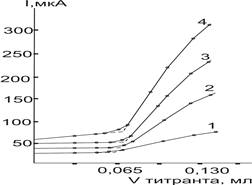
Рис. 1. Кривые титрования Pd(II) 0,004 М раствором ДДТКNа на фоне 0,25 М по ацетату калия в уксусной кислоте при различных напряжениях на индикаторных электродах, В: 1–0,3; 2–0,5; 3–0,7; 4–0,9
Форма кривых амперометрического титрования Pd(II) раствором (ДДТК)2Рb адекватна кривым, полученным при его определении раствором ДДТКNа при потенциалах, меньших на 0,2 В.
Эксперименты показали, что если проводить титрование Cu(II) с омедненными (Hg(II)-амальгамированными) электродами, а Ag(I) с электродами, покрытыми небольшим слоем серебра (поскольку они более чувствительны) при очень небольших напряжениях (0,05–0,2 В), то единственно возможными в этих условиях электродными процессами до т. э. будут: восстановление ионов серебра на катоде и окисление органического растворителя на аноде.
Из рассмотренных вольтамперных характеристик (ДДТК)2Рb на различных фоновых электролитах также следует, что для осуществления титрования различных катионов раствором этого реагента в н-пропаноле напряжения на платиновых индикаторных электродах следует устанавливать в области порядка 0,6–0,9 В.
Влияние величины напряжения на форму кривой и результаты титрования Ni(II) (в качестве примера) было исследовано при следующих оптимальных условиях: фон — 0,25 М ацетат калия, объем титруемого раствора — 10,0 мл, концентрация титранта — 1,10–4–5,10–3моль/л, напряжение изменяли от 0,3 до 1,0 В ступенями 0,1 В [2].
Как показали проведенные исследования, результаты определения ионов металлов правильны (на основании t0,95 статистик смешение незначимо) при напряжении в области 0,30–0,95 В [3]. При снижении его величины (менее 0,30 В) правая ветвь кривой постепенно теряет крутизну, ее прямолинейный участок укорачивается, что приводит к резкому снижению надежности определения КТТ и неправильности результатов титрования. Эксперименты показали, что наиболее оптимальным напряжением следует считать 0,40–0,95 В и при этом расход титранта в т. э., найденный обычным графическим способом, хорошо воспроизводится и пропорционален взятому количеству ионов металлов.
С целью получения более четких кривых амперометрического титрования в последующих опытах напряжение на электродах было увеличено до 0,9 В. При таком напряжении правая ветвь кривой становятся более крутой и ее область плавного искривления значительно уменьшается.
Влияние природы и концентрации фонового электролита. Так как кислотно-основные свойства и концентрация фонового электролита оказывают весьма существенное влияние на форму кривой, условия и результаты титрования ионов металлов, то влияние его природы и концентрации было детально изучено при напряжении 0,5–0,8 В (в зависимости от природы титруемой среды). Было исследовано влияние трех фоновых электролитов, отличающихся по своей природе: ацетата калия, нитрата и перхлората лития, проявляющих соответственно основные, нейтральные и кислые свойства.
Эксперименты показали, что сравнительно лучшие по форме кривые титрования P(II)d и Ag(I) регистрируются в присутствии ацетата калия, а Hg(II) — на фоне перхлората лития. На остальных же фонах (особенно при титровании палладия) кривые имеют менее чуткую форму с большим разбросом точек и дополнительным изломом на левой ветви кривой титрования (рис. 2).
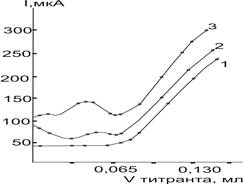
Рис. 2. Кривые титрования Pd(II) раствором ДДТКNа на фоне 0,2 М по ацетату калия (1), нитрату лития (2), перхлорату лития (3) в уксусной кислоте, Е=0,8 В.
Исключение составляет кривая титрования Bi(III). По-видимому, комплексообразование на нитратном и перхлоратном фонах с двух- и трехзарядными катионами протекает с образованием промежуточных комплексов с соотношением компонентов в них 1:1, переходящие затем в комплексы нормального состава. Однако дополнительная т. э. предполагаемого процесса выражена плохо (менее четко) и не вполне совпадает с его стехиометрией. С увеличением концентрации нитрата и перхлората лития вышеуказанные аномалии соответственно увеличиваются.
Титрование Cu(II) проводили на перхлорате лития, так как при его замене на ацетат калия, хотя положение КТТ не изменяются, но область плавного закругления становиться более значимой.
Изменение концентрации ацетата калия оказывает заметное влияние на форму кривой титрования ионов металлов только в области очень малых (менее 0,05 М) или наоборот, в области высоких концентраций электролита (более 0,35 М).
Опыты показали, что титрование Au(III) растворами ДДТКNа и (ДДТК)2Рb в диапазоне концентрации фонового электролита 0,1–0,3 М протекает сравнительно быстро, при этом форма кривой титрования, ее чёткость и положение КТТ практически не изменяются при варьировании концентрации фонового электролита. При слишком высокой его концентрации (более 0,5 М) форма кривой амперометрического титрования ухудшается: правая ветвь быстро теряет крутизну и линейность, область плавного перехода между ветвями увеличивается, а положение т. э. сдвигается в сторону завышения. При весьма малой концентрации фона из-за низкой электропроводности анализируемого раствора правая ветвь кривой титрования становится изогнутой и КТТ при этом, хотя и незначительно, смещается в сторону завышения.
Результаты определения 76,62 мкг Au(III) растворами ДДТКNа и (ДДТК)2Рb в ДМФА и ДМСО при различных концентрациях ацетата аммония (0,1–0,4 М) свидетельствует о высокой точности (Sr не более 0,012) разработанного амперометрического метода определения.
Совсем по иному влияет концентрация нитрата и перхлората лития на титрование Au(III); при увеличении их содержания (от 0,1 до 0,5 М) обе ветви кривой практически не изменяют своего наклона к оси абсцисс. Возрастает лишь область плавного искривления между ветвями.
Как показали эксперименты, при концентрациях ацетата натрия (0,025–0,6 М) результаты амперометрического титрования Bi(III) раствором ДДТКNа получаются правильными и достаточно хорошо воспроизводимыми. Лишь при высокой концентрации фонового электролита (более 0,65 М) форма кривой титрования Bi(III) начинает ухудшаться, а результаты определения становятся завышенными.
Титрование Bi(III) возможно также и на нитрате лития. На этом фоне титрование протекает немного быстрее, чем на ацетате калия и аммония. Расход титранта в КТТ изменяется пропорционально введенному количеству Bi(III), но положение т. э. не совсем правильно отвечает стехиометрии образования нормального тиокарбамината металла, как это имеет место при титровании этого катиона на ацетатном фоне. При этом на один атом висмута приходится две молекулы ДДТКNа, т. е. образуется смешанно-лигандные комплексы состава ВiNO3(ДДТК)2 с соотношением Висмут:ДДТКNа=1:2. Необходимо подчеркнуть, что такое соотношение компонентов в комплексе наблюдалось и при титровании ионов этого же металла раствором (ДДТК)2Рb в безводной уксусной кислоте.
Кривая амперометрического титрования Bi(III) на фоне нитрата лития имеет хорошо выраженную V– образную форму, а не  — образную, как это наблюдалось при его титровании на ацетатном фоне.
— образную, как это наблюдалось при его титровании на ацетатном фоне.
Причиной такого различия в форме титрования Bi(III), по-видимому, является то, что на ацетатном фоне этот катион образует устойчивый комплекс, чем на нитратном, ввиду того, что ацетатные комплексы Bi(III) гораздо устойчивее нитратных. Поэтому на нитратном фоне Bi(III) восстанавливается при менее отрицательном потенциале катода, чем на ацетатном, благодаря этому на нитратном фоне при напряжении 0,6 В одновременно может окисляться н-пропанол на аноде и восстанавливаться Bi(III) на катоде, что обуславливает индикаторный ток до т. э.
Для установления оптимальной концентрации нитрата лития были проведены определения одного и того же количества Bi(III) при прочих равных условиях и возрастающей концентрации используемого фона. Результаты этих опытов свидетельствуют о том, что сравнительно точные результаты получаются в области концентраций нитрата лития от 0,025 до 0,4 М. За пределами этого интервала ухудшаются вид кривой титрования и соответственно воспроизводимость и правильность определений.
В отличие от титрования Bi(III) при определении Cu(II) лучшие по форме кривые амперометрического титрования наблюдаются на ацетатном фоне. На нитрате и перхлорате же лития титрование протекает значительно медленнее и с невысокой воспроизводимостью и правильностью результатов определения. Поэтому, все дальнейшие титрования Cu(II) раствором (ДДТК)2Рb проводились только на ацетате калия или аммония. Изменение концентрации фона в широких пределах (0,03–0,5М) при Е=0,85 В практически не сказывается на результатах титрования. Однако, форма кривой титрования Cu(II) заметно меняется: с повышением концентрации фона ее правая ветвь становится круто наклоненной, а левая, наоборот, уменьшает свою крутизну.
Эксперименты показали, что амперометрическое титрование Ag(I) растворами ДДТКNа и (ДДТК)2Рb протекает достаточно быстро и четко только на ацетатном фоне, а на нитрате и перхлорате лития не удается получить достаточно воспроизводимых и правильных результатов. Расход титранта в т. э. на ацетате калия пропорционален взятому количеству Ag(I). Изменение концентрации этого фона в пределах 0,1–0,3 M практически не влияет на форму кривой (рис.3) и результаты титрования серебра(I).
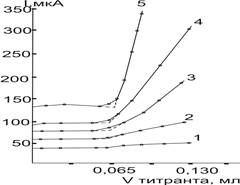
Рис. 3. Влияние концентрации ацетата аммония на форму кривой титрования Ag(I) раствором (ДДТК)2Рb (Е=0,75 В). Концентрация фона, моль/л: 1- 0,1; 2- 0,2; 3–0,3; 4–0,4.
Согласно проведенным экспериментальным данным, полученным при титровании ионов различных металлов можно заключить, что изменение концентрации фонового электролита — ацетата калия или аммония в исследуемом растворе (0,03–0,04 M) форма и четкость кривой амперометрического титрования остается практически неизмененным, однако, результаты определения при слишком высокой концентрации фона (более 0,4 M) заметно завышены. При слишком малой их концентрации (менее 0,2 M) резко ухудшается форма кривой титрования: её правая ветвь становится менее крутой и быстро теряет свою прямолинейность, загибаясь к оси объемов.
Таким образом, при титровании ионов различных металлов (за исключением ионов висмута) растворами ДДТКNа и (ДДТК)2Рb лучшим фоновым электролитом считается ацетат калия с оптимальной концентрацией в диапазоне 0,1–0,25 M [4].
Влияние природы и концентрации инертного растворителя. С целью установления возможности применения предлагаемого амперометрического метода с двумя индикаторными электродами для определения ионов металлов непосредственно в экстрактах или в органических объектах было изучено влияние четыреххлористого углерода, хлороформа, бензола и др. растворителей, чаше всего и широко применяющихся в качестве экстрагентов, на условия и результаты титрования растворами ДДТКNа и (ДДТК)2Рb. Титрование проводили при оптимальных условиях, за исключением того, что в анализируемом растворе та или иная часть протолитического растворителя заменялась на инертный растворитель (от 10,0 до 60,0 об. %).
Поскольку характер влияния всех изучавшихся инертных растворителей на форму кривой амперометрического титрования ионов исследованных металлов оказался приблизительно одинаковым, то для иллюстрации приведены только кривые титрование Bi(III) в присутствии четыреххлористого углерода (рис.4)
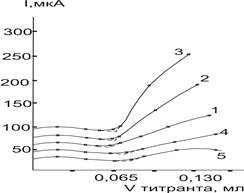
Рис. 4. Влияние добавок CCl4 на форму титрования Bi(III) раствором ДДТКNа на 0,25 М ацетате калия в н-пропаноле (∆Е=0,85 В). Содержание ССl4, об %: 1–0,4; 2–10,0; 3–20,0; 4–40,0; 5–60,0
Из рисунка видно что, возрастающие добавки инертных растворителей (30 об. %) сначала оказывают незначительное влияние на форму кривых амперометрического титрования ионов металлов. Лишь только начиная с 40 об. % содержания инертного растворителя мешающее влияние становится существенным: правая восходящая ветвь кривой начинает терять крутизну.
Эксперименты показали, что на форму кривых и результаты амперометрического титрования Bi(III) наименьшее влияние оказывают добавки четыреххлористого углерода. Даже при его содержании 40 об. % результаты титрования получаются все еще правильными и воспроизводимыми. Гексан начинает завышать результаты титрования ионов металлов при содержании, превышающем 35,0 об. %, а хлороформ и бензол — с 25,0 и 30,0 об. % соответственно.
Как показали экспериментальные данные, при титровании Pd(II), Hg(II), Bi(III), Ag(I), Au(III) и др. металлов добавление возрастающих количеств любого из изученных неводных растворителей сначала заметно улучшает форму кривой амперометрического титрования — ее правая ветвь становится более крутой, а область плавного искривления уменьшается, что свидетельствует о повышении эффективной константы устойчивости (ЭКУ) комплекса под влиянием добавки инертного растворителя.
Кроме того, его добавки всегда приводят к заметному ускорению установления равновесия после каждого добавления титранта. Особенно благоприятно влияют на форму кривой титрования добавки хлороформа. Однако начиная приблизительно с 30–50 об. % (в зависимости от природы растворителя) добавляемого инертного растворителя, крутизна правой ветви кривой титрования вследствие снижения электропроводности исследуемого раствора непрерывно понижается по мере повышения его содержания. Следует отметить, что резкость наклона кривой амперометрического титрования после т. э. во всех случаях увеличивается с повышением концентрации (до предельно допустимых содержаний) любого из изученных инертных растворителей, что свидетельствует о повышении степени прочности образующегося комплекса металла.
Таким образом, на основании проведенных нами исследований можно заключить, что добавление к протолитическим растворителям небольших количеств инертного растворителя (не более 30–40 об. %) приводит к значительному повышению четкости кривой титрования и, следовательно, к повышению точности определений. Оптимальное содержание инертного растворителя, при котором получаются наилучшие результаты титрований, зависит от его природы. Наиболее точное значение этой величины получено для хлороформа (45 об. %), бензола (50 об. %) и метилэтилкетона (40 об. %).
Отсюда следует, что лучше всего проводить амперометрическое титрование ионов изученных металлов в бензольных и хлороформных экстрактах, так как в их присутствии получаются наилучшие по форме кривые титрования с наименьшей затратой протолитического растворителя.
При титровании в других смесях (гексане, четыреххлористом углероде метилэтилкетоне) для обеспечения оптимальных условий титрования, как показали эксперименты, в достигнутых условиях проведения анализа при титровании 3–1000 мкг Cu(II) и Bi(III) относительное стандартное отклонение не превышает 0,03. На нитратном же фоне оно не превышает 0,02. Достаточно точное титрование меньших количеств Bi(III) (до I мкг в 10,0 мл раствора) также возможно, если использовать 5·10–4 М стандартный раствор реагента. Результаты титрования Ni(II) и Ag(I) также правильны и воспроизводимы [5].
Заключение. Таким образом, предлагаемая методика титрования ионов различных металлов раствором ДДТКNа обладает вполне удовлетворительными точностью и быстротой выполнения анализа.
Было также проверено изменение основных характеристик разработанной методики, если вместо ДДТКNа в качестве титранта использовать (ДДТК)2Рb. Опыты показали, что амперометрическое титрование ионов различных металлов раствором (ДДТК)2Рb протекает с такой же скоростью, как и при титровании раствором ДДТКNа и также приводит к образованию такого же состава. Однако, при титровании раствором (ДДТК)2Рb получаются менее правильные и воспроизводимые результаты.
Оценка правильности и воспроизводимости разработанных методик. С целью статистической оценки правильности и воспроизводимости предлагаемых методик были проведены амперометрические титрования различных количеств Hg(II), Ag(I), Au(III), Pd(II), Bi(III) и Cu(II) растворами ДДТКNа и (ДДТК)2Рb на различных по природе фоновых электролитах в уксусной кислоте, н-пропаноле и ДМФА, содержащих 30 об. % СНСI3, при большом числе параллельных определений.
Условия титрования: 0,25 М ацeтат калия, напряжение на электродах 0,80 В и 0,65 В, объем исследуемого раствора 10,0 мл, концентрации используемых титрантов 0,004 М ДДТКNа и (ДДТК)2Рb. Результаты титрования ионов металлов, обработанные методом математической статистики, показывают, что для всех содержаний металлов получаются достаточно хорошо воспроизводимые результаты, близкие и соответствующие взятым количествам. Относительное стандартное отклонение (Sr) при титровании 10–1000 мкг ионов исследованных металлов ДДТКNа не превышает 0,039, а (ДДТК)2Рb- 0,087.
Воспроизводимость и правильность результатов титрования различных количеств металлов в оптимальных условиях показывают, что при титровании катионов раствором ДДТКNа результаты получаются более точными, чем при их определении (ДДТК)2Рb.
Вi(III) при амперометрическом титровании образует несколько менее прочные комплексы с ДДТК-ионами, чем Ag(I), Pd(II) и Hg(II), но все же прочнее тиокарбаминатного комплекса Pb(II). Поэтому обменная реакция 2Bi3+ + 3Рb(ДДТК)2 → 3Рb2+ + 2Вi(ДДТК)3 должна протекать количественно.
Эксперименты показали, что Bi(III) титрируется также быстро, как на фоне 0,25 М по ацетату калия или натрия, так и на фоне 0,20 М по перхлорату лития, при этом, полученные результаты достаточно правильны и воспроизводимы. В отличие от титрования Hg(II), Pd(II) и Ag(I) область плавного искривления кривых титрование Bi(III) гораздо больше, что связанно с меньшей прочностью его карбаминатного комплекса. Тем не менее положении КТТ воспроизводится, её абсцисса прямо пропорциональна взятому количеству Bi(III).
В водной среде AuCI3 взаимодействует с ДДТК-ионами нестехиометрически и поэтому реагенты, основу которых составляют карбаминовая кислота и ее аналоги, широко используемые в качестве аналитических титрантов ионов благородных металлов, редко применяются для определения Au(III). Поэтому представляло интерес проведения амперометрического титрования ионов этого металла растворами ДДТКNа и (ДДТК)2Рb в ДДФА и ДМСО, так как предварительные опыты были обнадеживающими.
Результаты титрования 5–1000 мкг Au(III) растворами ДДТКNа и (ДДТК)2Рb показывают, что полученные данные правильны и воспроизводимы, а Sr во всех случаях не превышает 0,033.
Подводя итог рассмотрению амперометрического титрования ионов различных металлов растворами ДДТКNа и (ДДТК)2Рb в безводной уксусной кислоте можно заключить, что для исследованных количеств Pd(II), Hg(II), Cu(II), Bi(III) и Ag(I) получаются достаточно правильные и воспроизводимые результаты, а между введенным и найденным количествами ионов металлов на основании t0.095 статистик значимых расхождений не обнаруживается. Sr при титровании 5–1000 мкг ионов изученных металлов растворами ДДТКNа и (ДДТК)2Рb не превышает 0,03, а СН составляет 2 мкг в 10,0 мл анализируемого раствора.
Литература:
1. Геворгян А. М., Талипов Ш. Т., Хадеев В. А., Мухамеджанова Д. В. Вольт-амперометрическое поведение диэтилдитиокарбамината натрия на платиновом аноде в среде диметилформамида// Журн. аналит. химии. 1980. Т. 35. № 10. С. 2026–2028.
2. Лурье Ю. Ю. Справочник по аналитической химии.-М.:Химия.1979. С. 230–236
3. Фишер Р. А. Статистические методы для исследователей, занимающихся определением благородных элементов. М.; Мир. 1988. 287 с.
4. Геворгян А. М., Яхшиева З. З., Киреев Г. В. Комплексонометрическая амперометрия при определении благородных металлов в объектах окружающей среды. Тез. докл. Респ. научно-прак. конф. «Кимёнинг долзарб муаммолари» Самарканд. 2009. С. 65–66.
5. Геворгян А. М., Талипов Ш. Т., Хадеев В. А., Мирзоян И. И. Вольтамперные кривые окисления тионалида на платиновом микроаноде в ледяной уксусной кислоте.// Депонир. в ВИНИТИ № 4616–81 от 24.09.81. С. 1–3.







