Исследованияв работе направлены на изучение адсорбционных свойствв мицелия Abortiporusbiennis. В качестве методов исследования были выбраны потенциометрическое титрование и микроэлектрофорез. Определены изоэлектрическая точка и точка нулевого заряда частиц мицелия.
Ключевые слова: Abortiporus biennis, потенциометрическое титроание, изоэлектрическая точка, точка нулевого заряда..
Адсорбцию можно определить как изменение концентраций растворенных веществ в поверхностном слое по сравнению с их концентрацией в объеме фаз. Классическая ионообменная адсорбция реализуется за счет простого электростатического взаимодействия. Любая другая адсорбция является специфической. Механизмы специфической адсорбции, виды взаимодействий адсорбата с поверхностью могут быть различны. В случаи специфической адсорбции на поверхности могут происходить различные химические взаимодействия с образованием ковалентных, донорно-акцепторных, ионных и водородных связей. В случаи адсорбции электролитов на границе раздела фаз происходит образование двойного электрического слоя (ДЭС). Исследования процессов адсорбции и изучение свойств ДЭС взаимосвязаны.
Для дисперсных систем, в том числе и мицелия, заряд поверхности определяется количеством адсорбированных Н+- и ОН- -ионов, которые для мицелия являются потенциалопределяющими ионами. Величина рН растворов, при которой заряд поверхности равен нулю, называется рН точки нулевого заряда и обозначается рНтнз. В рНтнз адсорбция Н+- и ОН--ионов одинакова (Гн+=Гон-). Значение рНтнз определяют по результатам потенциометрического титрования.
Еще одной характеристикой частиц дисперсии является изоэлектрическая точка (рНИЭТ). рНИЭТ соответствует такому значению рН при котором электрокинетический потенциал (ζ) равен 0.
Большой интерес представляет изучение коллоидных свойств мицелия базидиомицетов, данная работа является продолжением этих исследований [1]. Мицелий грибов в основном состоит из полисахаридов и белков, коллоидные свойства которых были исследованы в более ранних работах [2–6]. В настоящие время широко исследуются физико- химические и коллоидные свойства систем содержащих сложные биологически активные соединения, а также устойчивость их дисперсий [7–10]. Исследование адсорбционных свойств мицелия позволит использовать его в качестве носителя лекарственных препаратов, включая новые лекарственные формы, разрабатываемые в настоящее время в академии [11–12].
Целью данной работы является изучение адсорбционных свойств мицелия базидиомицета Abortiporusbiennis(Ab. biennis), а также сопоставление рНтнз и рНИЭТ мицелия.
Существуют два метода изучения адсорбционных процессов: электрокинетические исследования и прямые адсорбционные измерения. Прямое измерение количества адсорбированного вещества позволяет оценить адсорбционную и буферную емкость сорбентов. Для использования мицелия в качестве носителя лекарственных средств необходимо определить его адсорбционную емкость. Количество активных центров на поверхности мицелия можно оценить методом непрерывного потенциометрического титрования.
Мицелий грибов получали методом глубинного культивирования в жидкой глюкозо-пептонной питательной среде (ГПС) следующего состава: пептон — 2,5 г/л; глюкоза — 10 г/л; NaCl — 0,5 г/л; СаСl2–0,5 г/л; MgS04–0,5 г/л; КН2Р04–0,6 г/л; К2НР04–0,4 г/л; ZnSO4–0,001 г/л; MnSO4–0,05 г/л; мальт-экстракт — 1,6 г/л; рН 6,0. Стерилизацию среды проводили в автоклаве в течение 30 минут при избыточном давлении 0,5 атм [13–14]. Для посевного материала использовали культуру, выращенную в статических условиях 10–14 дней, в ГПС при температуре 24°С. Перед внесением посевного материала в колбы для ферментации его встряхивали до образования мелких фрагментов мицелия. Суспензию посевного материала вносили в ферментационные колбы в количестве 7 % от объема питательной среды.
Культуру выращивали в колбах Эрленмейера вместимостью 750 мл (объем питательной среды 150 мл) на лабораторной качалке (n = 220 об/мин). Культивирование проводили 8 суток при температуре 23–24оС.
рНтнз находили методом непрерывного потенциометрического титрования [15–16]. В ячейку для потенциометрического титрования помещали 25 мл исследуемой дисперсии, 30 минут пропускали воздух, освобожденный от СО2 и титровали раствором КOH (0,0129 моль/л) или НС1 (0,010 моль/л). Титрант вводили порциями по 0,1 мл с помощью микробюретки с интервалом в 1 минуту. Растворы КOH готовили на дистиллированной воде, предварительно освобожденной от СО2 воздуха кипячением в течение 30 минут. После каждой добавленной порции титранта измеряли значения рН раствора. Регистрация рН осуществляется на рН-метре — милливольтметре рН-673 с точностью измерения рН ±0,05 единиц рН.
По результатам потенциометрического титрования были построены зависимости рН исследуемого раствора от объема добавленного титранта (V, мл) для растворов без адсорбента и с адсорбентом. Значение рН точки пересечения кривых титрования с адсорбентом и без него соответствует условию равенства адсорбированных Н+ и ОН- -ионов — это соответствует рНТНЗ. Слева от рНТНЗ преобладает адсорбция ионов Н+ в результате чего поверхность заряжается положительно, а справа преобладает адсорбция ОН- — поверхность мицелия заряжается отрицательно. Методом потенциометрического титрования определяли разницу между адсорбцией ионов Н+ и ОН-. Кривые титрования с адсорбентом и без сравнивали и определяли рНТНЗ. Погрешность измерения значений рН составила 0,05 единиц рН. Ранее метод был отработан на порфиринах [17–18].
Электрокинетический потенциал (ζ-потенциал) частиц мицелия определяли методом микроэлектрофореза [16]. Погрешность измерений электрокинетического потенциала не превышала 10 %.
Величина ζ рассчитывалась по уравнению Гельмгольца-Смолуховского. Уравнение использовалось без поправок, так как выполнялись условия k×a>>1, где k — обратная толщина ДЭС, а — радиус частиц. Изучение электрокинетических свойств водных дисперсий мицелия проводилось в зависимости от рН водной фазы.
Прежде чем использовать методику для изучения мицелия, она была отработана как на простых оксидах [19–25], так и на сложных биологических системах [26–28].
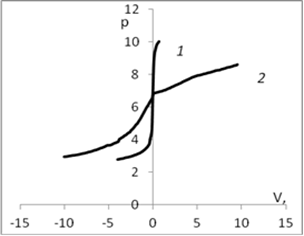
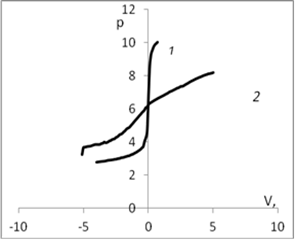
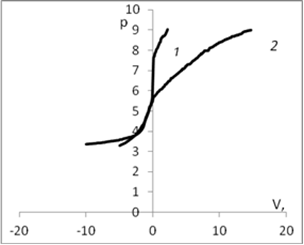
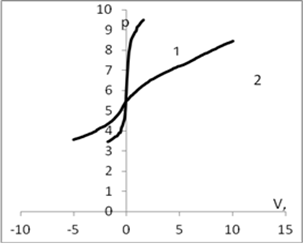
Для определения рНтнз для мицелия Ab.biennis был проведен ряд экспериментов потенциометрического титрования с различными неорганическими электролитами, по результатам которых были построены кривые. Рис. 1.
а) б)
в) г)
Рис. 1. График потенциометрического титрования: а) 1 — кривая титрования воды; 2 — кривая титрования дисперсии мицелия Ab. biennis в воде; б) 1 — кривая титрования раствора КСl (0,01 моль/л); 2 — кривая титрования дисперсии мицелия Ab. Biennisc КСl (0,01 моль/л); в) 1 — кривая титрования раствора СаСl2 (0,01 моль/л); 2 — кривая титрования дисперсии мицелия Ab. Biennisc СаСl2 (0,01 моль/л); г) 1 — кривая титрования раствора K2SO4 (0,01 моль/л); 2 — кривая титрования дисперсии мицелия Ab. Biennisc K2SO4 (0,01 моль/л).
На рис. 1. приведены кривые потенциометрического титрования мицелия водных растворах различных электролитов (вода, хлорид калия 0,01 моль/л, сульфат калия 0,01 моль/л, хлорид кальция 0,01моль/л/). Точка пересечения кривой с адсорбентом (2) и без адсорбента (1) соответствует равенству количества адсорбированных ионов водорода и гидроксила и является точкой нулевого заряда (рНтнз)[1].
В области рН меньше рНтнз кривая с мицелием идет выше, чем кривая без мицелия, вследствие адсорбции Н+ ионов. Поверхность в этой области имеет положительный заряд. В области рН больше рНтнз кривая с мицелием идет ниже, вследствие адсорбции ОН—ионов, что эквивалентно десорбции Н+.
Из рисунка видно, что с ростом ионов калия в растворе рНтнз смещается в кислую область, что свидетельствует о незначительной специфической сорбции катионов калия. Это смещение увеличивается с ростом концентраций в соответствие с теоретическими представлениями о специфической адсорбции. Сравнение показывает, что влияние катиона кальция выше, чем катиона калия, что по-видимому связано с тем, что ион кальция двухзарядный.
Максимальные значения адсорбции в области высоких значений рН соответствуют количеству отрицательных активных центров на поверхности мицелия. Минимальные значения в области низких рН — количеству положительных активных центров.
Важно отметить, что для биполярных сорбентов, коим является мицелий или белки, количество адсорбированного вещества зависит не только от концентрации адсорбата, но и от значений рН водной среды, при которых идет процесс адсорбции [29].
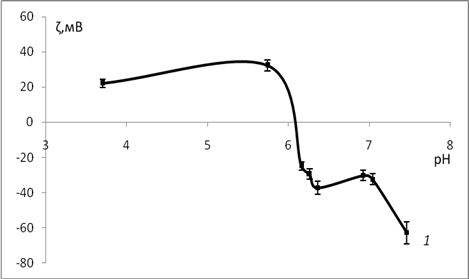
Рис. 2. Зависимость электрокинетического потенциала мицелия в водных растворах от рН.: 1 — через 24 часа после приготовления дисперсии.
Следующим действием была определена изоэлектрическая точка мицелия. Для этого рассматривалась зависимость ζ- потенциала мицелия Ab. Biennis от рН его водных дисперсий (рис. 2). рН водный фазы создавался добавлением необходимых количеств соляной кислоты и гидроксида калия. Из рис. 2 видно, что рНИЭТ= 6,1. В области рН<рНиэт, поверхность мицелия заряжена положительно вследствие преобладания адсорбции ионов водорода, при рН>рНиэт поверхность заряжена отрицательно из-за адсорбции гидроксид ионов.
В работе определены значения рНтнз и рНиэт для мицелия базидиомицета Ab. Biennis. Сорбция будет происходить максимально эффективно при =6,1–6,5 и 6,9–7,5. В области рН<рНтнз мицелий заряжен положительно, а рН>рНиэт отрицательно, что согласуется с результатами электрокинетических измерений. Отметим, что величина отрицательного заряд больше, чем положительного.
Литература:
1. Бриллиантова Е. Ю., Чухно А. С., Ананьева Е. П., Гурина С. В., Банкина А. Н. Исследование адсорбционных свойств мицелия базидиомицета Poliporus ciliatus. // Молодой ученый. 2014. № 18. С. 116–120.
2. Чухно А. С., Дмитриева И. Б., Мартынов Д. В.. Влияние солей одно-, двух- и трехзарядных катионов металлов на сорбцию Н+ и ОН- ионов на декстране. // Бутлеровские сообщения. 2011. Т.27. № 14. С. 47–54.
3. Чухно А. С., Дмитриева И. Б., Мартынов Д. В.. Изоэлектрическая точка белков в водных растворах азолов. // Вестник СПбГУ. 2011. Серия 4: Физика. Химия. Вып. 2. С.124–133.
4. Чухно А. С., Дмитриева И. Б., Колодеева С. С., Мартынов Д. В.. Адсорбция ионов Н+ и ОН- на коллагене. // Вестник СПбГУ. 2011. Серия 4: Физика. Химия. Вып. 3. С. 87–95.
5. Чухно А.С., Дмитриева И.Б., Банкина А.Н., Бриллиантова Е.Ю. Изучение взаимодействия белков с биологически активными азотсодержащими гетероциклическими соединениями при различных значениях pH. // Бутлеровские сообщения. 2013. Т.34. № 5. С.91–99.
6. Чухно А. С., Банкина А. Н., Бриллиантова Е. Ю.. Кинетика процесса набухания желатины в водных растворах азолов. // Бутлеровские сообщения.- 2014. — Т.38. № 5. С.84–88.
7. Men'shikova A.Yu., Skurkis Yu.O., Kuchuk V. I., Dmitrieva I. B., Evseeva T. G., Shabsel's B. M. Effect of the surface structure of poly(styrene-co-acrolein) microspheres and its modification by protein on electrosurface properties. // Коллоидный журнал. 2001. Т. 63. № 5. С. 629–636.
8. Широкова И. Ю., Кучук В. И., Беляев А. П., Шевченко Н. Н., Голикова Е. В. Агрегативная устойчивость дисперсных систем. Часть 1. Исследование электроповерхностных свойств и кинетики коагуляции монодисперсных полимерных частиц с карбоксилированной поверхностью. // Бутлеровские сообщения. 2014. Т.37. № 2. С.29–38.
9. Кучук В. И., Широкова И. Ю., Голикова Е. В. Физико-химические свойства водно-спиртовых смесей гомологического ряда низших алифатических спиртов. // Физика и химия стекла. 2012. Т. 38. № 5. С. 625–633.
10. Родионова Е. Ю., Дмитриева И. Б., Чухно А. С. Влияние состава дисперсионной среды на устойчивость и электрокинетические свойства билирубина. // Бутлеровские сообщения. 2014. Т.37. № 1. С.55–61.
11. Беляев А. П., Рубец В. П., Антипов В. В., Бордей Н. С., Зарембо В. И. Фазовый переход пар — кристалл при синтезе пленок парацетамола методом вакуумного испарения и конденсации. // ЖТФ. 2014. Т.84. Вып. 3. С.141–143.
12. Беляев А. П., Рубец В. П., Антипов В. В., Рыбников А. О., Беляева С. А. Кристаллизация парацетамола ромбической формы. // Бутлеровские сообщения. 2014. Т.37. № 3. С.113–119.
13. Ананьева Е. П., Гурина С. В., Алексеева Г. М. Изучение условий культивирования и антиоксидантной активности мицелия базидиомицета Phallus impudicus (веселка обыкновенная). // Проблемы медицинской микологии. 2014. Т. 16. № 3. С. 80–82.
14. Кожемякина Н. В., Ананьева Е. П., Гурина С. В., Галынкин В. А. Условия культивирования, состав и биологическая активность мицелия flammulina velutipes (fr.). P. Karst // Прикладная биохимия и микробиология. 2010. Т. 46. № 5. С. 583–586.
15. Беляев А. П., Скворцов А. М., Кучук В. И., Дмитриева И. Б., Бахолдина Л. А., Чухно А. С., Гришин В. В., Купина Н. А., Малахова Е. Е.. Физическая и коллоидная химия. Руководство к практическим занятиям: учебное пособие. / Под ред. проф. А. П. Беляева. — М.: ГЭОТАР-Медиа, 2012. — 320 с.
16. Григоров О. Н. Электрокинетические свойства капиллярных систем. / Григоров О. Н., Козьмина З. П., Маркович А. В., Фридрихсберг Д. А. М. — Л.: Изд-во АН СССР. 1956. 336с.
17. Чухно А. С., Дмитриева И. Б., Силаева Д. С., Сенина А. С., Кошевенко А. С., Назипова А. Р. Сорбция ионов Н+ и ОН- на хлорофилле, влияние рН на устойчивость водных дисперсий хлорофилла. Бутлеровские сообщения. 2013. Т.34. № 5. С.124–130.
18. Крайник И. И., Родионова Е. Ю., Дмитриева И. Б. Исследование электроповерхностных свойств водных дисперсий гемоглобина. // Молодой ученый. 2014. № 14–1. С. 20–24.
19. Чухно А. С., Дмитриева И. Б., Аксинович В. А., Силаева Д. С., Сенина А. С., Кергенцев А. А.. Электроповерхностные свойства оксида кремния(IV) в водных растворах азолов // Бутлеровские сообщения.- 2014. — Т.38. № 5. С.78–83.
20. Dmitriyeva I. B., Tikhomolova K. P., Chukhno A. S., Prokopovich P. P., Starov V. M. Investigation of the electrosurface properties of NiO and Fe2O3 in azole solutions. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 2007. Т. 300. № 3 SPEC. ISS.. P. 315–320.
21. Дмитриева И. Б., Тихомолова К. П., Чухно А. С.. Особенности адсорбции 1,3 — диазола на поверхности оксидов NiО и Fe2О3. // Журн. прикл. химии. 2005. т. 78. Вып. 5. С. 741–746.
22. Дмитриева И. Б., Тихомолова К. П., Чухно А. С.. Адсорбция тетразола на оксидах Ni(II) и Fe(III). // Журн. прикл. химии. 2006. Т. 79. Вып. 1. С. 51–56.
23. Гришина А. В., Беляев А. П., Гришин В. В. Исследование окислительных и адсорбционных свойств двуокиси марганца по отношению к протонам и гидроксилам к и сульфаниламидам. // Молодой ученый. 2014. № 18. С. 121–123.
24. Dmitrieva I. B., Chukhno A. S., Rodionova E. Y.,. Novichkov R. V. Specific Adsorption of Aspartic Acid on Iron (III) and Nickel (II) Oxides.// Eurasian Chemico-Technological Journal. 2012. Т. 14. № 4. С. 299–304.
25. Дмитриева И.Б., Чухно А.С., Новичков Р. В.. Взаимодействие глицина с катионами железа(III) и никеля(II) в водных растворах и на поверхности их оксидов. // Бутлеровские сообщения. 2013. Т.35. № 8. С.133–137.
26. Родионова Е. Ю., Дмитриева И. Б., Чухно А. С. Электрокинетические свойства гемоглобина в водных растворах НСl и KCl. // Бутлеровские сообщения. 2012. Т.30. № 6. С.103–107.
27. Родионова Е. Ю., Дмитриева И. Б., Чухно А. С. Электрокинетические свойства гемоглобина в водных растворах 1-, 2- и 3-зарядных ионов. // Бутлеровские сообщения. 2013. Т.34. № 6. С.135–140.
28. Родионова Е. Ю., Дмитриева И. Б., Чухно А. С. Электрокинетические свойства хлорофилла в водных растворах 1-, 2- и 3-зарядных катионов. // Бутлеровские сообщения. 2013. Т.34. № 6. С.130–134.
29. Кергенцев А. А., Дмитриева И. Б., Чухно А. С. Определение точки нулевого заряда молекул альбумина в водных дисперсиях при различных концентрациях хлорида калия. // Молодой ученый. 2014. № 18. С. 123–126.







