В работе исследована устойчивость водных дисперсий декстрана в растворах одно-, двух- и трёхзарядными электролитов фотометрическим титрованием. Из полученных данных можно сказать, что дисперсная система наименее устойчива при рН= 4,01. При рН= 1,68 и 6,86 коагуляция происходит только под действием электролитов.
Ключевые слова: устойчивость, фотометрический метод, декстран.
Декстраны являются полимерами глюкозы (полигликозиды), могут иметь различную степень полимеризации. В зависимости от этого растворы, получаемые из них, имеют различное функциональное назначение, чем и привлекают внимание исследователей (биохимиков, физиологов и т. д.). Растворы, содержащие декстран, используются в качестве гемодинамических средств, восстанавливающих объем циркулирующей крови, поднимают и удерживают на высоком уровне артериальное давление, уменьшают отек тканей. Работа входит в цикл работ посвященных исследованию коллоидных свойств полиамфолитов [1–8]
Декстраны — это гомополисахариды (эмпирическая формула (С6Н10О5)n), мономерами которых являются глюкопиранозные остатки. Этиглюкопиранозные остатки содержат два типа гидроксильных групп: глюкозидные и глюкозные. Разные типы функциональных групп определяют структуру гомополисахаридов, их физические и химические свойства, а также активность. Оба вида гидроксильных групп обладают амфотерными свойствами. [9]
В работах [1,10] приведены результаты изучения кислотно–основного баланса в системе декстран — водные растворы электролитов. Установлено, изоэлектрическая точка (рНИЭТ) декстрана в водных растворах хлоридов калия, бария, железа (II) изменяется в диапазоне от 4,75 до 4,35 рН.
Агрегативная устойчивость дисперсных систем в большей степени зависит от состава дисперсионной среды, соответственно, может нарушиться при добавлении даже малых количеств электролитов [11–18]. Важность данной работы состоит в том, что изучение коллоидных свойств дисперсной системы декстраны — водные растворы электролитов необходимо для создания наилучших условий при использовании их в качестве плазмы крови и природных сорбентов для очистки организма человека от вредных и токсичных веществ [19–25]. Подобные исследования в будущем позволят применять данные методы для исследования живых клеток [26–27] и в медицинский целях [28]. Подобные исследование позволят более детально подойти к разработке новых лекарственных формы в академии [29–32].
Целью данной работы является исследование влияния одно-, двух- и трехзарядных электролитов на устойчивость водных дисперсий декстране в зависимости от концентрации электролита и рН дисперсной системы.
Объект исследования: бисерно-полимерный гель декстрана (размер частиц 20–120 мкм, набухание составляет 12–15 мл/г сухого геля), очищенный и синтезированный на заводе химреактивов Ренал, Венгрия, Будапешт.
Коагулирующие электролиты: водные растворы NaNO3 (2,0 моль∙л-1), BaCl2 (0,1 моль∙л-1), AlCl3 (0,001 моль∙л-1), Na2SO4 (0,1 моль∙л-1), C6H5O7Na3 (0,005 моль∙л-1). Все используемые в работе неорганические реактивы соответствовали марке х. ч.
Изучение влияния электролитов на устойчивость водных дисперсий декстрана проводили фотометрическим методом [33]. Для этого готовили три 0,1 % дисперсии декстрана в буферных растворах с рН = 1,68; 4,01 и 6,86. Для получения системы с наилучшей агрегативной устойчивостью навеску декстрана помещали в ступку с небольшим количеством буферного раствора, растирали до состояния однородной мази, переносили количественно суспензию в мерный стакан, доводили раствором до нужного объёма и диспергировали ультразвуком в течение 5 минут. В две кюветы с толщиной слоя 1 см вводили по 5 мл полученной дисперсии. Кюветы помещали в фотоколориметр. В одну кювету вводили по каплям коагулирующий электролит. После каждой капли проводили измерения оптической плотности при λ = 315 нм. Раствором сравнения служила дисперсия без электролита. Пороги коагуляции рассчитали по формуле:
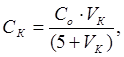
где СК — порог коагуляции, моль/л; Со — концентрация исходного раствора электролита, моль/л; VК — объём электролита, вызвавший коагуляцию 5 мл дисперсии декстрана.
Полученные результаты исследования коагуляции дисперсий декстрана приведены в таблице 1.
Таблица 1
Значения порога коагуляции для водных дисперсий декстрана растворами солей одно-, двух- и трёхзарядных ионов
|
Электролит с концентрацией, моль/л |
СК, моль/л |
|||||
|
Значения рН дисперсий декстрана |
||||||
|
рН = 1,68 |
СКn/СК3 |
рН = 4,01 |
СКn/СК3 |
рН = 6,86 |
СКn/СК3 |
|
|
NaNO3–2,0 |
0,039 |
234 |
Коагуляция произошла самопроизвольно |
0,032 |
1019 |
|
|
BaCl2–0,1 |
0,0076 |
54 |
0,002 |
51 |
||
|
AlCl3–0,001 |
0,00014 |
1 |
0,000039 |
1 |
||
|
NaNO3–2,0 |
0,039 |
86 |
- |
- |
||
|
Na2SO4–0,1 |
0,0125 |
27 |
- |
- |
||
|
C6H5O7Na3–0,005 |
0,00045 |
1 |
- |
- |
||
Анализ экспериментальных данных показывает, что дисперсия декстрана самопроизвольно коагулирует при рН = 4,01. На основе полученных результатов были построены графики зависимости десятичного логарифма порога коагуляции от десятичного логарифма заряда коагулирующего иона при разных значениях рН (рис.1 и 2).
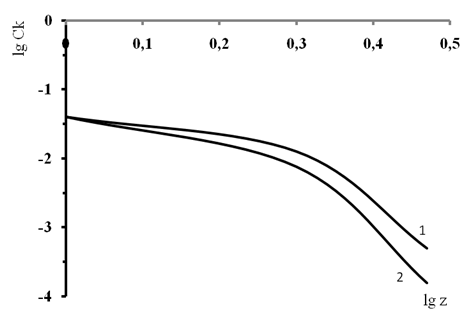
Рис. 1. Зависимость lgCКот lgz при рН = 1,68: 1 — коагулирующий ион с отрицательным зарядом (анион); 2 — коагулирующий ион с положительным зарядом (катион)
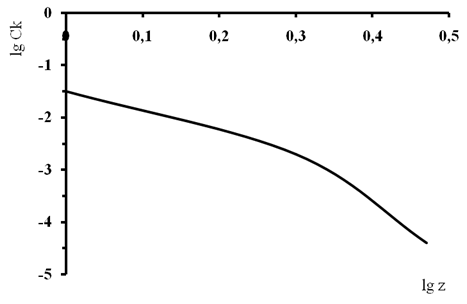
Рис. 2. Зависимость lgCК от lg z при рН =6,86
рН = 4,01 соответствует рНИЭТ декстрана [1] –это та область рН, в которой дисперсная система характеризуется наименьшей устойчивостью, так как в этом случае электростатические силы отталкивания между частицами декстрана практически отсутствуют. Этот результат подтверждает изучение зависимости электрокинетического потенциала ζ от рН дисперсионный среды методом микроэлектрофореза. Полученная зависимость отражена на рис.3.
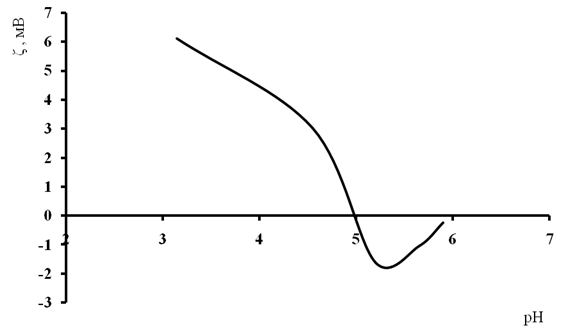
Рис. 3. Зависимость электрокинетического потенциала от рН дисперсной системы
В области рН >рНИЭТ поверхность декстрана имеет большой отрицательный заряд, дисперсия устойчива, коагуляция происходит под действием электролита. Коагуляция происходит под действием индифферентных электролитов. Коагулирующим ионами являются катионы (противоионы). При этом выполняется правило Шульце — Гарди [34]. Порог коагуляции уменьшается с увеличением заряда коагулирующих ионов в следующем соотношении 1016: 54: 1 = 1+: 2+: 3+. Соотношения полученных порогов коагуляции для катионов с разными зарядами очень близки к теоретическим (729: 64: 1 = 1+: 2+: 3+).
В области рН <рНИЭТ поверхность декстрана имеет высокий положительный заряд и дисперсия устойчива. Коагулирующим ионом являются анионы и порог коагуляции анионами выше, чем катионами. И в этом случае коагулирующая способность электролита возрастает с увеличением заряда иона коагулятора. Однако, соотношение порогов коагуляции для анионов с различной величиной заряда, значительно отличается от правила Шульце-Гарди (86: 27: 1 = 1+: 2+: 3+).
Таким образом, проведенные исследования показали, что коагуляция дисперсных систем биологической природы (с глобулярной структурой) происходит по классическим законам коагуляции, разработанных для золей малорастворимых неорганических соединений.
Литература:
1. Чухно А. С., Дмитриева И. Б., Мартынов Д. В.. Влияние солей одно-, двух- и трехзарядных катионов металлов на сорбцию Н+ и ОН- ионов на декстране. // Бутлеровские сообщения. 2011. Т.27. № 14. С. 47–54.
2. Родионова Е. Ю., Дмитриева И. Б., Чухно А. С. Электрокинетические свойства гемоглобина в водных растворах НСl и KCl. // Бутлеровские сообщения. 2012. Т.30. № 6. С.103–107.
3. Родионова Е. Ю., Дмитриева И. Б., Чухно А. С. Электрокинетические свойства гемоглобина в водных растворах 1-, 2- и 3-зарядных ионов. // Бутлеровские сообщения. 2013. Т.34. № 6. С.135–140.
4. Родионова Е. Ю., Дмитриева И. Б., Чухно А. С. Электрокинетические свойства хлорофилла в водных растворах 1-, 2- и 3-зарядных катионов. // Бутлеровские сообщения. 2013. Т.34. № 6. С.130–134.
5. Кергенцев А. А., Дмитриева И. Б., Чухно А. С. Определение точки нулевого заряда молекул альбумина в водных дисперсиях при различных концентрациях хлорида калия. // Молодой ученый. 2014. № 18. С. 123–126.
6. Чухно А.С., Дмитриева И.Б., Банкина А.Н., Бриллиантова Е.Ю. Изучение взаимодействия белков с биологически активными азотсодержащими гетероциклическими соединениями при различных значениях pH. // Бутлеровские сообщения. 2013. Т.34. № 5. С.91–99.
7. Чухно А. С., Банкина А. Н., Бриллиантова Е. Ю.. Кинетика процесса набухания желатины в водных растворах азолов. // Бутлеровские сообщения.- 2014. — Т.38. № 5. С.84–88.
8. Чухно А. С., Дмитриева И. Б., Силаева Д. С., Сенина А. С., Кошевенко А. С., Назипова А. Р. Сорбция ионов Н+ и ОН- на хлорофилле, влияние рН на устойчивость водных дисперсий хлорофилла. Бутлеровские сообщения. 2013. Т.34. № 5. С.124–130.
9. Biochemistry of Carbohydrate, v. 16, Balt., 1978, p. 75–126.
10. Чухно А. С., Дмитриева И. Б., Воронкова Н. В. Адсорбция ионов Н+ и ОН- на декстране. // Материалы международной научной конференции «КОЛЛОИДЫ И ПОВЕРХНОСТИ», 14–15 мая 2010 года, Вестник КазНУ, серия химическая, № 3(59), Алма-Ата, 2010. — С. 33–36.
11. Men'shikova A.Yu., Skurkis Yu.O., Kuchuk V. I., Dmitrieva I. B., Evseeva T. G., Shabsel's B. M. Effect of the surface structure of poly(styrene-co-acrolein) microspheres and its modification by protein on electrosurface properties. // Коллоидный журнал. 2001. Т. 63. № 5. С. 629–636.
12. Широкова И. Ю., Кучук В. И., Беляев А. П., Шевченко Н. Н., Голикова Е. В. Агрегативная устойчивость дисперсных систем. Часть 1. Исследование электроповерхностных свойств и кинетики коагуляции монодисперсных полимерных частиц с карбоксилированной поверхностью. // Бутлеровские сообщения. 2014. Т.37. № 2. С.29–38.
13. Кучук В. И., Широкова И. Ю., Голикова Е. В. Физико-химические свойства водно-спиртовых смесей гомологического ряда низших алифатических спиртов. //
14. Физика и химия стекла. 2012. Т. 38. № 5. С. 625–633.
15. Родионова Е. Ю., Дмитриева И. Б., Чухно А. С. Влияние состава дисперсионной среды на устойчивость и электрокинетические свойства билирубина. // Бутлеровские сообщения. 2014. Т.37. № 1. С.55–61.
16. Голикова Е. В., Григорьев В. С., Кучук В. И., Мащенко Т. С., Ефименко Л. П., Дьячкова А. Т. Агрегативная устойчивость водных золей ZrO2 в растворах электролитов. // Физика и химия стекла. 2008. Т. 34. № 5. С. 759–784.
17. Загорская Л. Л., Голикова Е. В., Гарибин Е. А., Молодкина Л. М., Кучук В. И. Ближняя и дальняя АГ регация частиц в золе G-AL2O3. I. Исследование агрегативной устойчивости отрицательно за ряженного золя G-AL2O3.// Физика и химия стекла. 2010. Т. 36. № 4. С. 542.
18. Голикова Е. В., Кучук В. И., Григорьев В. С., Шарыпин В. В. Устойчивость и коагуляция золя природного алмаза в растворах LID.// Физика и химия стекла. 2011. Т. 37. № 4. С. 518–538.
19. Evstratova K. I., Bakholdina L. A., Kuchuk V. I., Ivanovskaya T.Yu. Adsorption activity of polyphepan with respect to some heavy metal cations.// Pharmaceutical Chemistry Journal. 1999. Т. 33. № 8. С. 437–440
20. Чухно А. С., Дмитриева И. Б., Аксинович В. А., Силаева Д. С., Сенина А. С., Кергенцев А. А.. Электроповерхностные свойства оксида кремния(IV) в водных растворах азолов // Бутлеровские сообщения.- 2014. — Т.38. № 5. С.78–83.
21. Дмитриева И. Б., Тихомолова К. П., Чухно А. С.. Особенности адсорбции 1,3 — диазола на поверхности оксидов NiО и Fe2О3. // Журн. прикл. химии. 2005. т. 78. Вып. 5. С. 741–746.
22. Дмитриева И. Б., Тихомолова К. П., Чухно А. С.. Адсорбция тетразола на оксидах Ni(II) и Fe(III). // Журн. прикл. химии. 2006. Т. 79. Вып. 1. С. 51–56.
23. Гришина А. В., Беляев А. П., Гришин В. В. Исследование окислительных и адсорбционных свойств двуокиси марганца по отношению к протонам и гидроксилам к и сульфаниламидам. // Молодой ученый. 2014. № 18. С. 121–123.
24. Dmitrieva I. B., Chukhno A. S., Rodionova E. Y.,. Novichkov R. V. Specific Adsorption of Aspartic Acid on Iron (III) and Nickel (II) Oxides.// Eurasian Chemico-Technological Journal. 2012. Т. 14. № 4. С. 299–304.
25. Дмитриева И.Б., Чухно А.С., Новичков Р. В.. Взаимодействие глицина с катионами железа(III) и никеля(II) в водных растворах и на поверхности их оксидов. // Бутлеровские сообщения. 2013. Т.35. № 8. С.133–137.
26. Шкляева А. С., Васильева О. В., Кучук В. И. Исследование физико-химических свойств водной дисперсии энтеросорбента полисорба мп. Бутлеровские сообщения. 2013. Т.35. № 8. С.94–99.
27. Бриллиантова Е. Ю., Чухно А. С., Ананьева Е. П., Гурина С. В., Банкина А. Н. Исследование адсорбционных свойств мицелия базидиомицета Poliporus ciliatus. // Молодой ученый. 2014. № 18. С. 116–120.
28. Банкина А.Н., Чухно А. С., Гурина С. В., Ананьева Е. П., Бриллиантова Е. Ю. Исследование адсорбционных свойств мицелия базидиомицета Abortiporus biennis. // Молодой ученый. — 2014. — № 19. — С. 56–60.
29. Бобров А. П., Маслов В. В., Ткаченко Т. Б., Воронина Д. В., Гришин В. В., Тефц С. Н. Сравнительная оценка действия поверхностно-активных веществ на изменение кинетических параметров агрегации тромбоцитов.// Институт стоматологии. 2010. Т. 3. № 48. С. 80–81.
30. Беляев А. П., Рубец В. П., Антипов В. В., Бордей Н. С., Зарембо В. И. Фазовый переход пар — кристалл при синтезе пленок парацетамола методом вакуумного испарения и конденсации. // Журнал технической физики.. 2014. Т.84. № 3. С.141–143.
31. Беляев А. П., Рубец В. П., Антипов В. В., Рыбников А. О., Беляева С. А. Кристаллизация парацетамола ромбической формы. // Бутлеровские сообщения. 2014. Т.37. № 3. С.113–119.
32. Беляев А. П., Рубец В. П., Антипов В. В., Бордей Н. С. Фазовые превращения при формировании кристаллов парацетамола из паровой фазы. // Журнал технической физики. 2014. Т. 84. № 7. С. 156–158.
33. Беляев А. П., Рубец В. П., Антипов В. В., Бордей Н. С. О механизме начальной стадии образования наноструктур в условиях сверхнизких температур.// Наносистемы: физика, химия, математика. 2012. Т. 3. № 5. С. 103–110.
34. Беляев А. П., Скворцов А. М., Кучук В. И., Дмитриева И. Б., Бахолдина Л. А., Чухно А. С., Гришин В. В., Купина Н. А., Малахова Е. Е.. Физическая и коллоидная химия. Руководство к практическим занятиям: учебное пособие. / Под ред. проф. А. П. Беляева. — М.: ГЭОТАР-Медиа, 2012. — 320 с.
35. Беляев А. П. Физическая и коллоидная химия / Беляев А. П., Кучук В. И. / под.ред. А. П. Беляева. — 2-ое изд., перераб. и доп. — М., 2012.-752с.







