Одновременно в организме человека происходят миллионы различных химических взаимодействий. Какие-то химические реакции должны были бы длиться очень долго, а многие из них вообще не должны происходить. Протекают реакции благодаря участию в обмене веществ ферментов. Одним из них в организме человека является лактатдегидрогеназа.
Цель работы: обобщить сведения о функции ЛДГ и методах определения её активности.
Основная задача: подготовка к поиску новых ингибиторов ЛДГ.
Лактатдегидрогеназа (ЛДГ) — это фермент, катализирующий реакцию образования пировиноградной кислоты из молочной кислоты, а также обратную реакцию.
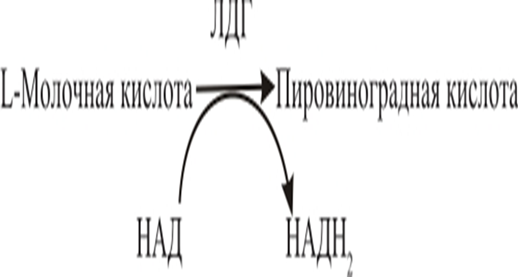
Рис. 1. Образование пировиноградной кислоты из молочной кислоты
Молекула ЛДГ представляет собой тетрамер, который состоит из 1 или 2 типов субъединиц, которые обозначаются как М(англ. Muscle) и Н(англ. Heart). Субъединицы различаются между собой по аминокислотному составу, иммунохимическим свойствам.
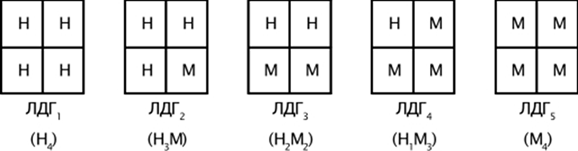
Рис. 2. Схема строения изоферментов ЛДГ
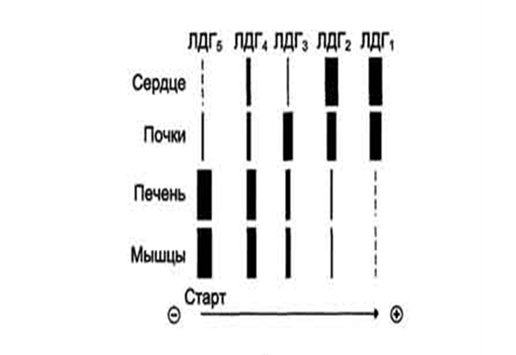
Рис. 3. Органоспецифичность ЛДГ
Наиболее точным, специфичным и быстрым методом определения активности ЛДГ является кинетический спектрофотометрический метод, который базируется на оптическом тесте Варбурга. Принцип метода основан на отличии спектров поглощения восстановленной (НАДН) и окисленной (НАД) форм никотинамидадениндинуклеотида. При 340 нм НАДН имеет максимальное поглощение, тогда как НАД не имеет поглощения при данной длине волны. Таким образом, при превращении НАДН в НАД происходит уменьшение оптической плотности реакционной смеси при 340 нм. [1]
Использование ЛДГ в клинической диагностике
Во время острого инфаркта миокарда сердечная мышца выделяет в кровь большое количество ферментов. Скорость выброса различных специфических ферментов неодинакова. Изменение во времени их уровня в крови имеет большую диагностическую ценность.
Увеличение активности ЛДГ можно наблюдать при заболеваниях печени, но степень ее повышения не столь высока по сравнению с аминотрансферазами.
Умеренное увеличение активности ЛДГ обнаружено в сыворотке крови пациентов с прогрессирующей мышечной дистрофией, особенно на ранних стадиях заболевания. Наблюдаемое увеличение обычно связано с изоферментом ЛДГ5, преобладающим в скелетной мышце.
Подготовка к поиску новых ингибиторов ЛДГ
Распад каждой молекулы глюкозы до пировиноградной кислоты требует восстановления двух молекул НАД до НАДН. Однако запас НАД в клетке ограничен, поэтому распад глюкозы в конечном итоге прекращается. Катаболизм глюкозы может продолжаться лишь при соответствующем окислении НАДН. Такая регенерация НАД возможна в результате лактатдегидрогеназной реакции — ферментативного превращения пировиноградной кислоты в молочную. На каждую образующуюся молекулу молочной кислоты приходится одна молекула НАД, что обеспечивает превращение еще одной половины молекулы глюкозы. Путь от глюкозы до молочной кислоты называют лактатным гликолизом; таким образом, в энергию без участия кислорода может быть превращено столько глюкозы, сколько потребуется. Еще в 1923 г. Варбург, анализируя поглощение кислорода и образование молочной кислоты в срезах солидных опухолей, обнаружил, что они поглощают меньше кислорода и образуют больше молочной кислоты, чем срезы нормальной ткани. В нормальной клетке активность ЛДГ стабильна в двух направлениях. В случае нарушений в дыхательной цепи (эффект Варбурга) равновесие смещается вправо. [2]
В результате нормальная клетка идёт по пути развития раковой. 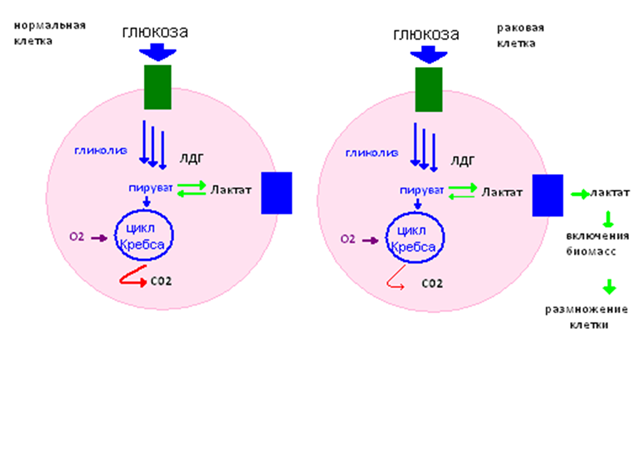 Рис. 4. Схема протекания процессов в нормальной и раковой клетках
Рис. 4. Схема протекания процессов в нормальной и раковой клетках
В настоящее время уже существуют ингибиторы ЛДГ, которые позволяют путь развития раковой клетки делать менее вероятным. Однако, основная задача в дальнейшей работе, проанализировав строение ЛДГ и механизмы связывания фермента с веществами, создать новые ингибиторы, которые могут быть более доступными.
Литература:
1. https://ru.wikipedia.org/wiki/Лактатдегидрогеназа
2. http://lekmed.ru/info/arhivy/rak-eksperimenty-i-gipotezy-38.html







