Автором статьи доказывается необходимость расчета тепловых эффектов реакции между вольфраматом железа, нитратом натрия и карбонатом натрия, для выявления возможности проведения высокотемпературного синтеза (СВС) и определение оптимальных соотношений реагентов, с точки зрения развития современной науки. Основное внимание в работе автор акцентирует на то, что концентрационные пределы, при которых ожидается самораспространяющийся высокотемпературный синтез (СВС), характеризуются весовыми соотношениями FеWO4:NaNO3:Na2CO3,как 17,87: 1:(0÷5,61) для реакций с выделением молекулярного азота; а для реакций с выделением монооксида азота FеWO4:NaNO3:Na2CO3соответственно10,87:1:(0÷3,12).
Ключевые слова:химическая реакция, нитрат натрия и карбонат натрия, реагент, вольфрамат железа, окислителели, высокотемпературный синтез.
Так как соотношение окислителя к восстановителю менять нельзя, то так же, как и в предыдущем случае, можно уменьшать количество карбоната натрия с получением в качестве дополнительного продукта вольфрамового ангидрида. При полном отсутствии карбоната натрия возможна реакция:
6FеWO4 + 2NaNO3 = 3Fe2O3 + 5WO3+ Na2WO4 +2NО (9).
В общем виде при варьировании количества карбоната натрия можно расписать серию реакций, общий вид которых будет таким:
6FеWO4 + 2NaNO3 + nNa2CO3 = 3Fe2O3 + (5-n) WO3 +(n+1)Na2WO4 + 2NО + nCO2 (10).
Рассчитаем значения стандартных энтальпий данных серий реакций (7) и (10) при различных значениях n (табл.1).
Таблица 1
|
n |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
ΔНО (7) реакции кдж |
-756,6 |
-725,2 |
-693,5 |
-661,8 |
-630,1 |
-598,4 |
-567,1 |
-534,6 |
-503,3 |
-471,6 |
|
ΔНО(10) реакции кдж |
-181,2 |
-149,5 |
-117,8 |
-85,7 |
-54,4 |
-22,7 |
- |
- |
- |
- |
Из таблицы видно, что уменьшение количества карбоната натрия в реакционной смеси приводит к увеличению термоэффекта. Представим в виде графиков изменение теплового эффекта реакций от мольного содержания карбоната натрия (рис. 1).
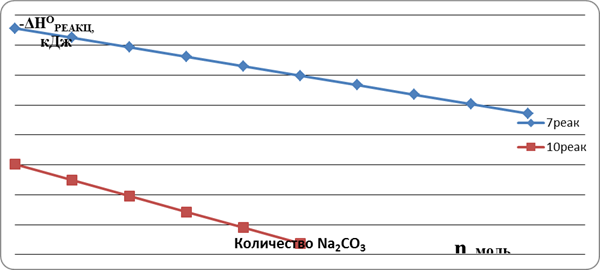
Рис.1. Изменение энтальпии реакций (7) и (10) в зависимости от количества карбоната натрия (n), в расчете на один моль вольфрамата железа
Графики имеют линейный характер и могут быть представлены в виде функций ΔНО=kn+b, где k = 3,1688 и b = — 75,682, для реакции (7), а k = 5,2852 и b = — 30,194 для реакции(10).
По сравнению с реакциями (7), тепловыделение в реакциях (10) на один моль вольфрамата железа в 2,5–12,5 раза меньше (сравнение дается для максимальных и минимальных содержаний карбоната натрия). Для проведения самораспространяющегося синтеза в нашем случае очень важно чтобы началось плавление самой низкоплавкой фазы. При этом будет достигнут оптимальный контакт с тугоплавкими компонентами. Даже без учета теплоемкости всех компонентов можно увидеть, что реакция n = 5 (10) и, возможно, n = 6 (10) без предварительного подогрева реакционной смеси не пойдёт. Самый низкоплавкий компонент NaNO3 имеет температуру плавления 308О С и мольную теплоту плавления 16 кдж. В реакции используется два моля NaNO3, следовательно, на плавление потребуется 32 кдж. В реакции n = 5 (10) тепловыделение составляет 22,7 кдж. Поэтому предварительно необходимо подогреть реакционную шихту минимум до 278–304О С, то есть до плавления эвтектик, которые существуют в системе карбонат натрия — нитрат натрия [4].
В результате проведенных расчетов можно определить концентрационные пределы для всех компонентов, при которых возможно протекание реакций с экзотермическим эффектом. Для реакций (7) весовые соотношения компонентов FеWO4: NaNO3:Na2CO3 находятся в пределах 17,87:1:(0÷5,61), а для реакций (10) в пределах 10,87:1:(0÷3,12) соответственно. Для более точной оценки возможности протекания СВС синтеза проведем оценку удельной теплоемкости компонентов реакций, и на этой основе определим конечные температуры реакционных смесей. Приведем стандартные удельные теплоемкости для исходных и конечных продуктов (табл.3) [2,3].
Таблица 2
|
|
FеWO4 |
Na2CO3 |
NaNO3 |
Fe2O3 |
Na2WO4 |
NaNO2 |
WO3 |
NO |
CO2 |
N2 |
|
СрО Дж/м К |
114,9 |
112,2 |
93 |
103,8 |
139,95 |
93,19 |
73,85 |
29,9 |
37,11 |
29,1 |
Приведем также данные расчетов по суммарной удельной теплоемкости реакционной смеси по продуктам реакции для серии реакций (7) и (10, а также подъем температуры ожидаемый в зоне реакции (табл.4).
Таблица 3
|
n |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
СрОΣпродуктов реакции(7) кдж·К-1 |
1,35 |
1,46 |
1,56 |
1,62 |
1,77 |
1,87 |
1,97 |
2,08 |
2,18 |
2,28 |
|
ΔТ реакции(7) ОС |
563 |
500 |
445 |
402 |
355 |
318 |
285 |
255 |
228 |
204 |
|
СрОΣпродуктов реакции(10) кдж·К-1 |
0,74 |
0,98 |
1,09 |
1,19 |
1,29 |
1,40 |
- |
- |
- |
- |
|
ΔТ реакции(10) ОС |
245 |
152 |
108 |
72 |
42 |
16 |
- |
- |
- |
- |
Для серии реакций (10) подъем температуры, ожидаемый в зоне реакции, недостаточен для плавления нитрата натрия. Проведение этих реакций возможно только при предварительном прогреве исходной реакционной шихты. Результаты расчетов подъема температуры для реакций (7) и (10) в зависимости от мольной добавки карбоната натрия представлены в виде графиков на рис 2.
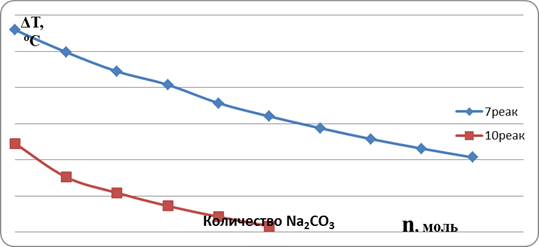
Рис. 2. Зависимость расчетного изменения температуры реакционной смеси от мольного количества карбоната натрия в результате проведения экзотермических реакций (7) и (10).
Анализ изменения температуры в реакциях (7) и (10) показал, что форма зависимости ΔТ от мольного содержания карбоната натрия соответствует формуле ΔТ = (k1n+b) / (k2n-c) для расчетов, проведенных по теплоемкостям и энтальпиям образования исходных компонентов смеси и продуктов реакции.
Выводы:
1. Для реакций, в результате которых, получается монооксид азота необходим предварительный нагрев реакционной смеси до температуры не менее 300О С.
2. Концентрационные пределы, при которых ожидается самораспространяющийся высокотемпературный синтез (СВС), характеризуются весовыми соотношениями FеWO4:NaNO3:Na2CO3,как 17,87: 1:(0÷5,61) для реакций с выделением молекулярного азота; а для реакций с выделением монооксида азота FеWO4: NaNO3:Na2CO3 соответственно10,87:1:(0÷3,12).
Литература:
1. Гутарева Н. Ю., Виноградов Н. В. Thermal effects in the oxidation of iron in the Tungstate treatment with sodium nitrate in the presence of sodium carbonate — труды конференции материалы международного симпозиума LFPM-32014. г. Ростов-на-Дону — г. Туапсе, 2–6 сентября 2014 год Выпуск 3, Том 1–386 с. — С. 147–151.
2. Гутарева Н. Ю., Сыродой С. В., Соломатов В. В. Concentration organic components in the hydrocarbon fuel particles conditions and characteristic of ignition. EPJ Web of Conferences 76, 01018 (2014). — 01018 — p.6.
3. Гутарева Н. Ю., Сыродой С. В., Соломатов В. В. Modelling of heat and mass transfer to solve the problem of particle ignition water-coal fuel. EPJ Web of Conferences 76, 01018 (2014). — 01018 — p.6. IOP Conf. Series: Materials Science and Engineering 66 (2014) 012040
4. Гутарева Н. Ю., Сыродой С. В., Соломатов В. В. Effect of structural heterogeneity water-coal fuel conditions and characteristics of ignition. EPJ Web of Conferences Volume82, 2015. — 01037 — p.5. IOP Conf. Series: Thermophysical Basis of Energy Technologies 66 (2014) 012040
5. Химия и технология редких и рассеянных элементов. Часть 3. Под ред. К. А. Большакова. — М.: Высшая школа, 1978. — 320 с.
6. Краткий химический справочник. Рабинович В. А., Хавин З. Я. Под ред. А. А. Потехина и А. И. Ефимова. — Л.: Химия, 1991. — 432 с.
7. Термические константы веществ. Выпуск 7, Часть 1. Под ред. В. П. Глушко. М.: Высшая школа, 1978. — 342 с.
8. Справочник по плавкости систем из безводных неорганических солей. Том 1, Двойные системы. Под ред. Н. К. Воскресенской. — АН СССР. М.: Химия, 1961. — 132 с.







