Ключевые слова: биотестирование, Paramecium caudatum, гальванотаксис.
Введение
Человечество с каждым годом создает все больше новых веществ, которые должны проходить проверку на безопасность как для человека, так и для окружающей среды. Для этого используется множество химических методов, математическое моделирование, помогающее предсказать свойства синтезированного соединения, и биотестирование.
Биотестирование представляет собой процесс установления токсичности среды с помощью тест-объектов — живых организмов. Оно позволяет оценивать интегральную токсичность различных веществ.
Главным элементом биотестирования является тест-система — пространственно ограниченная совокупность биологических элементов (объектов биотестирования) и среды, в которой они находятся. В результате воздействия на неё факторов среды система проявляет тест-реакции. Тест-реакция — это одна из возникающих ответных реакций тест-системы, выбранная для анализа состояния этой тест-системы. Определение степени проявления тест-реакции производится при помощи тест-критерия, после чего дается оценка исследуемому образцу.
В данной работе в качестве объекта биотестирования были выбраны пресноводные инфузории Paramecium caudatum. Эти простейшие довольно часто используются биологами для оценки токсичности сред, так как у них есть ряд преимуществ перед другими организмами. Во-первых, у них высокая чувствительность к находящимся в среде токсинам. Во-вторых, размеры клеток (примерно 200 микрометров) удобны для наблюдения, их можно увидеть невооруженным глазом. также размер позволяет проводить один тест с использованием множества особей, что дает большую статистическую достоверность. В-третьих, простота культивирования и короткое время удвоения биомассы. В-четвертых, этичность проведения опытов, т. к. инфузории не обладают нервной системой и не испытывают страдания, как подопытные млекопитающие.
Реакции на токсины у инфузорий выражаются в виде таксисов. Таксисом (taxis греч. — расположение, конфигурация) называется изменение поведения (то есть характера движения) простейших под влиянием факторов внешней среды. Различают фототаксис (реакции на свет), хемотаксис (на химические раздражители), геотаксис (движение под действием силы тяжести), термотаксис (под действием температуры) и гальванотаксис (движение в электрическом поле). Работа посвящена гальванотаксису у Paramecium caudatum, поэтому рассмотрим это явление немного подробнее.
Механизм гальванотаксиса обусловлен тем, что мембрана клетки инфузории при пропускании через среду электрического тока имеет небольшой электрический заряд (это связано с молекулярной структурой оболочек клетки). Таким образом, на мембране клетки индуцируется положительный заряд на передней части (ориентируется к катоду), и отрицательный — на заднем конце клетки (ориентируется к аноду). Парамеции представляют собой ориентирующиеся в среде диполи и, сохраняя свою подвижность, меняют направление — движутся в сторону отрицательно заряженного катода [5].
Мембранный потенциал меняется при помощи Ca2+-канала [4]. Ca2+, который поступает в цитозоль клетки, может регулировать различные процессы, например, контролировать движения ресничек.
Материалы
Работа проводилась с культурой инфузорий Paramecium caudatum, клон 94А Б6–18, предоставленной Санкт-Петербургским государственным электротехническим универсистетом.
Инфузорий культивировали на сенном отваре. Питательную среду разливали в конические колбы объемом 250 мл и настаивали сутки для развития сенной палочки, которая является кормовой культурой для инфузорий. Затем колбы засевались 5 мл культуры Paramecium caudatum с концентрацией около 1000 клеток/мл. Колбы закрывали ватно-марлевыми пробками и содержали при комнатной температуре. Для отмывания и концентрирования инфузорий использовали традиционный метод отмывания (в пикнометрах).
В качестве ингибиторов гальванотаксиса были использованы этилендиаминтетрауксусная кислота (ЭДТА), диметил-сульфоксид (ДМСО), соли Ni(CH3COO)2, Al2(SO4)3.
Эксперимент
Для проведения эксперимента была взята горизонтальная кювета, выполненная из оргстекла; высота 10 мм, ширина 10 мм, длина 100 мм. Она заполнялась раствором определенного ингибитора примерно на 0,5 сантиметра, затем туда добавлялось около 200 мкл отмытой от сенного настоя культуры инфузорий. Графитовые электроды, расположенные по краям кюветы, отделены от среды мембраной из фильтровальной бумаги (рисунки 1, 2).
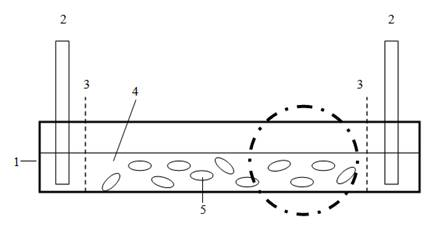

Рис. 1. Схема и фотография системы до включения тока: 1- кювета; 2- электрод; 3- мембрана из фильтровальной бумаги; 4- среда; 5- инфузории (в круге обозначена зона видимости микроскопа).
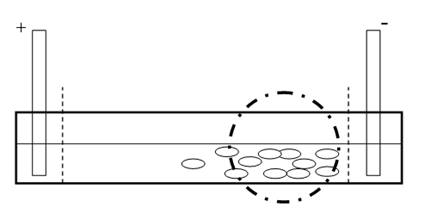

Рис. 2. Схема и фотография системы при включении тока
К электродам подавался электрический ток с напряжением 5 В в течение 30 секунд; за это время клетки двигались по направлению к катоду. Такое напряжение выбрано потому, что при больших значениях клетки начинают погибать, а при меньших гальванотаксис протекает медленно. По истечении времени с помощью программы Celltrk было подсчитано количество клеток в прикатодной области. Затем меняли полярность электродов и через 30 секунд пропускания тока снова считали количество клеток. Всего эксперимент проводился 5 раз с каждым веществом. Также был проведен контроль в 15 %-м растворе минеральной среды Лозина-Лозинского [1].
Результаты
Ниже представлены графики (рисунки 3–6) зависимости количества клеток инфузорий в прикатодной области от концентрации ингибитора в растворе (мкмоль/л; массовые доли для ДМСО). Пунктирной линией обозначена линия контроля. Также показаны граница разброса при подсчете клеток.
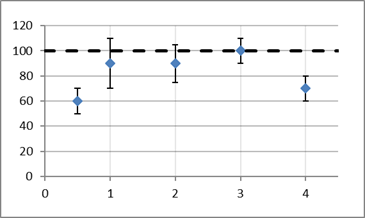
Рис. 3. График для ДМСО
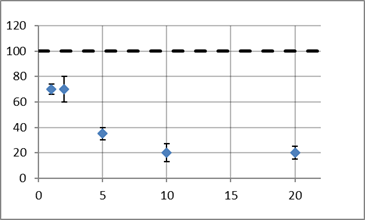
Рис. 4. График для ЭДTA
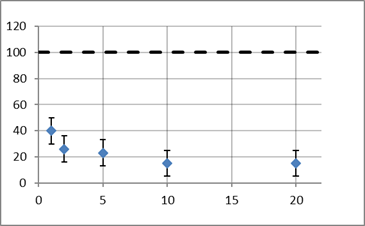
Рис. 5. График для Ba2+
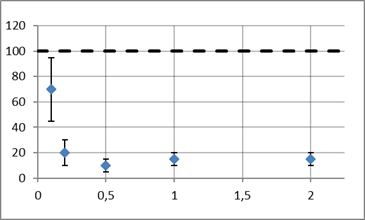
Рис. 6. График для Ni2+
Концентрации не гибельны для клеток, т. к. они значительно меньше значений ПДК, но гальванотаксис проявляется в меньшей степени. Это обусловлено тем, что выбранные токсины перекрывают кальциевые каналы в мембране ресничек.
Из графиков видно, что наименьшее воздействие оказывает ДМСО — результаты на уровне контроля. Сильнее всего повлияли неорганические токстиканты Ba2+ и Ni2+ — при концентрациях 10 и 0,5 мкмоль/л соответственно гальванотаксис уменьшается на 80 % по сравнению с контролем.
Таким образом, на основе полученных результатов можно проверить чувствительность инфузорий к токсинам для дальнейшей работы на приборе автоматизированной оценки токсичности [2], который позволяет проводить экспресс анализ интегральной токсичности различной токсичности различных объектов окружающей среды.
Литература:
1. Виноходов Д. О. Научные основы биотестирования с использованием инфузорий. Диссертация на соискание ученой степени доктора биологических наук, Санкт-Петербург, 2001.
2. Попов А. В., Виноходов Д. О., Рутто М. В. Практическое использование реакции гальванотаксиса простейших в токсикологических исследованиях для автоматизации оценки острой токсичности сред. Экологическая химия, 2013, 22(4); 203–214.
3. Хаусман К., Протозоология, Москва: Мир., 1988., 336 с.
4. Aonuma M., Kadono T., Kawano T. Inhibition of anodic galvanotaxis of green Paramecia by T-type Calcium channel inhibitors. Z. Naturforsch, 2007, pp. 93–102.
5. Ogawa N., Oku H., Hashimoto K., Ishikawa M. A physical model for galvanotaxis of Parameciem cell, J.Theoretical Biology, 2006, Sep. 21 242, pp. 314–328.







