Исследован способ деструктивного окисления фенола до углекислого газа и воды в мягких условиях. Определено влияние каталитических добавок серебра на степень превращения фенола в процессах жидкофазного окисления и непрямого электроокисления под действием окислителей, образующихся электрохимически in situ в сернокислотных растворах фенола. Степень деструкции фенола в присутствии серебра, при продолжительности процесса 40 мин, составляет 58–81 %. Наиболее эффективно глубокое окисление идет в присутствии AgNO3 с концентрацией 0,6·10–7 моль/дм3.
Ключевые слова: окисление фенола, катализаторы окисления, окислительная система, жидкофазное окисление, непрямое электроокисление, химическое потребление кислорода, инверсионная вольтамперометрия.
Процессы жидкофазного окисления фенолов изучены достаточно широко. Поэтому в качестве окислителей, в зависимости от того какой продукт окисления фенола следует получить, предлагается использовать целый ряд соединений как органической, так и неорганической природы. Однако в процессах деструктивного окисления C6H5OH в жидкой фазе наиболее популярными являются [1]: персульфаты, пероксиды, кислород и озон. Данные окислители могут быть введены в жидкофазную систему извне или получены непосредственно в реакционном объеме in situ. Одним из вариантов генерирования окислителей in situ является процесс электролиза, при котором синтез окислительной системы, жидкофазное и электрохимическое окисление органического субстрата протекают одновременно [2]. Интенсифицировать процесс окисления возможно за счет добавления различных каталитических систем.
Цель данной работы заключалась в исследовании влияния каталитических добавок на скорость глубокого окисления фенола под действием окислительной системы, генерируемой при пропускании электрического тока через водные растворы серной кислоты.
Деструктивное окисление фенола (с исходной концентрацией 0,017 моль/л) до нетоксичных компонентов проводили в бездиафрагменном электролизере (объемом 70 дм3) со свинцовыми электродами (с рабочей площадью 10 см2) и мешалкой в 40 %-ных растворах серной кислоты, при плотности тока 0,5 А/см2, температуре 20 °С и атмосферном давлении. В качестве каталитической добавки использовали серебро и его соли в количестве 10–7–10–4 моль/дм3. Эффективность окисления фенола в лабораторных условиях оценивали, определяя показатель ХПК (химическое потребление кислорода) на микропроцессорном анализаторе Экотест-120. Содержание серебра определяли методом инверсионной вольтамперометрии на анализаторе ТА-4.
Предварительные эксперименты показали, что деструктивное окисление фенола в растворах серной кислоты (без наложения электрического тока) в присутствии AgNO3 протекает в два раза быстрее. Окисление фенола в условиях данного эксперимента протекает по схеме, представленной на рисунке 1, которая согласуется с некоторыми литературными данными [3].
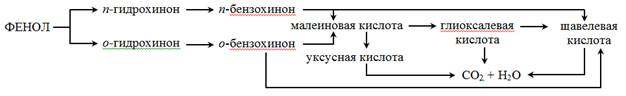
Рис. 1. Схема глубокого окисления фенола
Суммарное содержание органического углерода без каталитической добавки снижается в течение 10 суток всего на 28 % (табл. 1), что на 50 % меньше, в сравнении с окислением, которое катализируется серебром. Следовательно, получаемые в результате диссоциации соли AgNO3 ионы Ag+ производят каталитический эффект, что делает возможным использование серебра для интенсификации процесса жидкофазного окисления фенола. Однако здесь виден главный недостаток — это большая продолжительность процесса. Сократить время окисления возможно за счет использования постоянного электрического тока.
Таблица 1
Изменение ХПК (мгО2/дм3) растворов фенола при окислении в 40 % H2SO4
|
τ, мин |
СAgNO3 (0,0034 моль/дм3) |
τ, мин |
СAgNO3 (0,00 моль/дм3) |
|
0 |
432,2 |
0 |
432,2 |
|
1440 |
419,8 |
480 |
242,3 |
|
4320 |
410,55 |
9120 |
108,5 |
|
7200 |
403,7 |
20632 |
92,6 |
|
11520 |
364,25 |
33592 |
86,4 |
|
14400 |
310,6 |
37912 |
51,0 |
|
kI, мин-1 |
(2,035×±0,3857)×10–5 |
kI, мин-1 |
(4,213×±1,076)×10–5 |
Исследования показали, что при наложении электрического тока окисление фенола протекает на несколько порядков быстрее, но добавление Ag+ в концентрациях 10–6–10–4 моль/дм3 оказывает тормозящее действие (табл. 2).
Таблица 2
Изменение ХПК (мгО2/дм3) растворов фенола при непрямом электроокислении
|
τ, мин |
СAgNO3, моль/дм3 |
||||||
|
0 |
0,6·10–7 |
10–6 |
10–5 |
17·10–4 |
34·10–4 |
50·10–4 |
|
|
0 |
432,2 |
432,2 |
432,2 |
432,2 |
432,2 |
432,2 |
432,2 |
|
10 |
257,85 |
246,43 |
311,1 |
381,7 |
391,78 |
294,76 |
382,1 |
|
20 |
183,4 |
163,13 |
264,1 |
283,3 |
339,22 |
266,39 |
336,9 |
|
30 |
148,7 |
114,73 |
206,2 |
252,6 |
269,21 |
224,17 |
278,45 |
|
40 |
89,05 |
66,77 |
182,1 |
214,1 |
240,28 |
182,11 |
230,95 |
|
α, % |
79 |
85 |
58 |
50 |
44 |
58 |
47 |
Это происходит вследствие того, что протекают электрохимические процессы восстановления ионов серебра на свинцовом катоде по реакции: Ag+ + ē = Ag°. Причем, чем больше начальная концентрация Ag+ в растворе, тем большее его количество осаждается на поверхности свинцового катода — невооруженным глазом были видны на свинцовом катоде игольчатые вкрапления серебристого цвета (табл. 3).
Таблица 3
Содержание Ag+ до и после проведения непрямого электроокисления фенола
|
СAgNO3, моль/дм3 |
τ, мин |
СAg+, мг/дм3 |
||||
|
С1 |
С2 |
С3 |
Ссредн |
Стеор. |
||
|
0,0017 |
0 |
108 |
97 |
– |
102,5 |
182 |
|
40 |
89,1 |
74 |
95,3 |
86,3 |
- |
|
|
0,0034 |
0 |
– |
469 |
294 |
381,5 |
364 |
|
40 |
102 |
198 |
122 |
140,7 |
- |
|
|
0,0050 |
0 |
390 |
– |
260 |
325 |
535 |
|
40 |
176 |
225 |
– |
253 |
- |
|
Максимально эффективно фенол деструктирует при концентрации серебра 0,6·10–7 моль/дм3, при этом степень превращения (α) по органическому углероду увеличивается на 6 % в сравнении с безкаталитическим процессом.
Так как предыдущие эксперименты показали, что ион формы Ag+ восстанавливается, то возникла необходимость исследовать возможность внесения серебра другими способами. В качестве источников серебра были выбраны:
– свинцовый катод, покрытый слоем электрохимически нанесенного Ag+ (1);
– свинцовый катод, выдержанный в насыщенном растворе AgNO3 (2);
– металлическое серебро в качестве катода (3);
– раствор серной кислоты с содержанием AgNO3 0,0034 моль/дм3 (4).
– металлическое серебро в качестве анода (5);
– свинцовый анод, выдержанный в насыщенном растворе AgNO3 (6);
Из приведенных в таблице значений мы видим, что при использовании серебряной соли AgNO3 (4), с концентрацией 0,0034 моль/дм3 наблюдается наименьшее значение степени превращения равное 58 %. Это происходит вследствие того, что здесь основным процессом является процесс восстановления серебра на катоде.
Таблица 4
Изменение ХПК (мгО2/дм3) растворов фенола при непрямом электроокислении
|
τ, мин |
Обозначение способа внесения серебра |
|||||
|
1 |
2 |
3 |
4 |
5 |
6 |
|
|
0 |
432,2 |
432,2 |
432,2 |
432,2 |
432,2 |
432,2 |
|
10 |
347,8 |
403,7 |
293,1 |
294,76 |
268,6 |
358,83 |
|
20 |
266,9 |
301,7 |
286,3 |
266,39 |
188,9 |
265,73 |
|
30 |
220,5 |
221,3 |
193,9 |
224,17 |
157,3 |
187,93 |
|
40 |
181,2 |
166,9 |
163,2 |
182,11 |
81,9 |
119,13 |
|
α, % |
58 |
62 |
62 |
58 |
81 |
72 |
При применении свинцового анода, покрытого слоем электрохимически нанесенного Ag+ (1) степень превращения минимальна (58 %), так же как и в опыте (4). Значение ХПК через первых 10 минут электроокисления больше в случае (1) по сравнению с (4). При использовании электродов, насыщенных ионами Ag+ электрохимическим путем, часть ионов переходит в раствор и оказывает незначительно ускоряющее действие на реакцию непрямого электрохимического окисления фенола лишь в начальный момент времени. В дальнейшем происходит разрушение серебряного слоя на поверхности свинцового анода с образованием оксида серебра, который оседает на дне электролизера и теме самым каталитический эффект действия серебра прекращается.
В случае использования серебряного катода (2) и (3), казалось бы, что скорость восстановления ионов серебра должна несколько замедлиться. Но, несмотря на то, что поверхность катода уже покрыта серебряным слоем, а часть избыточных ионов серебра с поверхности катода растворяется в объеме электролита, Ag+ в данном случае оказывают незначительный каталитический эффект на процесс непрямого электрохимического окисления фенола. Экспериментальные данные показывают, что степень превращения в опытах (2) и (3) отличается от полученных данных для опытов (1) и (4) всего на 6 %.
Меньшее значение α в опыте (4), в сравнении с (2) и (3), говорит о том, что реакции восстановления серебра на катоде ускоряются, так как потенциал свинцового катода позволяет с достаточно высокой скоростью вести осаждение серебра на свинцовой поверхности. Но в целом способы внесения серебра в раствор (1), (2), (3) и (4) оказывают ингибирующее действие.
По представленным экспериментальным данным можно сделать выводы о том, что лучше всего вносить серебро путем выдерживания свинцового анода в насыщенном растворе Ag+ (6) или при использовании металлической серебряной проволоки закрепленной на поверхности свинцового анода (5). Однако в случае (6) степень превращения фенола на 9 % меньше, чем для (5). Это происходит вследствие того, что серебро, покрывающее поверхность анода в первые минуты процесса (до того момента пока оно полностью не перейдет в объем электролита) препятствует образованию оксидной пленки свинца на поверхности которой должен протекать синтез окислителей (последние в свою очередь должны ускорить процесс окисления фенола в жидкой среде). Об этом свидетельствуют и значения ХПК растворов фенола.
Самое наибольшее значение α наблюдается для (5). В этом случае электрохимическая реакция растворения серебра по уравнению Ag° — ē = Ag+ протекает параллельно реакциям образования окислительной системы на PbO2. Поэтому каталитический эффект Ag+ является более ощутимым и явным.
Литература:
1. М. А. Шевченко, М.А., Марченко П. В., Таран П. Н., Лизунов В. В. Окислители в технологии водообработки. — Киев: Наукова думка, 1979. — 173 с.
2. Волгина Т. Н., Кукурина О. С., Новиков В. Т. Исследование деструкции фенола окислительным способом // Химия в интересах устойчивого развития, 2005. — № 1. — с. 41–44.
3. Сайт НПО Позитрон-Квинта: http://www.tk-pozitron.ru/ozon/about.php (дата обращения: 30.04.2015).







