В данной статье представлены обзорные данные о клинических проявлениях, методах диагностики и лечении токсоплазмозной инфекции у новорожденных. Своевременная диагностика и лечение данной инфекции, предотвращает летальный исход.
Ключевые слова: токсоплазмозная инфекция, интранатальное инфицирование беременной женщины и плода, полиорганные поражения плода, методы диагностики, антибиотики.
Токсоплазмоз у детей — врожденное (заражение в утробе матери) или приобретенное паразитарное заболевание.
Актуальность проблемы токсоплазмоза обусловлена практически повсеместным распространением возбудителя в природе, высокой частотой инфицированности токсоплазмами, возможностью длительной персистенции токсоплазм в различных органах и тканях, а также простыми путями передачи инфекции и ролью этой инфекции в перинатальной патологии.
Латентные формы токсоплазмозной инфекции, как и при многих других инфекциях, количественно преобладают над клинически выраженными. Заболевания токсоплазмозом различной степени тяжести развиваются при массивном заражении или при низком уровне иммунологической защиты организма.
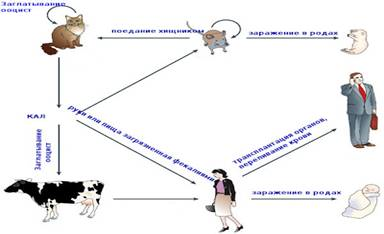
ЭТИОЛОГИЯ: Возбудитель — Toxoplasma gondii, облигатный внутриклеточный паразит, относится к типу Protozoa, классу Sporozoa и имеет сложный цикл развития. Окончательным (дефинитивным) хозяином токсоплазмы является домашняя кошка, а также дикие представители семейства кошачьих. При заражении кошки алиментарным путем паразиты проникают в эпителиальные клетки кишечника, где после нескольких бесполых генераций формируются макро- и микрогаметы. Половой процесс завершается образованием ооцист, которые выводятся с фекалиями кошки во внешнюю среду. Ооцисты токсоплазм высоко устойчивы к различным неблагоприятным воздействиям и сохраняют свою эффективность в почве при достаточной влажности до 2-х лет. Промежуточные хозяева — многие виды теплокровных животных, млекопитающие, птицы, а также человек. [12,15,24].
ОСНОВНЫЕ ИСТОЧНИКИ: Источником инфекции для людей могут быть домашние животные. Крупный и мелкий рогатый скот, свиньи, кролики, инфицированы токсоплазмами в 5 –15 % и человек может заразиться при употреблении недостаточно термически обработанного мяса. Проведенные в США исследования по изучению инфицированности кошек — основного хозяина паразита — показали, что 30 % кошек инфицированы токсоплазмами, но только 1 % выделяют ооцисты, которые при попадании в почву до 2 лет могут сохранять инфекционные свойства.
ПУТИ ЗАРАЖЕНИЯ: 1. Основной путь — пероральный. Он осуществляется в основном цистами или ооцистами. Заражение цистами может произойти при употреблении полусырого мяса или сырого мясного фарша, а заражение ооцистами — через грязные руки при контакте с кошками, при употреблении немытых или плохо вымытых овощей, ягод, загрязненных почвой. 2. Контаминационный путь — заражение через слизистые и поврежденную кожу — возможен у детей и взрослых при тесном контакте с больными животными, а также у взрослых, имеющих профессиональный контакт с животными (например, работники мясокомбинатов). 3. Возможна трансплантационная передача токсоплазмоза — при пересадке органов от донора с токсоплазмозной инфекцией. 4. Конгенитальный путь заражения — внутриутробное заражение плода от матери через плаценту — имеет важное значение в акушерской и педиатрической практике. Источником инфекции для плода в данном случае является мать. Доказано заражение плода только от женщин со свежей (первичной) инфекцией, приобретенной во время данной беременности, когда имеется паразитемия, и возбудитель с кровью может попасть в плаценту. В ней формируется первичный очаг инфекции, откуда токсоплазмы гематогенным путем попадают к плоду. У женщин, заразившихся токсоплазмозом до беременности (старая, хроническая или латентная инфекция), передача возбудителя в плод не доказана, развившийся иммунитет матери защищает плод от заражения. Не все женщины, заразившиеся во время беременности, имеют симптомы острого заболевания токсоплазмозом, а только одна из десяти. Обычно это лимфаденит. У остальных первичная инфекция протекает асимптомно. Но передача возбудителя плоду может происходить как от больных с лимфаденитом, так и от женщин с первичной асимптомной инфекцией. Установлено также, что не все женщины, заразившиеся во время беременности, передают инфекцию плоду, это происходит примерно у половины из них; у остальных успевает развиться иммунитет, защищающий плод. [5,13,24].
ЭПИДЕМИОЛОГИЯ: Инфицированность токсоплазмами в разных странах колеблется от 0 до 90 %. В Западной Европе и Северной Америке инфицированность здорового населения составляет 25–50 %, в то время как в Африке и Центральной и Южной Америке — до 90 %. Сравнительно низкая инфицированность в Азии — Афганистане, Вьетнаме, Индонезии. В средней полосе России инфицированность составляет 15–25 %, в Москве инфицированность составляет 25 %. Для региональной инфицированности играют роль климатические условия, хозяйственный профиль района, особенности национальной кухни, санитарное состояние и уровень культуры. Заболеваемость токсоплазмозом изучена недостаточно. Обязательная регистрация введена лишь в некоторых странах (ФРГ, Чешская и Словацкая республики). Имеются данные о частоте врожденного токсоплазмоза. Так, во Франции, Австрии, ФРГ на 1000 новорожденных приходится 1–8 детей с врожденным токсоплазмозом. [6,11].
ПАТОМОРФОЛОГИЯ ТОКСОПЛАЗМОЗА: При врожденном токсоплазмозе обнаруживают деструктивные изменения и кальцификаты в головном и спинном мозге, пигментный хориоретинит. Некротические очаги в коре, базальных ганглиях, мозжечке, перивентрикулярных областях, спинном мозге образуются в результате тромбоваскулита. В очагах некроза и вокруг них обнаруживаются токсоилазмы в виде псевдоцист. В дальнейшем в некротических очагах откладывается известь. Кальцификации могут подвергаться и сами паразиты. Крупные петрификаты можно обнаружить на рентгенограмме, а мелкие — только при гистологическом исследовании. Часто наблюдается обызвествление сосудистой стенки. Степень патологических изменений в мозге широко колеблется от небольших очагов деструкции до глубокого недоразвития мозга с явлениями гидроцефалии. При хориоретините в области желтого пятна обнаруживают овальной формы, беловато-желтого цвета диск, который образуется на месте воспалительно-некротического очага в результате разрастания соединительной ткани и атрофии сосудов сетчатки. В некоторых случаях очаги некроза находят в печени, почках, легких, миокарде. При инфицировании плода в период органогенеза токсоплазма вызывает настолько тяжелые изменения, что беременность заканчивается самопроизвольным выкидышем или рождением ребенка с пороками развития, не совместимыми с жизнью. Такие дети обычно погибают в ближайшее время после рождения. При более позднем заражении плода острый период токсоплазмоза может закончиться внутриутробно. В этом случае ребенок рождается с выраженными рубцовыми изменениями мозга, глаз, внутренних органов. Иногда ребенок рождается в период генерализации внутриутробной инфекции с текущими воспалительно-дегенеративными изменениями нервной системы, глаз и внутренних органов. При заражении плода в конце беременности ребенок рождается здоровым, а первичная генерализация и острый период токсоплазмоза наступают уже после рождения. [5,11,15,24].
Таблица 1
Клиника врожденного токсоплазмоза:
|
Возраст больных |
Форма |
Течение |
|
Новорожденные дети и первых месяцев жизни (от 0 до 3 мес.) |
Генерализованная |
Острое |
|
Менингоэнцефалическая |
Острое и подострое |
|
|
Энцефалическая |
Подострое и хроническое |
|
|
Резидуальная |
|
|
|
Дети грудного и раннего возраста (от 4–5 мес. до 3 лет) |
Энцефалическая |
Подострое и хроническое |
|
Резидуальная |
|
|
|
Дети дошкольного и школьного возраста |
Энцефалическая |
Хроническое |
|
Резидуальная |
|
КЛАССИФИКАЦИЯ.
Общепринятой классификации токсоплазмоза как таковой не существует.
Наиболее удобной является следующая классификация врожденного токсоплазмоза (Титова А. И., 2002 г.)
Особенности клинических проявлений заболевания зависят от степени вирулентности возбудителя, его способности к длительному персистированию в организме инфицированного, пути заражения (лабораторный, алиментарный, трансплацентарный, при трансплантации органов и тканей).
В 70–90 % случаев врождённого токсоплазмоза у новорожденных отсутствует какая-либо симптоматика, заболевание начинает проявляться через месяцы и годы. Симптомами врождённого токсоплазмоза при рождении могут быть макулопапулезная сыпь, генерализованная лимфоаденопатия, гепатомегалия, спленомегалия, желтуха, тромбоцитопения. Как следствие внутриутробного менингоэнцефалита развивается микроцефалия, гидроцефалия, хореоретинит, судорожный синдром и глухота. Очаги кальцификации в головном мозге можно обнаружить при рентгенографии, ультрасонографии, компьютерной томографии.
Ребенок рождается в различных стадиях развития токсоплазмоза:
1. Если заражение произошло незадолго до рождения, то ребенок родится в стадии генерализации процесса. Это генерализованная клиническая форма с острым течением.
2. Если заражение произошло на более раннем этапе внутриутробного развития плода, стадия генерализации токсоплазменного процесса может быть законченной до рождения ребенка. К моменту рождения на первое место выступают симптомы поражения центральной нервной системы (менингоэнцефалит), воспалительные изменения со стороны глаз и другие явления. При рождении у детей может быть гидроцефалия, микроцефалия, судороги, микрофтальм, врожденная катаракта, кальцификаты в мозгу и т. д. Эта клиническая форма называется менингоэнцефалитической с подострым или хроническим течением.
3. Если заражение произошло в эмбриональном периоде, все стадии патологического процесса к моменту рождения закончились и гибель человеческого эмбриона не наступила, ребенок рождается с различными дефектами (уродствами). Эта форма называется резидуальной.
Генерализованная форма врожденного токсоплазмоза с острым течением у новорожденных детей протекает в основном по типу сепсиса, пневмонии и других острых инфекционных заболеваний. Длительность лихорадочного периода и характер температурной кривой различны. Кожные покровы могут быть бледными, с серовато-землистым или желтушным оттенком. Бывают экзантемы в виде розовой или красной пятнисто-папулезной сыпи, расположенной симметрично, преимущественно на конечностях. Сыпь держится 2–3 дня, но может рецидивировать. Реже наблюдаются кровоизлияния, отеки внизу живота, половых органов, нижних конечностей. У больных детей часто возникает пневмония, преимущественно интерстициального типа, бывают поражения сердца (миокардиты и т. д.). Почти регулярно обнаруживаются диспепсические явления (учащенный жидкий стул, рвота), стойко держится спленогепатомегалия. Больные дети плохо прибавляют в весе. В крови отмечается повышенный нейгрофильный лейкоцитоз, эозинофилия, увеличенная СОЭ, в моче обнаруживаются белок, цилиндры, эритроциты. Отмечается мышечная гипо- или гипертония, постепенно начинает увеличиваться голова, открывается малый и боковые роднички, нарастают явления гидроцефалии. Эта клиническая форма заболевания нередко заканчивается летальным исходом. При благоприятном течении воспалительный процесс постепенно затихает, ликвидируется или принимает подострое хроническое течение.
При менингоэнцефалитической форме температура тела может быть нормальной или субфебрильной. Ребенок иногда нормально физически развивается, но он вял или, наоборот, беспокоен, криклив. При внимательном наблюдении можно заметить адинамию, парезы, единичные судороги, тремор, гипертонию мускулатуры, напряжение родничков, а в дальнейшем микроцефалию, гидроцефалию, явления олигофрении, эпилепсии. На рентгенограмме черепа обнаруживаются кальцификаты. Последние представляют собой участки некроза с отложением солей кальция. Величина их обычно не превышает 2мм в диаметре; как правило, они множественны. Локализация их разнообразна, они могут быть расположены в коре и более глубоких слоях полушарий. Цереброспинальная жидкость прозрачна или ксантохромна, количество белка увеличено до 5 %, констатируется белково-клеточная диссоциация. Очень часто поражается орган зрения: микрофтальм, гидрофтальм, изменения со стороны орбиты, экзофтальм, косоглазие, аблефария, эпикантус, сращение краев век между собой, «синие склеры», помутнение роговицы, хрусталика, стекловидного тела, колобома радужной оболочки, изменения положения, формы и множественность зрачков, отсутствие радужки, иридоциклит, хореоретинит, глаукома, неврит зрительного нерва.
Резидуальная форма токсоплазмоза представляет собой по существу эмбриопатию и проявляется аномалиями развития (уродствами). Могут быть врожденные пороки сердца, расщепление верхней губы, твердого неба, позвоночника, недоразвитие конечностей, микрофтальм, катаракта, глухота, слепота, микроцефалия, другие поражения центральной и периферической нервной системы.
Классическая тетрада, характерная для перенесенного внутриутробного токсоплазмоза, включает гидроцефалию, кальцификаты в мозге, хориоретинит и гепатоспленомегалию.
Среди пороков развития нервной системы при токсоплазмозе наиболее частыми являются анэнцефалия, микроцефалия, гидроцефалия, мозговые грыжи.
При заражении в более поздние сроки беременности ребенок родится с текущим менингоэнцефалитом или с его последствиями. Дети беспокойны или, наоборот, вялы, малоактивны, плохо сосут, теряют в массе. Наблюдаются нистагм, косоглазие, мышечная гипертония, судороги, задержка психического развития.
При заражении в последние месяцы беременности наиболее выражены симптомы острого заболевания: высокая температура, общая интоксикация, срыгивание, рвота, дыхательные расстройства, повышение мышечного тонуса, судороги, гепато-лиенальный синдром, анемия, лимфоаденопатия.
У детей первых недель и месяцев жизни острые токсоплазмозные энцефалиты протекают особенно тяжело и часто заканчиваются летально. Наряду с этим одним из вариантов течения врожденного токсоплазмоза является субклиническая инфекция, протекающая в течение длительного промежутка времени малосимптомно, в основном с общесоматическими проявлениями. Иногда единственным клиническим признаком врожденного токсоплазмоза может быть прогрессирующая гидроцефалия или задержка психического развития.
Кроме поражения центральной нервной системы наиболее частым симптомом врожденного токсоплазмоза является хориоретинит. Возможны также неспецифические эндокринные нарушения, нефротический синдром, дисфункция печени, внутрикожные кровоизлияния вследствие тромбоцитопении, миокардит, глухота. Иногда врожденный токсоплазмоз может проявляться эритробластозом и водянкой плода.
Токсоплазменный хориоретинит. Поражение глаз возможно и при врожденном, и при приобретенном токсоплазмозе, у детей и взрослых. Основные очаги поражения располагаются в сосудистой оболочке и склере. Очаговое поражение сетчатки сопровождается воспалением, вызывает иммунную реакцию и завершается фиброзом. Возможен и диффузный ретинит, при котором воспаление нередко распространяется на стекловидное тело. Токсоплазменныйхориоретинит рецидивирует даже после лечения, часто — в раннем подростковом возрасте.
К резидуальным симптомам врожденного токсоплазмоза относятся задержка физического развития, нарушение порядка и сроков окостенения и прорезывания зубов, замедление полового созревания, гидроцефалия, параличи, парезы, гиперкинезы, речевые нарушения, судороги, отставание в психическом развитии, атрофия зрительного нерва, катаракта, тугоухость, различные эндокринные расстройства и др. [2,4,5,7,10,16,20,22,23].
ДИАГНОСТИКА: В диагностике токсоплазмоза большое значение имеют анамнестические, клинические (классическая триада — обструктивная гидроцефалия, хориоретинит, внутричерепные кальцификаты) и лабораторные (непосредственное обнаружение токсоплазм в окрашенных мазках крови, ликворе, в мазках пунктата и биоптата лимфатических узлов) данные. Для выявления специфических антител проводят РСК, РИФ, ИФА, кожную пробу (КП) с токсоплазмином; определяют специфические IgM и IgG (РЭМА -реакция энзиммеченных антител); снимают ЭКГ, осуществляют R-графию черепа, проводят исследования на предмет наличия паразитов в мышцах, а также внутрикожную аллергическую пробу (ВАП) с токсоплазмином и реакции бласттрансформации, Сейбина-Фельдмана (РСФ), РПГА, ПЦР. Подтверждает наличие токсоплазмоза факт нарастания титра антител в динамике заболевания или присутствие в высоком титре специфических антител класса IgM (анти-ТОХО IgM) выявляющихся при иммуноферментном анализе.
При остро текущей форме токсоплазмоза в сыворотке крови обнаруживаются анти-ТОХО IgM при отрицательной кожной пробе (положительны также РСК, РИФ, РПГА), хронический токсоплазмоз — при выявлении анти-ТОХО IgG и стойкой положительной кожной пробе.
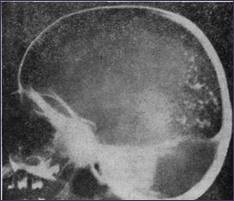
Рис. 1. Рентгенограмма черепа (боковая проекция). Множество интрацеребральных калыцификаций (Коуэн, Вольф и Пейдж).
Основным методом диагностики является серологический. Иммуноглобулины G (определяемые с помощью реакции непрямой флюоресценции или иммуноферментный анализ) достигают пиковой концентрации через 1–2 месяца после инфекции и остаются позитивными неопределённо долго. У пациентов с сероконверсией или четырехкратным увеличением титра IgG следует определить специфические IgM для подтверждения острой инфекции. Наличие IgM подтверждает острую или недавно перенесённую инфекцию. Иммуноферментный анализ более чувствителен при определении IgM. IgM определяются через 2 недели после инфицирования, достигая пиковой концентрации через 1 месяц, и обычно исчезают через 6–9 месяцев, но могут персистировать в отдельных случаях более 2 лет, затрудняя дифференцировку острой и перенесённой ранее инфекции. Определение IgA и IgE, уровень которых растет быстрее, чем IgM, полезно при диагностике врождённого токсоплазмоза и обследовании пациентов, в частности беременных женщин, для которых информация о длительности и стадии инфекционного процесса чрезвычайно важна.
Диагноз врождённого токсоплазмоза может быть установлен пренатально при исследовании крови плода или амниотической жидкости (определение IgM и IgA, ДНК Т.gondii с использованием ПЦР). При ультрасонографии увеличение размеров латеральных желудочков являются косвенными признаками инфекции.
При подозрении на токсоплазмоз у новорожденных следует провести исследование зрительной, слуховой и нервной систем, люмбальную пункцию, компьютерную томографию головы. Так же следует попытаться выделить возбудителя из плаценты, пупочного канатика, крови путём заражения мышей. Альтернативой может быть выделение возбудителя из спинномозговой или амниотической жидкости с помощью ПЦР. Возможно выделение возбудителя при заражении лабораторных животных, но заключение, что в данном препарате обнаружены токсоплазмы, не несёт никакой положительной информации, за исключением той, что данный пациент был ими инфицирован. Также и отсутствие в препарате возбудителя не может служить основанием для исключения токсоплазмоза, поскольку в исследуемый материал он мог просто не попасть. [8,9,14,18,19,21].
ЛЕЧЕНИЕ: Специфическая терапия должна быть проведена в каждом случае врожденного токсоплазмоза или внутриутробного инфицирования токсоплазмами, даже в случае субклинического или латентного течения инфекции.
Препараты и дозы:
Пириметамин (дараприм, хлоридин, тиндурин) + сульфадимезин — 4–6-недельный курс. Оба препарата ингибируют синтез фолиевой кислоты, но на разных уровнях, т. е. действуют синергично. К сожалению, они так же, как и антибиотики, не оказывают выраженного влияния на внутриклеточные и инцистированные формы токсоплазм, а потому лечение при врожденном токсоплазмозе длительное. Хлоридин в первые 2 дня дают внутрь в нагрузочной дозе 2 мг/кг/сут., разделенной на два приема; далее — в дозе 1 мг/кг/сут. (в 2 дозах для приема внутрь) один раз в 2 дня, ибо период полувыведения препарата из организма — около 100 ч.
Сульфадимезин назначают в дозе 50–100 мг/кг/сут. в 2 или 4 приема внутрь. Для предотвращения гематологической токсичности хлоридина и сульфадимезина три раза в неделю дают фолиевую кислоту внутрь или парентерально в дозе 5 мг (оптимально 10 мг лейковорина).
Спирамицин (антибиотик из группы макролидов) — 1–1,5-месячный курс в дозе 100 мг/кг/сут., разделенной на 2 приема, внутрь.
Кортикостероиды (преднизолон) в дозе 1,0 мг/кг/сут, разделенной на два приема, внутрь (утром и днем) назначают при доказанном активном воспалительном процессе до его стихания (в частности, до снижения уровня белка в ЦСЖ до 1 г/л или до визуального стихания хориоретинита). Прежде чем отменить препарат, дозу снижают постепенно.
Рекомендуется сочетание пириметамина и сульфадиазина + фолиевая кислота назначать непрерывно в течение 2–6 мес., далее делать месячный перерыв и вновь возвращаться к аналогичному курсу (т. е. не чередовать с курсами спирамицина). J. S. Remington и соавт. (1995) подчеркивают, что эритромицин обладает меньшей активностью против токсоплазм, чем спирамицин. В настоящее время другие препараты при врожденном токсоплазмозе не используют. Бисептол (бактрим) эффективен при экспериментальном токсоплазмозе, но в клинике эффект его не доказан. Клиндамицин также эффективен при экспериментальном токсоплазмозе, но его не рекомендуют назначать детям из-за высокой частоты побочных эффектов (язвенно-некротический энтероколит, токсико-аллергические реакции)
Показания для специфической терапии (Remington J. S., Desmonts G., 1990):
1. Очевидный токсоплазмоз (врожденный) — общая длительность специфической терапии 1 год: 4–6 нед. — комбинация хлоридина с сульфадимезином + фолиевая кислота 2 раза в неделю; в течение года — 4 курса, разделенных 1–1,5-месячными курсами спирамицина. При втором варианте длительность комбинированного назначения хлоридина и сульфадимезина — 6 мес, а далее (до 1 года) — месячные курсы этих препаратов, чередующиеся с курсами спирамицина. После года лечения обычно необходимости в специфической терапии нет, но надо руководствоваться клинической картиной и результатами иммунологических исследований.
2. Очевидный токсоплазмоз (врожденный) с доказательствами активного воспалительного процесса (хориоретинит, менингоэнцефалит, генерализованная инфекция, желтуха): то же + кортикостероиды.
3. Субклинический врожденный токсоплазмоз, но доказанный иммунологически, — то же, что и при очевидном. Оптимально 6-недельный курс хлоридина + сульфадимезина и 6-недельный курс спирамицина и далее 4-недельные курсы хлоридина и сульфадимезина, чередующиеся с 6-недельными курсами спирамицина. И так — до 1 года.
4. Здоровые дети без убедительных серологических доказательств наличия инфекции, но с доказанным активным приобретенным токсоплазмозом у матери во время беременности: 4-недельный курс хлоридина и сульфадимезина, далее курс спирамицина и в дальнейшем — в зависимости от результатов исследований.
5. Здоровые дети с положительными результатами иммунологического обследования на токсоплазмоз: спирамицин в течение 1 мес. и далее курс хлоридина и сульфадимезина, в последующем — в зависимости от результатов обследования.
Побочные эффекты хлоридина: анорексия, рвота, диарея, боли в животе; тремор, атаксия, судороги; агранулоцитоз, апластическая или мегалобластическая анемия, лейкопения, тромбоцитопения; многоформная эритема (синдром Стивенса-Джонсона), токсический эпидермонекролиз (синдром Лайелла).
Побочные эффекты сульфаниламидных препаратов: олигурия, анурия, кристаллурия, гематурия из-за токсического нефроза; тошнота, рвота, боли в животе, стоматит; гемолитическая анемия и повышение уровня непрямого билирубина в крови с увеличением риска ядерной желтухи; лейкопения, нейтропения, тромбоцитопения; судороги; фотосенсибилизация и различные кожные сыпи; многоформная эритема и токсический эпидермонекролиз.
Оправдала себя схема применения препаратов пириметамина (суточная доза тиндурина 1 мг/кг, дают в 2 приема) и сульфаниламидов короткого действия (0,1 г/кг в 3–4 приема) циклами: 5 дней — тиндурин, сульфаниламид — 7 дней; 3 цикла с перерывами между ними 7–14 дней. Такой курс терапии по показаниям (хроническая форма, при иммунодефицитном состоянии, обострении хориоретинита и др.) повторяют через 1–2 мес. Имеются комбинированные препараты фансидар, метакельвин, содержащие в 1 таблетке по 25 мг пиримидина и 500 мг сульфадоксина. ПДВУИ рекомендуют один раз в 3 дня давать препараты фолиевой кислоты. Как альтернативные препараты, ПДВУИ предлагают ко-тримоксазол (бактрим), спирамицин, рокситромицин. [1,3,6,9,17].
Таблица 2
Показания к терапии токсоплазмоза (ПДВУИ, М.,2001г.)
|
Клиническая форма |
Клинические и лабораторные показатели |
Терапия |
|
Острая (манифестная) форма: а) генерализованная; б) локализованная (гепатит, энцефалит, хориоретинит и др.) |
Симптомы острого воспалительно-дегенеративного процесса. Динамика специфических Ig:IgM-IgG, высокий уровень специфических антител |
Лечение назначить как можно быстрее |
|
Остаточные явления токсо-плазменного: а) хориоретинита; б) менингоэнцефалита и др. |
Хориоретинит: пигментация, фиброз. Энцефалопатия: эписиндром, отставание в психомоторном развитии. Низкие уровни антител (реже средние и высокие) класса IgG |
Специфическое лечение не показано. Осмотр окулиста 2 раза в месяц, но возможно обострение хориоретинита
|
|
Сочетанные варианты острого токсоплазмоза с другими инфекциями: а) перинатальными; б) постнатальными вирусно-бактериальными |
Клиническая картина; высокие и средние титры антител класса IgM, затем низко авидные IgG |
Выбор первоочередной, а также комплексной терапии с учетом клинико-лабораторных показателей |
|
Острое субклиническое инфицирование |
Учесть акушерский анамнез. Антитела класса IgM у матери и ребенка |
Лечение |
|
Инфицированность в сочетании с не инфекционными заболеваниями: а) наследственными; б) онкогематологическими; в) аллергическими; г) экопатологическими; д) гипертензионно-гидроцефальным синдромом и др. |
Антитела класса IgG. Достоверно установлен диагноз не инфекционного заболевания |
Специфическая терапия не показана |
|
Инфицированность у практически здоровых детей |
Чаще низкие и средние титры антител класса IgG. Могут быть и высокие |
Лечение не проводится |
Заключение. Наибольший вред токсоплазмоз, если симптомы у детей ярко выражены, может нанести желудочно-кишечной, сердечно-сосудистой, нервной и другим системам организма. Однако вовремя начатое лечение, как правило, успешно справляется с инфекцией и тяжелых осложнений удается избежать. Наиболее опасен с этой точки зрения врожденный токсоплазмоз у детей, особенно если мать заболела в 1 и 2 триместре беременности. Паразиты могут полностью нарушить зрение, вплоть до слепоты, возможно отставание в умственном развитии на фоне поражения мозга. Вот почему нередко рекомендуют прерывание беременности.
Исходя из этого, беременные женщины, чей серостатус не известен, или серонагативные должны избегать контакта с землёй и другими объектами, которые могут быть загрязнены фекалиями кошек, или работать в перчатках и мыть руки после работы. Домашние кошки, во избежание инфицирования, не должны питаться сырым мясом и пойманными грызунами. Необходимо проводить достаточную тепловую обработку мяса, мыть овощи и фрукты, мыть руки и кухонные поверхности после контакта с сырым мясом, овощами и фруктами.
Профилактика токсоплазмоза заключается, в первую очередь, в укреплении естественных защитных сил организма, соблюдении правил гигиены (мытье овощей и фруктов, рук, особенно, после общения с кошками). Желательно домашних питомцев проверять на наличие у них паразитов. При употреблении в пищу мяса и яиц, подвергать их термической обработке, не пробовать сырой фарш или мясо.
Литература:
1. Васильев, В. В. Рациональная терапия токсоплазмоза / В. В. Васильев, В. Н. Тимченко, И. С. Васильева // Детские инфекции. 2004.
2. Клиническая характеристика детей с врожденным токсоплазмозом / Т. И. Долгих [и др.] // Российский педиатрический журнал. 2002. № 1.
3. Бакулева Л. П., Лысенко А. Я., Асатова М. М. О системе мероприятий по профилактике врожденного токсоплазмоза // Акушерство и гинекология. — 2003. -№ 6.
4. Буланьков Ю. И., Никитин А. Ф., Васильев В. В., Соловьев А. И. Классификация токсоплазмоза // Сб. науч. тр., посвящ. 80-летию каф.инф. болезней «Вопросы инфекционной патологии»: СПб., 2008г.
5. Перинатальные TORCH-инфекции. Karen E.Johnson/ Overviewof Torchinfections / UpToData, 2002 г. Перевод с английского — Ю. М. Богданов.
6. О выявлении и профилактике токсоплазмоза в Москве. Методические рекомендации (№ 25). М., 2007.
7. Борисов Б. А., Дзуцева Ф. К., Мороз Б. В. Клинико-неврологические проявления токсоплазменной инвазии. Учебное пособие. М., 2003г.
8. Авдеева, М. Г. Современное течение и особенности диагностики острого приобретенного токсоплазмоза / М. Г. Авдеева, А. А. Кончакова // Инфекционные болезни. 2012. — № 3. — С. 63–66.
9. Долгих, Т. И. Современный подход к диагностике и лечению токсоплазмоза: пособие для врачей — Омск: 2005. — 45 с.
10. Перфилов, А. П. Врожденный токсоплазмоз у детей / А. П. Перфилов, Т. И. Померанцева, О. В. Скоробогатова // Украiнский медичний альманах. — 2008. — Т.11. — № 3. — С.122–125
11. Токсоплазмоз: пособие для врачей / Е. Л. Красавцев, В. М. Мицура. — Гомель: УО ГГМУ, 2009. — 30 с.
12. Dubey, J. P. Toxoplasma gondii / JP Dubey // BMJ. 2000. — Vol. 322. — P. 142–147.
13. Боровкова Е. И. Факторы и условия, влияющие на процесс инфицирования плода на разных сроках беременности / Боровкова Е. И., Сидорова И. С. и др. // Вестник Российской Академии Медицинских Наук. — 2004.—№ 1. с. 48–50.
14. Германенко И. Г. Врожденный токсоплазмоз: клиника и диагностика / Германенко И. Г., Нилипович Е. Д., Клюйко H.JI.// VI Российский съезд врачей-инфекционистов / Материалы съезда.- СПб., ВМедА.- 2003.-С.86.
15. Заводнова О. С. Врожденный токсоплазмоз / Заводнова О. С., Безроднова С. М., Боташева B. C., Кальная T. B.// Российский педиатрический журнал. 2005. — № 1. С. 13–16.
16. Косыгин В. А. Гидроцефалия у детей первых трех лет жизни при внутриутробных цитомегаловирусной и токсоплазменной инфекциях: Дис.. канд. мед. наук.- Ставрополь, 2005.—207 с.
17. Лобзин Ю. В. Токсоплазмоз у беременных: клинические проявления, терапия и медикаментозная профилактика врожденного токсоплазмоза / Лобзин Ю. В., Васильев В. В. // Российский медицинский журнал.-2001. № 5. — С.40–41.
18. Макаров О. В. Современные представления о диагностике внутриутробной инфекции / Макаров О. В., Бахарева И. В., Ганковская JI. В., Идрисова J1. С. // Российский вестник акушера гинеколога. 2006. — Т. 6, № 6. -С.11–15.
19. Малкова Е. М. Диагностика внутриутробных инфекций у новорожденных детей методом полимеразной цепной реакции / Методические рекомендации для врачей // Малкова Е. М., Гришаева О. Н. — Томск, Кольцово -2000.
20. Полунин B. C. Медико-социальные факторы риска возникновения пороков развития спинного мозга / B. C. Полунин, Е. И. Нестеренко, В. В. Попов и др. // РМЖ. 2006. — № 1. — С.3–6.
21. Протокол диагностики, лечения и профилактики внутриутробных инфекций у новорожденных детей (второе издание, переработанное и дополненное). Под ред. Володина H. H., Антонова А. Г., Базаровой М. А., Байбариной E. H. и др. М.: ГОУ ВУНМЦ МЗ РФ, 2002. 53 с.
22. Скляр К. Е. Роль внутриутробной инфекции в механизмах формирования врожденных пороков развития / Скляр К. Е., Малкова Е. М., Рязанцева Н. В. и др. // Бюллетень Сибирской медицины: научно-практический журнал. 2005. — № 1. — С. 80–84.
23. Туки А., Пекхем С. et al. Врожденные, перинатальные и неонатальные инфекции / Туки А., Пекхем С. et al. — М.:, Медицина, 2000. -288 с.
24. Токсоплазмоз у детей. Основные симптомы. Лечение. Ольга Ляшенко. Журнал «Здоровье младенца и уход».







