При выгорании метанола, воспламененного распыленным дизельным топливом (ДТ), в цилиндре дизеля создаются высокие локальные концентрации активных центров цепных реакций — атомов и свободных радикалов, возникающих в результате деструктивных превращений, окисления и распада углеводородов метанола в окрестностях испаряющихся и горящих капель ДТ. В этих условиях образование оксидов азота отличается двумя главными особенностями: во-первых, решающую роль в этом процессе играет не только тепловое, но и цепное ускорение реакций за счет высоких локальных концентраций активных частиц; во-вторых, процессы их образования тесно связаны конкуренцией в потреблении активных частиц и кислорода. Образование оксидов азота NOх происходит через сложные превращения продуктов реакций метанольных радикалов с азотом воздушной среды в предпламенной и послепламенной зонах. Скорость этих процессов зависит от концентрации азота в объеме цилиндра дизеля, скорости сгорания, доли выгоревшего метанола, а также скорости конкурирующих реакций продуктов неполного сгорания, в том числе СО и сажевых частиц [1,5].
Используя результаты моделирования изотермических кинетических систем для расчета кинетики образования оксидов азота при горении метанола и ДТ в условиях сгорания в дизелях, кроме того, суммируя известные данные протекания элементарных реакций при сгорании метанола и выделяя из них наиболее весомые, исключая процессы с большими энергиями активации, механизм процесса образования оксидов азота в цилиндре дизеля при работе на метаноле с двойной системой топливоподачи (ДСТ) можно представить в виде определенной последовательности этапов и ветвей образования промежуточных и конечных элементов так, как это видно на рисунке 1. Полный перечень реакций предложенного механизма представлен в таблице 1.
Таблица 1
Элементарные реакции образования оксидов азота в цилиндре дизеля при работе на метаноле с ДСТ
|
№ реакции |
Реакция |
|
1 |
2 |
|
1 |
N2 + O2 → 2NO |
|
2 |
NO + HO2∙→ NO2 + OH∙ |
|
3 |
NO + OH∙→ NO2 + H. |
|
4 |
N2 + O + M → N2O + M |
|
5 |
N2 + HO2∙→ N2O + OH∙ |
|
6 |
N2O + O → 2NO |
|
7 |
NО2 + H → NO + OH∙ |
|
8 |
CH3OH∙ → CH3 + OH∙ |
|
9 |
CH3OH∙ + OH∙ → CH2OH∙ + H2O |
|
10 |
CH3OH∙ + H → CH2OH∙ + H2 |
|
11 |
CH3OH∙ + H → CH3 + H2O |
|
12 |
CH3∙ → CH2∙ + H |
|
13 |
CH2∙ + CH3∙ → C2H2∙ + H2 +H |
|
14 |
C2H2∙ → 2CH∙ + H2 |
|
15 |
CH3OH∙ + CH3∙ → CH2OH∙ + CH4 |
|
16 |
CH3OH∙ + HO2∙ → CH2OH∙ + H2O2∙ |
|
17 |
CH3OH∙ + O → CH2OH∙ + OH∙ |
|
18 |
CH2OH∙ + O2 → CH2O∙ + OH∙ |
|
19 |
CH2OH∙ + M → CH2O∙ + H + M |
|
20 |
CH3∙ + O2 → CH2O∙ + OH∙ |
|
21 |
CH3∙ + O → CH2O∙ + H |
|
22 |
CH2O∙ + OH∙ → CHO∙ + H2O |
|
23 |
CH2O∙ + H → CHO∙ + H2 |
|
24 |
CH2O∙ + M → CO + H2 + M |
|
25 |
CH2∙ + N2 → HCN∙ + NH∙ |
|
26 |
СН∙ + N2 → HCN∙ + N) |
|
27 |
СН∙ + N → CN∙ + H |
|
28 |
CN∙ + OH∙ → HCN∙ + O |
|
29 |
HCN∙ + O → CN∙ + OH∙ |
|
30 |
HCN∙ + H → CN∙ + H2 |
|
31 |
CN∙ + O → CHO + N |
|
32 |
CN∙ + O2 → CO + NO |
|
33 |
NH∙ + O → NO + H |
|
34 |
N2 + O → NO + N |
|
35 |
NO + N → N2 + O |
|
36 |
N + O2 → NO + O |
|
37 |
NO + O → N + O2 |
|
38 |
N + ОН∙ → NO + H |
|
39 |
NO + H → N + ОН∙ |
|
40 |
НNО + ОН∙ → NO + H2О |
|
41 |
HNО + O → NO + OH∙ |
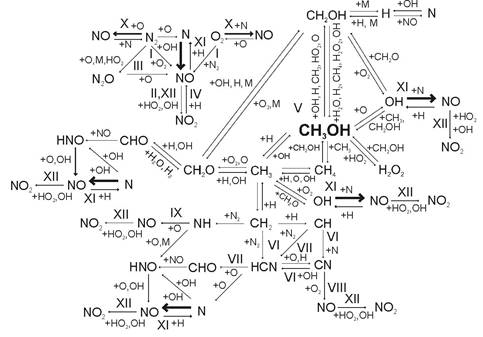
Рис. 1. Химизм процесса образования оксидов азота в цилиндре дизеля при работе на метаноле с двойной системой топливоподачи: I — образование NO по бимолекулярной реакции; II — окисление NO до NO2 в предпламенной зоне; III — образование и разложение гемиоксида азота N2O; IV — образование NO за счет расхода NO2; V — термический пиролиз метанола; VI — взаимодействие молекулярного азота с углеводородными фрагментами; VII — превращение HCN в CN; VIII, IX — образование быстрого NO; X — образование термического NO по механизму Я. Б. Зельдовича; XI — образование термического NO через радикалы OH; XII — окисление NO до NO2 в запламенной зоне
При смешении паров топлива — метанола, дизельного топлива (запального) и окислителя — при температурном режиме 1000 К и более образование оксида азота происходит в результате столкновения молекул азота метаноловоздушной смеси с молекулами кислорода (цепь I, рис. 1):
N2 + O2 → 2NO. (1)
Образовавшийся в результате оксид азота в предпламенной зоне, под действием в основном пероксидного радикала НО2, образующегося в зоне гибели атомарного водорода и радикала ОН, доокисляется до NO2 (ветвь II, рис. 1):
NO + HO2∙→ NO2 + OH∙; (2)
NO + OH∙→ NO2 + H. (3)
При температурном уровне менее 1500 К, где имеется недостаток окислителя азота метаноло-воздушной смеси, происходит образование быстрых оксидов азота по схеме (цепь III, рис. 1) с образованием и разложением гемиоксида азота N2O:
N2 + O + M → N2O + M; (4)
N2 + HO2∙→ N2O + OH∙; (5)
N2O + O → 2NO. (6)
Образовавшийся при низкой температуре диоксид азота NO2 практически весь переходит в оксид азота по реакции 7 за счет расхода NО2 (ветвь IV, рис. 1):
NО2 + H → NO + OH∙. (7)
Образующиеся в результате пиролиза молекулы метанола СН3ОН (цепь V, рис. 1):
CH3OH∙ → CH3 + OH∙; (8)
CH3OH∙ + OH∙ → CH2OH∙ + H2O; (9)
CH3OH∙ + H → CH2OH∙ + H2; (10)
CH3OH∙ + H → CH3 + H2O; (11)
CH3∙ → CH2∙ + H; (12)
CH2∙ + CH3∙ → C2H2∙ + H2 +H; (13)
C2H2∙ → 2CH∙ + H2; (14)
CH3OH∙ + CH3∙ → CH2OH∙ + CH4; (15)
CH3OH∙ + HO2∙ → CH2OH∙ + H2O2∙; (16)
CH3OH∙ + O → CH2OH∙ + OH;∙ (17)
CH2OH∙ + O2 → CH2O∙ + OH;∙ (18)
CH2OH∙ + M → CH2O∙ + H + M; (19)
CH3∙ + O2 → CH2O∙ + OH;∙ (20)
CH3∙ + O → CH2O∙ + H; (21)
CH2O∙ + OH∙ → CHO∙ + H2O; (22)
CH2O∙ + H → CHO∙ + H2; (23)
CH2O∙ + M → CO + H2 + M. (24)
углеводородные фрагменты взаимодействуют с азотом (цепь VI, рис. 1):
CH2∙ + N2 → HCN∙ + NH∙; (25)
СН∙ + N2 → HCN∙ + N; (26)
СН∙ + N → CN∙ + H; (27)
CN∙ + OH∙ → HCN∙ + O. (28)
При этом в качестве промежуточных продуктов выступают соединения типа HCN∙и СN∙, участвующие в последующем механизме образования быстрого NO.
Половина HCN∙, образовавшегося по реакциям 25, 26 и 28, превращается в CN∙(цепь VII, рис. 1):
HCN∙ + O → CN∙ + OH∙. (29)
Ещё около 10 %, образовавшегося в этих реакциях HCN∙ переходит в CN по реакции:
HCN∙ + H → CN∙ + H2, (30)
а остальные 40 % преобразуются в N по реакции:
HCN∙ + O → CHO + N. (31)
Возникающие в процессе цепных реакций радикалы CN∙, NH∙ являются дополнительными центрами образования быстрого NO (ветви VIII, IX, рис. 1):
CN∙ + O2 → CO + NO; (32)
NH∙ + O → NO + H. (33)
Далее протекает образование термического NO по механизму Я. Б. Зельдовича (цепь X, рис. 1):
N2 + O → NO + N; (34)
NO + N → N2 + O; (35)
N + O2 → NO + O; (36)
NO + O → N + O2. (37)
При глубоком пиролизе топлива в камере сгорания дизеля при работе на метаноле с двойной системой топливоподачи находится большое количество локальных объемов метаноло-воздушной смеси, в которых присутствуют промежуточные химически неустойчивые продукты низкотемпературного разложения метанола, в том числе радикалы ОН. Поэтому образование термического NO протекает также по схеме через радикалы ОН∙ (цепь XI, рис. 1):
N + ОН∙ → NO + H; (38)
NO + H → N + ОН∙; (39)
НNО + ОН∙ → NO + H2О; (40)
HNО + O → NO + OH∙. (41)
Кроме того, происходит доокисление возникших в процессе реакций 25…30 радикалов CN∙, NH∙по реакциям (32), (33).
При максимальной температуре и избытке окислителя преобладающими являются реакции окисления СН3ОН, определяющие тепловой режим в цилиндре дизеля при работе на метаноле с двойной системой топливоподачи. Здесь образование термического NO происходит в определяющей степени по реакциям 36…41 (цепи X, XI, рис. 1). Атомы азота не начинают цепной реакции, так как их равновесная концентрация во время горения низка по сравнению с равновесной концентрацией атомарного кислорода. Поэтому в дизеле при работе на метаноле интенсивное образование оксида азота происходит после окончания первой стадии горения метаноло-воздушной смеси, характеризующейся почти полным расходом исходных углеводородов и образованием максимальных концентраций промежуточных продуктов сгорания — СО и Н2. При уменьшении температуры происходит расход оксида азота по реакциям 17…39 (цепи X, XI, рис. 1) [2,3].
При температуре ниже 970 К происходит доокисление NO в NO2 в запламенной зоне за счёт реакций 2 и 3 (ветвь XII, рис. 1).
Всего же в продуктах сгорания метаноло-воздушной смеси содержатся различные оксиды азота, которые по термодинамической устойчивости можно расположить в ряд по убыванию:
NO, N2O, NO2, N2O3, N2O4, N2O5.
Характерной особенностью всего процесса образования NOх в цилиндре дизеля при работе на метаноле с двойной системой топливоподачи является преобладание образующегося оксида азота по механизму Я. Б. Зельдовича и через радикалы ОН∙, количество которых на много порядков выше количества всех остальных, образующихся в процессе горения метаноло-воздушной смеси [4,6].
Следовательно, разработка расчетной модели для этого механизма позволит без трудоемких и дорогостоящих экспериментальных работ на натурных объектах исследовать влияние различных параметров, таких как применение метанола, на образование и выход основного токсичного компонента.
Литература:
1. Анфилатов А. А. Снижение содержания оксидов азота в отработавших газах дизеля 2Ч 10,5/12,0 путём применения метанола с двойной системы топливоподачи. Автореферат диссертации на соискание ученой степени кандидата технических наук / Санкт-Петербургский государственный аграрный университет. Санкт-Петербург, 2009. — 18 с.
2. Анфилатов А. А., Лиханов В. А., Лопатин О. П. Исследование процессов образования и разложения оксидов азота в цилиндре дизеля 2Ч 10,5/12,0 путем применения метанола с двойной системой топливоподачи: Монография. — Киров: Вятская ГСХА, 2008. — 154 с.
3. Изменение образования оксидов азота в цилиндре дизеля при работе на метаноле / В. А. Лиханов, А. А. Анфилатов // Тракторы и сельхозмашины. 2015. № 4. С. 3–5.
4. Снижение содержания оксидов азота в отработавших газах дизеля путём применения метанола с использованием двойной системы топливоподачи / В. А. Лиханов, О. П. Лопатин, А. А. Анфилатов // Тракторы и сельхозмашины. 2012. № 5. С. 5–8.
5. Анфилатов А. А. Снижение содержания оксидов азота в отработавших газах дизеля 2Ч 10,5/12,0 путём применения метанола с двойной системы топливоподачи. Диссертация на соискание ученой степени кандидата технических наук / Киров, 2009. — 184с.
6. Улучшение экологических показателей дизеля 2Ч 10,5/12,0 при работе на метаноле / В. А. Лиханов, А. Н. Чувашев, А. А. Глухов, А. А. Анфилатов // Тракторы и сельхозмашины. 2007. № 3. С. 4–5.







