Проведен синтез 5-ацетил-6-метил-3,4-дигидропиримидинона трехкомпонентной реакцией Биджинелли в присутствии различных ионных жидкостей. Исследованы характеры действия катализаторов на выход продуктов, а также рассмотрены зависимости соотношений исходных продуктов и продолжительности проведения реакции.
Ключевые слова: 3,4-дигидропиримидинон, реакция Биджинелли, ионная жидкость, катализатор.
Разработка простых, безопасных, экологических и экономичных путей синтеза для широко используемых органических соединений из легкодоступных реагентов являются одним из основных проблем в органическом синтезе. Производные 3,4-дигидропиримидинонов привлекают в последнее время все большое внимание исследователей — синтетиков [2], что связано с их фармацевтическими свойствами, а также как класс органических веществ с широким спектром биологической активности и как высокоэффективные ключевые соединения для модификации уже существующих биологически активных матриц. Продукты реакции Биджинелли проявляют противоопухолевую [3], антистафилококковую, противовирусную [6], антигипертензивную [8], антиаритмическую [1] активности и являются селективными антагонистами адренорецепторов, а также применяются в борьбе со спидом и сердечнососудистыми заболеваниями.
Успешное лечение сердечно-сосудистых заболеваний и гипертензии не возможно без применения препаратов группы 1,4-дигидропиридинов и их структурных аналогов 3,4-дигидропиримидинонов/тионов. В последние годы они используются в качестве модуляторов кальциевых каналов [7], антигипертензивных препаратов и некоторые алкалоиды начали применять как ингибиторы ВИЧ-GP-120-CD4. Поэтому синтез этого типа гетероциклических соединений имеет большую актуальность.
Описанные в литературе методы получения дигидропиримидинонов являются вариантами хорошо изученной трехкомпонентной реакции Биджинелли, открытой еще в 1893 году. Один из наиболее распространенных методов заключается в многочасовом нагревании реакционной смеси, состоящей из альдегида, ацетоуксусного эфира, мочевины (тиомочевины) и катализатора в среде органического растворителя.
С позиции концепции «Зеленой химии» к недостаткам классического метода можно отнести длительность проведения реакции (до 24 ч), необходимость в больших затратах электроэнергии, применение в качестве катализаторов сильной неорганической кислоты или солей тяжелых металлов [5,9], а также низкий выход продукта (20–60 %) [4] и загрязнение окружающей среды.
Таким образом, существует потребность в универсальных, простых и экологически чистых процессах для синтеза 3,4-дигидропиримидин-2 (1H) — онов.
В данной работе мы синтезировали 5-ацетил-6-метил-4-фенил-3,4-дигидропиримидин-2(1H)-он взаимодействием трехкомпонентной системы — бензальдегида, ацетилацетона и мочевины в присутствии ряда (I-V) зеленых катализаторов.
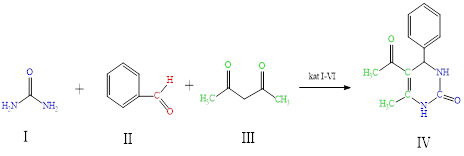
Как известно, подбор селективного катализатора для реакции Биджинелли является главным фактором. Одной из особенностей реакции Биджинелли является способность варьировать исходные реагенты, катализаторы и растворители. Поэтому мы решили исследовать в качестве катализатора для данной реакции следующие ионные жидкости: N-метилпирролидон гидросульфат (N-MPHS), N-формилморфолин гидросульфат (N-FMHS), пиперазин-2,3-дион дигидросульфат (PDHS), диэтиламмоний гидросульфат (DEAHS), диэтиламмоний дигидрофосфат (DEADHP), бутилметилимидазолиум гидросульфат (BMIHS) и сравнить выходы продуктов в зависимости от применяемого катализатора.
Таблица 1
Нахождение оптимальных условий синтеза 5-ацетил-6-метил-4-фенил-3,4-дигидропиримидин-2(1Н)-она в присутствии N-метилпирролидон гидросульфат (N-MPHS)
|
Соотношение исходных продуктов (бензальдегид: ацетилацетон: мочевина) |
Количество катализатора (моль %) |
Продолжительность реакции (мин) |
Выход продукта (%) |
|
1:1:1.5 |
3 |
60 |
76 |
|
1:1:2 |
3 |
60 |
75 |
|
1:1:3 |
3 |
60 |
90 |
|
1:1:1.5 |
3 |
120 |
72 |
|
1:1:2 |
3 |
120 |
75 |
|
1:1:3 |
3 |
120 |
74 |
Вероятно, на первой стадии в присутствии катализатора происходит присоединение мочевины (I) к ароматическому альдегиду (II) с образованием аминокарбинола (III) и с последующей его дегидратацией (IV). На второй стадии предполагается взаимодействие ацетилацетона с N-бензальмочевиной (IV) с образованием незамкнутого уреида (V), который впоследствии циклизуется до целевого продукта (IV).
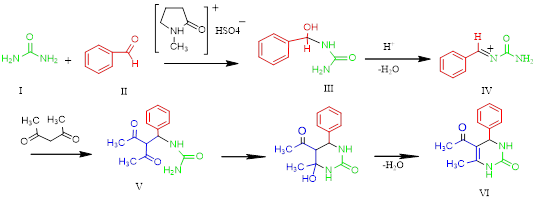
Таблица 2
Сравнение эффективности различных «зеленых» катализаторов в реакции Биджинелли
|
Название катализатора |
Количество катализатора (моль %) |
Продолжительность реакции (мин) |
Выход продукта, (%) |
|
N-MPHS (I) |
3 |
60 |
96 |
|
N-FMHS (II) |
3 |
60 |
86 |
|
PDHS (III) |
3 |
60 |
90 |
|
DEAHS (IV) |
3 |
60 |
62 |
|
DEADHP (V) |
3 |
60 |
53 |
|
BMIHS (VI) |
3 |
60 |
68 |
Экспериментальная часть
Синтез 5-ацетил-6-метил-4-фенил-3,4-дигидропиримидин-2(1Н)-она по реакции Биджинелли проводился между бензальдегидом, ацетилацетоном и мочевиной в присутствии зеленых ионных (I-VI) жидкостей. Исследовался процесс протекания реакции и выход продукта в зависимости от соотношения исходных продуктов, времени проведения реакции и типа использованного катализатора. Соотношения исходных продуктов менялись в пределах 1:1:1.5; 1:1:2; 1:1:3 и реакция проводилась с продолжительностью 1 и 2 часа.
Синтез 5-ацетил-6-метил-4-фенил-3,4-дигидропиримидин-2(1Н)-она.
В круглодонную колбу емкостью 100 мл поместили 1,06 г (10 ммоль) бензальдегида, 1г (10 ммоль) ацетилацетона, 1,8 г (30 ммоль) карбамида и 3 моль % (I-VI) ионной жидкости. Реакционную смесь перемешивали одновременно нагревая при 800С в течение часа. С помощью тонкослойной хроматографии проверялся ход реакции. Обработка реакционной смеси осуществлялась путем промывания реакционной смеси ледяной водой, выпавший осадок отфильтровывали, промывали 500 мл водой, высушивали, перекристаллизовывали из этанола (75мл).
Идентификацию химического строения 5-ацетил-6-метил-4-фенил-3,4-дигидропиримидин-2(1Н)-она проводили на приборе ИК-Фурье спектрометра ALPHA (фирма BRUKER Германия) в диапазоне волновых частот 600–4000см-1 на кристалле SeZn и спектры ЯМР 1Н и 13С регистрировали на приборе Bruker Fourier 300МГц), растворитель — DMSO-d6, химические сдвиги приведены относительно DMSO-d6.
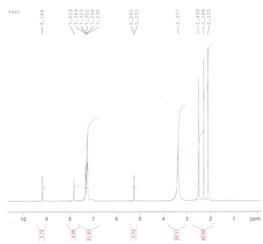
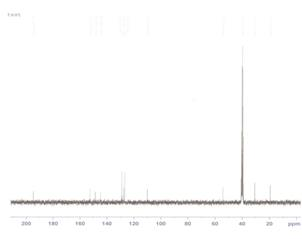
Рис.1.a) 1Н и б) 13С ЯМР спектров 5-ацетил-6-метил-4-фенил- 3,4-дигидропиримидин-2(1Н)-он.
5-ацетил-6-метил-4-фенил-3,4-дигидропиримидин-2(1Н)-он
Т.пл. 209–211°C; ИК: (SeZn): ν (см-1) 3252.96 (NH), 3116.24, 2919.90, 169 (C=O), 1672.05, 1592.82, 1446.37, 1415.00, 1372.68, 1324.15, 1266.99, 1230 (C-N), 1134.00, 1105.46, 1071.10, 1026.98, 994.48, 961.28, 817.62, 759.55, 696.80, 660.64. ЯМР ¹H Bruker, 300 MHz, DMSO-d6, δ м.м.): 9.184 (с, 1H, NH-C=O); 7.829 (с, 1H Ph-C-NH); 7.34–7.23 (м,5H, Ar); 5.262 (с, 1H, Ph-CH); 2.286 (с, 3H,CH3-C=O); 2.101 (с, 3H, =C-CH3). ЯМР 13C (DMSO-d6, δ, м.м): 19.37, 30.79, 54.25, 110.04, 126.88, 127.81, 128.98, 144.69, 148.61, 152.60, 194.74.
Выводы
Эксперименты показали, что в присутствии использованных катализаторов выходы 5-ацетил-6-метил-4-фенил-3,4-дигидропиримидин-2 (1Н)-она колеблются в пределах от 53–86 %, но с участием катализатора (3 % ммоль) N-метилпирролидон гидросульфата выход составляет 96 % соответственно и катализатор может быть использован повторно без потери каталитической активности 5 раза.
Литература:
1. Grover G. J., Dzwonczyk S., Mc Mulltn D. M., Normadinam C. S., Moreland S. J. // J.Cardio-vasc.Pharma-col.1995,-V.26, p. 289.
2. Kappe С. O. 100 Years of the Biginelli Dihydropyrimidine Synthesis. // Tetrahedron. — 1993. — 49, № 32. — P. 6937–6963.
3. Kappe C. O. Recent Advances in the Biginelli Dihydropyrimidine Synthesis. New Tricks from an Old Dog // Acc. Chem. Res., (2000) № 33, p. 879–888. а) C. O. Kappe, Tetrahedron 1993, 49, 6937–6963,
4. Karade H. N., Sathe M., Kaushik M. P. Synthesis of 4-aril substituted 3,4-dihydropyrimidinones using silica-chloride under solvent free condition //Molecules. 2007. N 12. P. 1341–1351.
5. Lu J., Bai Y. Catalysis of the Biginelli reaction by ferric and nickel chloride hexahydrates. One-pot Synthesis of 3,4-dihydropyrimidin-2-(1H)-ones // Synthesis. 2002. N 4. P. 466–470.
6. Rovnyak G. C., Kimball S. D., Beyer B., Cucinotta G., DiMarco J. D., Gougoutas J., Hedberg A., Malley M., McCarthy J. P., Zhang R. and Moreland S. J., “Calcium Entry Blockers and Activators: Conformational and Structural Determinants of Dihydro-Pyrimidine Calcium Channel Modulators,” Journal of Medicinal Chemistry, Vol. 38, No. 1, 1995, pp. 119–129.
7. Rovnyak G. C., Kimball S. D., Bever B., J. Med. Chem., 1995, 38, 119, (18–22)
8. Sharma P., Synthesis and QSAR studies of pyrimido4,5pyrimidine-2,5-dione derivatives as potential antimicrobial agents / P. Sharma, N. Rane, V. K. Gurram // Bioorg. Med. Chem. Lett. 2004. -Vol. 14, № 16. — P. 4185 -4190.
9. Sharma S. D., Gokoi P. G., Konwar D. A highly efficient and green method for the synthesis of 3,4-dyhydropyrimidin-2-ones and 1,5-benzodiazepines catalyzed by dodecyl sulfonic acid in water // The Royal Society of Chemistry. 2006. N 6. P. 61–72.







